Реабилитация больных, перенесших инсульт, — важнейшая медицинская задача. На сегодняшний день одной из причин резистентности таких пациентов к реабилитации является отсутствие патофизиологически обоснованных факторов, определяющих индивидуальный реабилитационный прогноз, на основании которых больные могли бы быть распределены в реабилитационные подгруппы. В связи с этим, несмотря на интенсивные попытки улучшить функциональные исходы после инсульта, восстановления психомоторных функций у больных часто не происходит. Понимание причин и механизмов «плохих исходов» в реабилитации, безусловно, позволит своевременно на них воздействовать.
Цель исследования: установление объективных параметров для оценки реабилитационного прогноза у больных с острым нарушением мозгового кровообращения.
МАТЕРИАЛЫ И МЕТОДЫ
Обследованы в динамике 203 пациента, перенесших инсульт, которые проходили реабилитацию в Московском научно-практическом центре медицинской реабилитации, восстановительной и спортивной медицины Департамента здравоохранения города Москвы в период с 2012 по 2015 г.
В исследование включены больные трех групп: с ишемическим инсультом (ИИ) полушарной локализации — 133 человека (65,5%); с ИИ стволовой локализации — 40 (19,7%); с внутримозговой гематомой полушарной локализации (геморрагический инсульт — ГИ) — 30 (14,8%). По генезу внутримозговой гематомы пациенты с ГИ были распределены следующим образом: 90% (n = 27) — больные с гематомами гипертензионного генеза; 10% (n = 3) — больные с субарахноидальным кровоизлиянием (тип субарахноидально-паренхиматозный) неустановленной этиологии без нейрохирургических операций в анамнезе.
Критериями исключения являлись: противопоказания к применению методов исследования; кардиоэмболический генез инсульта; имплантированные стимуляторы; наличие в анамнезе психических заболеваний, алкогольной или наркотической зависимости, эпилепсии; гидроцефалия, служащая показанием к хирургическому лечению; стенозы магистральных артерий головы и шеи, при которых также показано хирургическое лечение; ГИ, сопровождавшийся формированием внутримозговой гематомы, подлежавшей хирургическому лечению; грубые афазические расстройства, значимо затруднявшие вербальный контакт; наличие в анамнезе ЧМТ средней и тяжелой степени.
Клинико-демографическая характеристика групп больных представлена в таблице 1, характеристика больных в группах по результатам инструментальных методов исследования — в таблице 2.
Таблица 1
Клинико-демографическая характеристика групп больных с инсультом
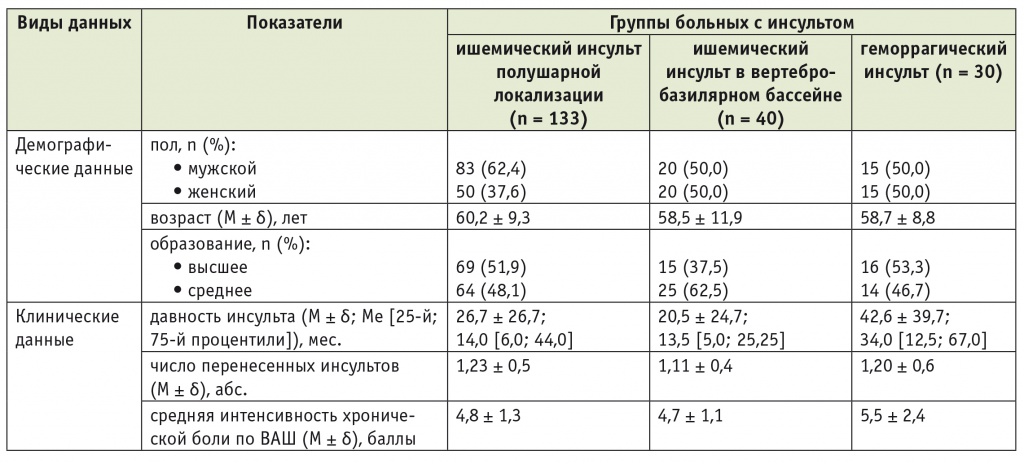
Примечание. Здесь и в последующих таблицах ВАШ — визуальная аналоговая шкала.
Таблица 2
Характеристика больных в группах по результатам инструментальных методов исследования
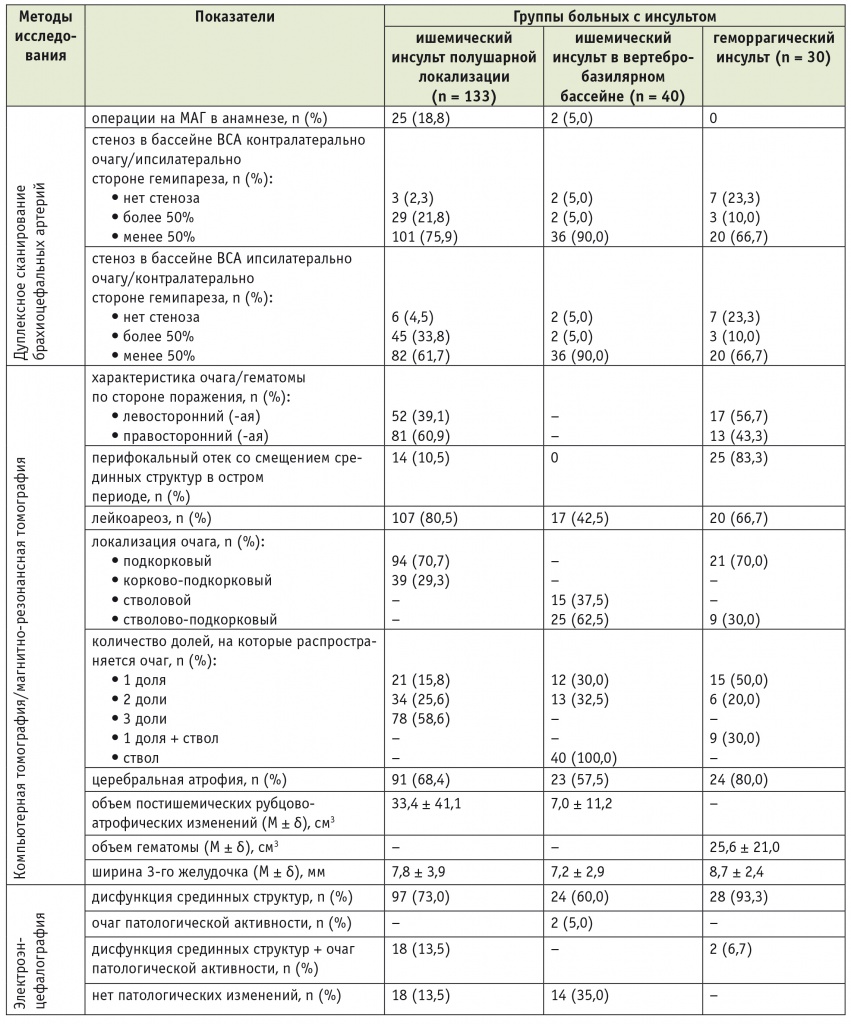
Примечания.
1. У пациентов с ишемическим инсультом в вертебро-базилярном бассейне (ВББ) основным являлось поражение ствола головного мозга, имевшееся в 100% случаев. При наличии детализированных нейровизуализационных данных дополнительно указывали количество долей (близлежащих отделов полушарий, кровоснабжаемых из ВББ), на которые распространялся ишемический очаг, что учитывалось при статистическом анализе.
2. Здесь и в последующих таблицах ВСА — внутренняя сонная артерия; МАГ — магистральные артерии головы.
Осмотр пациентов включал сбор жалоб (определяли наличие, интенсивность по визуальной аналоговой шкале (ВАШ) и длительность болевого синдрома), неврологическое обследование, расширенное нейропсихологическое тестирование, оценку по общим и локальным метрическим реабилитационным шкалам (в частности, применяли клиническую шкалу «Реабилитационный профиль активностей» в динамике для контроля эффективности реабилитации) [1].
При сборе анамнеза выявляли наличие у больных операций на магистральных артериях головы. Пациентам, перенесшим инсульт, были проведены МРТ и/или КТ головного мозга, дуплексное сканирование брахиоцефальных артерий, ЭЭГ, исследование эндогенных вызванных потенциалов головного мозга в динамике для оценки эффективности реабилитации.
Во время нейровизуализации определяли наличие перифокального отека головного мозга, сопровождавшегося смещением срединных структур в остром периоде инсульта, а также наличие перивентрикулярного лейкоареоза и церебральной атрофии; локализацию очага (ишемии или внутримозговой гематомы); количество долей головного мозга, на которые распространялся очаг; объем рубцово-атрофических изменений и внутримозговой гематомы; ширину 3-го желудочка.
В ходе дуплексного сканирования брахиоцефальных артерий оценивали степень стеноза магистральных артерий головы (внутренней сонной артерии — ВСА) ипси- и контралатерально очагу, локализации гематомы или стороне гемипареза.
При ЭЭГ, проводившейся в подостром или хроническом периоде инсульта, уточняли наличие дисфункции срединных структур головного мозга и патологической очаговой активности (медленноволновой).
Больные c инсультом, включенные в исследование, проходили реабилитацию в стационаре. Первичное обследование им выполняли до начала, а повторное — по окончании реабилитационного курса (в среднем через 1 месяц). Последний предусматривал индивидуальные и групповые занятия лечебной физкультурой, механотерапию, ручной массаж конечностей (по показаниям), занятия с нейропсихологом и трудотерапию (по показаниям). Занятия были направлены на выработку оптимального двигательного стереотипа, улучшение адаптации к повседневной жизни, активизацию моторных функций.
Статистическую обработку полученных данных производили с использованием стандартного пакета статистических программ SPSS версии 13. Достоверными считали различия при значении p < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При проведении однофакторного регрессионного и дисперсионного статистического анализа были выявлены основные факторы, достоверно влияющие на состояние психомоторных функций у больных, перенесших инсульт: возраст; уровень образования; давность инсульта; характер патологического процесса в головном мозге (тип инсульта); наличие хронической боли; локализация (полушарная/стволовая, правосторонняя/левосторонняя), распространенность и объем очага (рубцово-атрофические постишемические изменения, гематома); наличие и выраженность стенозов в бассейне ВСА контра- и ипсилатерально очагу; церебральная атрофия (диагностируемая по ширине 3-го желудочка); лейкоареоз; операции на магистральных артериях головы в анамнезе; очаговые патологические изменения на ЭЭГ; перифокальный отек головного мозга, сопровождавшийся смещением срединных структур в остром периоде инсульта, число перенесенных инсультов. В таблице 3 приведены, например, результаты однофакторного анализа неблагоприятных прогностических параметров у пациентов с ИИ в вертебробазилярном бассейне (ВББ).
Таблица 3
Однофакторный анализ прогностических параметров, определяющих ухудшение нейрофизиологических коррелятов психомоторных функций, у больных с ишемическим инсультом в вертебробазилярном бассейне после лечения
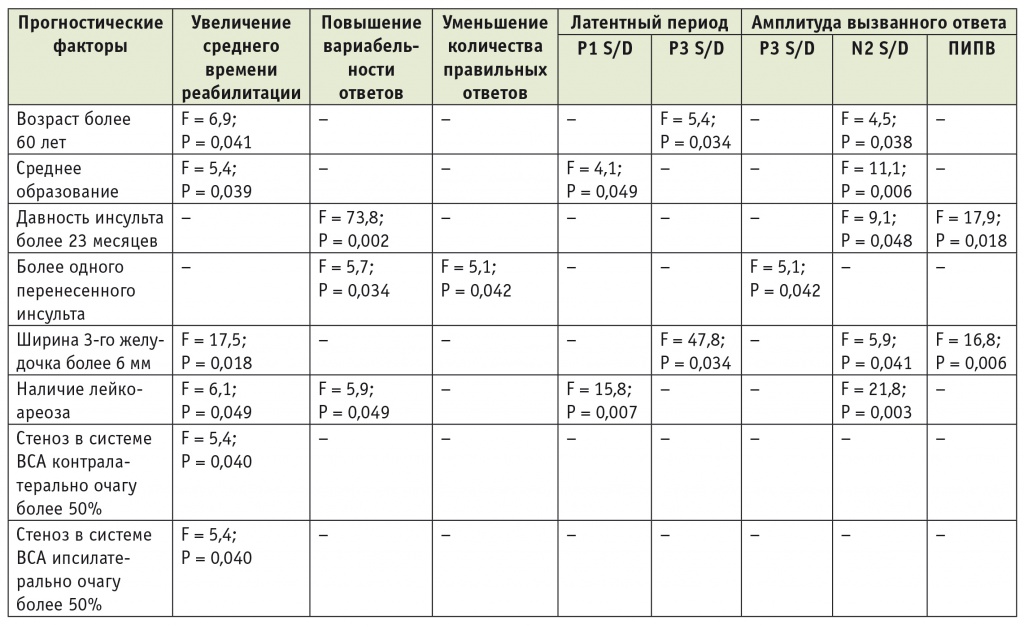
Примечания.
1. ПИПВ — постимперативная положительная волна; P1, P3, N2 — основные компоненты вызванных ответов; S, D — регистрация ответов слева и справа соответственно; F, P — статистические показатели.
2. Статистически обработанные данные оценивали как достоверные, согласно нормам математической статистики, при вероятности ошибки (р) < 0,05 (что соответствует 95%-ному ДИ при построении «диаграммы рассеяния»).
В зависимости от наличия установленных основных факторов риска, обусловливающих состояние психомоторных функций до и после реабилитации, мы распределили больных по реабилитационным подгруппам (табл. 4–6). Каждая из них имела определенные характеристики неврологического, нейропсихологического статуса, результаты по локальным и общим реабилитационным шкалам.
Таблица 4
Распределение больных с ишемическим инсультом полушарной локализации по реабилитационным подгруппам в зависимости от наличия установленных значимых прогностических факторов
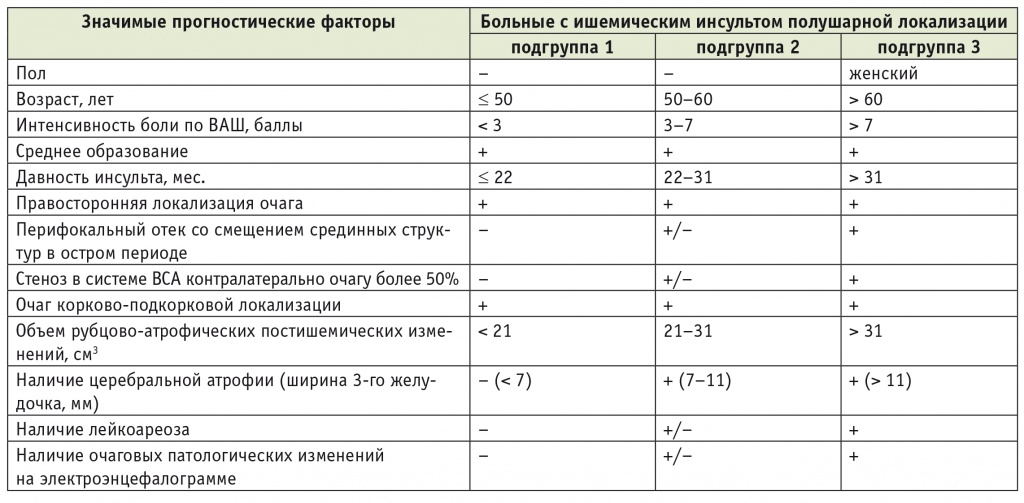
Примечание. В таблицах 4–6: (+) — наличие фактора; (–) — отсутствие фактора; (+/–) — наличие или отсутствие фактора.
Таблица 5
Распределение больных с ишемическим инсультом в вертебробазилярном бассейне по реабилитационным подгруппам в зависимости от наличия установленных значимых прогностических факторов
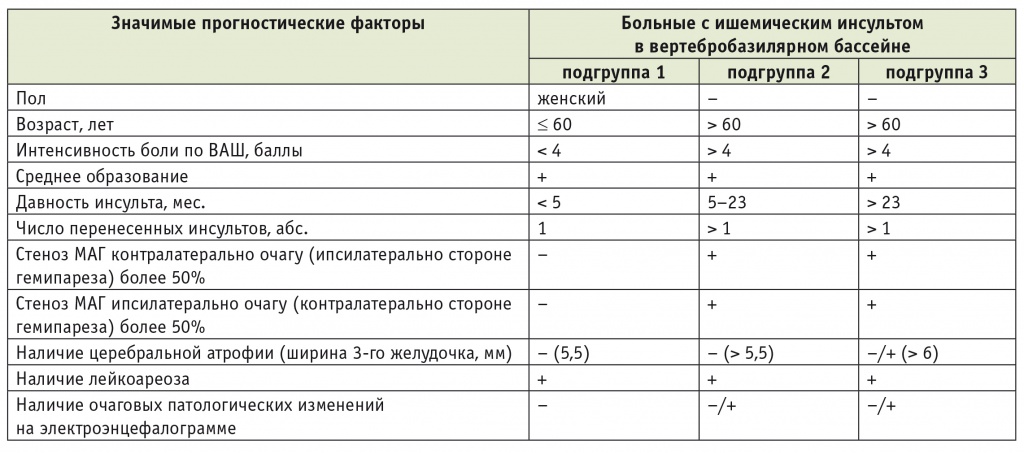
Таблица 6
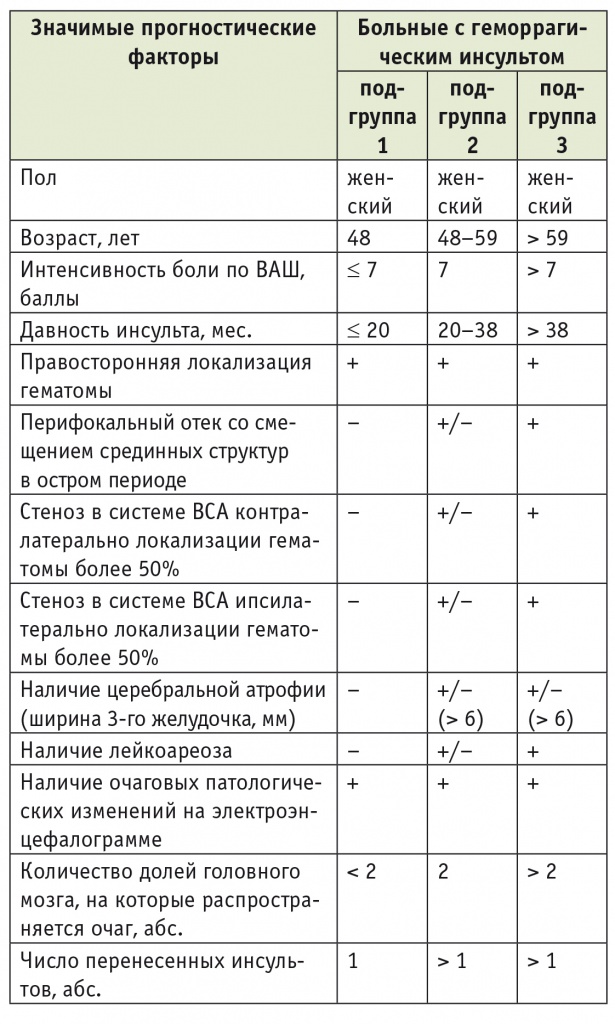
Распределение больных с геморрагическим инсультом по реабилитационным подгруппам в зависимости от наличия установленных значимых прогностических факторов
Так, установлено, что в подгруппе больных с ИИ полушарной локализации, у которых возраст составляет 50 лет и менее, интенсивность боли по ВАШ ниже 3 баллов, давность инсульта — 22 месяца и менее, объем рубцово-атрофических постишемических изменений не достигает 21 см3, частично представлены другие неблагоприятные прогностические факторы (среднее образование, правосторонняя локализация очага, корково-подкорковое расположение очага), а средний суммарный балл по «Реабилитационному профилю активностей» до лечения был 12,9 ± 7,1, вероятность клинически значимого улучшения психомоторных функций на фоне реабилитации равна 50%.
В подгруппе больных с ИИ полушарной локализации, которые находятся в возрасте 50–60 лет, характеризуются интенсивностью хронической боли по ВАШ 3–7 баллов, давностью инсульта от 22 до 31 месяца, объемом рубцово-атрофических постишемических изменений 21–31 см3, частичной представленностью других неблагоприятных прогностических факторов (среднее образование, правосторонняя локализация очага и корково-подкорковое расположение очага, а также наличие перифокального отека, сопровождавшегося смещением срединных структур головного мозга в остром периоде инсульта, стеноз в системе ВСА контралатерально очагу поражения более 50%, перивентрикулярный лейкоареоз, очаг патологических медленноволновых изменений на ЭЭГ, церебральная атрофия) и средним суммарным баллом по «Реабилитационному профилю активностей» до лечения 17,3 ± 9,4, вероятность клинически значимого улучшения психомоторных функций на фоне реабилитации близка к 40%.
В группе ИИ в ВББ в подгруппе больных, у которых возраст не превышает 60 лет, интенсивность боли по ВАШ ниже 4 баллов, давность инсульта менее 5 месяцев, частично представлены другие неблагоприятные прогностические факторы (среднее образование, наличие перивентрикулярного лейкоареоза), а средний суммарный балл по «Реабилитационному профилю активностей» до лечения — 4,3 ± 4,9, вероятность клинически значимого улучшения психомоторных функций на фоне реабилитации достигает 95%.
В этой же группе в подгруппе больных в возрасте старше 60 лет, с интенсивностью боли по ВАШ более 4 баллов, давностью инсульта от 5 до 23 месяцев, частичной представленностью других неблагоприятных прогностических факторов (среднее образование, наличие перивентрикулярного лейкоареоза, повторный инсульт, стенозы в системе ВСА ипси- и контралатерально стороне гемипареза более 50%) и средним суммарным баллом по «Реабилитационному профилю активностей» до лечения 15,4 ± 8,1 вероятность клинически значимого улучшения психомоторных функций на фоне реабилитации снижается до 40–50%.
В первой и во второй подгруппах больных с ГИ, где средний суммарный балл по «Реабилитационному профилю активностей» до лечения составил 18,2 ± 12,7 и 19,8 ± 4,9 соответственно, вероятность клинически значимого улучшения психомоторных функций на фоне реабилитации не превышает 40%.
Третьи подгруппы во всех группах составили больные с максимальной представленностью основных неблагоприятных прогностических факторов, у которых отсутствовало клинически значимое улучшение психомоторных функций на фоне реабилитации.
При проведении статистического анализа были определены ранги основных факторов, определяющих функциональный резерв и реабилитационный прогноз, у больных разных групп при психомоторной реабилитации (табл. 7).
Таблица 7
Распределение прогностических факторов по значимости в группах больных с инсультом
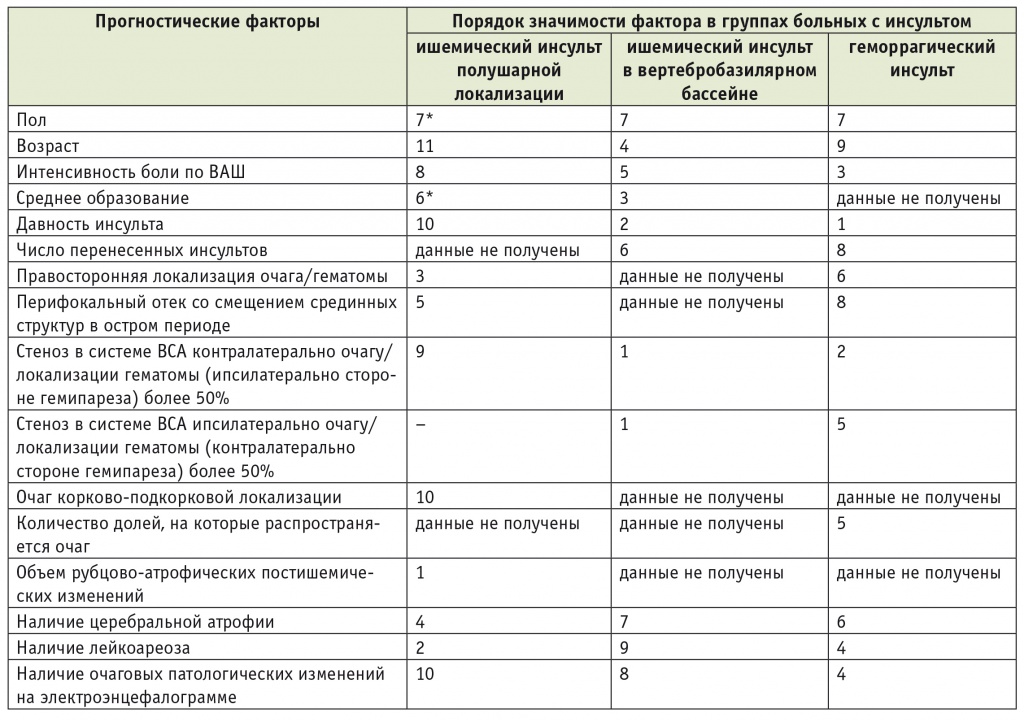
Примечание. Ранги значимости (порядок значимости) прогностических факторов для наглядности представлены в виде абсолютных значений после обработки данных методами многофакторного регрессионного анализа, расчета коэффициента конкордации и определения коэффициента ранговой корреляции Спирмена (базовая гипотеза была сформулирована на основании результатов однофакторного регрессионного и дисперсионного методов анализа). Факторы, обозначенные знаком «*», имеют недостоверные различия по значимости в рассматриваемой выборке и могут приниматься в порядковой нумерации за равные. При сравнительной корреляции с другими группами указанным факторам соответствует значение 7.
Выявленные различия в значимости основных факторов, определяющих функциональное психомоторное состояние больных, обусловлены различиями в патогенезе симптомов при ишемическом и геморрагическом инсульте, разной чувствительностью полушарий и стволовых структур головного мозга к острым и хроническим гипоксическим воздействиям.
Следует отметить, что механизм развития лейкоареоза является единым для больных с разными типами инсульта (перивентрикулярная демиелинизация, возникающая вследствие хронической гипоксии при поражении мелких перфорирующих артерий головного мозга). Наличие перивентрикулярного лейкоареоза выступает в качестве одного из ведущих факторов, определяющих состояние функциональных резервов у больных с ИИ полушарной локализации и у больных с ГИ.
Таким образом, при анализе данных, полученных в результате проведенного исследования, мы установили, что в каждой из групп пациентов (с ИИ полушарной локализации, ИИ в ВББ и с ГИ) могут быть выделены три подгруппы, в которых в разной степени представлены факторы риска неблагоприятного прогноза на восстановление. В литературных источниках имеются отдельные указания на комбинацию различных факторов риска, но четкие данные с выделением подгрупп больных отсутствуют [2, 5, 6].
Значение пораженного полушария в ранее проведенных исследованиях обсуждалось, как правило, в связи с большей подверженностью психологическим проблемам больных с правополушарными поражениями. Мы установили, что правополушарная локализация инсульта (как ишемического, так и геморрагического) является независимым неблагоприятным прогностическом фактором [3, 4].
В настоящее время наблюдается тенденция к пересмотру сроков так называемого реабилитационного периода (т. е. периода, в течение которого возможно истинное восстановление функции, утраченной или сниженной в результате инсульта) [7, 8]. Согласно полученным нами данным, давность инсульта имеет независимое влияние на исход реабилитации. Принятый в настоящее время период, когда больной считается перспективным в плане восстановления на фоне реабилитации, — 2 года с момента инсульта — подтвержден нами для больных с ИИ в ВББ. У пациентов с ИИ полушарной локализации, по нашим данным, реабилитационный период возрастает до 31 месяца с момента инсульта, а у пациентов с ГИ — до 38 месяцев.
Установлен спектр факторов риска неблагоприятного прогноза на восстановление у больных с ГИ и инсультом в ВББ, ранее не обсуждавшийся в литературных источниках. Так, определено, что при ГИ таким фактором может быть наличие распространенного перивентрикулярного лейкоареоза, имеющего иные, чем у основного поражения, патогенетические механизмы.
Для больных с ИИ в ВББ выявлено первостепенное прогностическое значение стенозов ипси- и контралатерально стороне гемипареза более 50% в системе ВСА. Последняя обеспечивает артериальное кровоснабжение полушарий головного мозга и по особенностям функционирования отличается от артерий ВББ. Тем не менее, несмотря на развитие инсульта в другом бассейне, наличие стенозов в системе ВСА по прогностической значимости занимает первое место.
Впервые определены ранги значимости для каждого прогностического фактора в каждой из групп больных. Доказана существенная роль типа инсульта, а также поражения различных по филогенетической давности структур головного мозга (ствол, полушария).
ЗАКЛЮЧЕНИЕ
Выделение реабилитационных подгрупп позволяет дифференцированно подходить к оценке прогноза восстановления. Описание «клинического портрета» каждой подгруппы, по сути, представляет собой перечень ключевых проблем больного и является основой для создания индивидуальной программы реабилитации.








