Глутамат — основной возбуждающий, или активирующий, церебральный нейротрансмиттер. Активация глутаматергической системы — универсальный механизм, активизирующийся как при нормальных, физиологических, так и при патологических процессах[3, 4, 20]. В основе действия глутамата лежит активация мембранных нейрональных рецепторов, она приводит к тому, что ионы кальция входят внутрь нейрона и заряд мембраны нервной клетки изменяется[26, 28].
Различают два типа глутаматных рецепторов — ионотропные и метаботропные. Ионотропные рецепторы, в свою очередь, подразделяются на три подтипа: α-амино-3-гидрокси-5-метил-4-изоксазолепропионатные (AMPA), каинатные и N-метил-D-аспартатные (NMDA)[26]. Имеется некоторое различие в действии ионотропных рецепторов: так, AMPA- и каинатные рецепторы изменяют заряд мембраны нейрона быстро, в то время как NMDA-рецепторы начинают свою работу значительно медленнее и медленнее же ее заканчивают, что приводит к долгой гиперполяризации и деполяризации мембраны нейрона.
При естественной работе мозга активность NMDA-рецепторов тесно связана с обучением человека, в частности с поддержанием достаточного уровня внимания, качеством запоминания информации, скоростью психических процессов[4, 15]. При активации NMDA-рецепторов опосредованно усиливается деятельность большинства нейрохимических систем мозга, в том числе ацетилхолинергической, дофаминергической, серотонинергической. Следствиями этого являются более качественное выделение значимой информации из общего потока, ее лучшая фиксация, более быстрое и полное последующее извлечение при необходимости. Многомодальное действие и широкая связь системы глутамата с другими медиаторными церебральными системами позволяют предположить, что препараты, оказывающие влияние на NMDA-рецепторы, будут полезны при различных заболеваниях, сопровождающихся когнитивными нарушениями в результате поражения тех или иных зон головного мозга и, как следствие, тех или иных нейромедиаторных систем.
При патологических состояниях, например церебральной ишемии или нейродегенерации, активация NMDA-рецепторов обычно лежит в основе гибели нервных клеток. Механизм гибели нейронов в этих случаях обозначается как апоптоз (программированная клеточная смерть)[7]. Генетически неполноценная клетка или клетка, находящаяся в условиях длительного токсического воздействия либо ишемии, в случае избыточной стимуляции NMDA-рецепторов накапливает значительное число ионов кальция на внутренней стороне мембраны; при долгом открытии ионных каналов это приводит к дополнительному входу в нейрон воды, разбуханию и последующей гибели нервной клетки. Данный универсальный механизм встречается при самых разнообразных заболеваниях головного мозга, в том числе при острых и хронических нарушениях мозгового кровообращения, ЧМТ, церебральных дегенерациях[3, 4, 12, 13, 22]. Сходные процессы описаны и при нормальном, физиологическом, старении: с момента рождения человека гены — индукторы апоптоза устраняют функционально неактивные клетки, этот естественный механизм является основным при старении и последующей смерти.
Важную роль при гибели клеток головного мозга как при сосудистом, так и при нейродегенеративном его поражении играет окислительный, или оксидативный, стресс. Ишемия, токсическое воздействие на клетку или иные факторы приводят к развитию митохондриальной дисфункции с последующей активацией процессов перекисного окисления липидов и образованием свободных радикалов[4, 7, 18, 22]. Свободные радикалы, в свою очередь, оказывают непосредственное токсическое действие на нейрон и играют роль катализатора при уже текущем патологическом процессе.
При болезни Альцгеймера (БА) оксидативный стресс имеет еще одно патологическое свойство: в условиях церебральной ишемии или окислительного стресса при данном заболевании ускоряется отложение амилоидного белка. Последний представляет собой в норме не образующееся соединение, состоящее из 42 аминокислот, которое оказывает непосредственное токсическое действие на нервные клетки[13, 17, 18]. Амилоидный белок изначально откладывается в местах, богатых ацетилхолином: некоторые ферменты, участвующие в метаболизме ацетилхолина, в частности бутирилхолинэстераза, стимулируют отложение амилоидного белка. Тропность амилоида к структурам мозга, богатым ацетилхолином, обуславливает клинические проявления БА, а именно раннее и наиболее грубое страдание памяти при этом заболевании. Известно, что внимание, необходимое для активного запоминания информации, консолидация следа памяти, а также последующее извлечение информации имеют ацетилхолинергическую медиацию[2, 4, 11, 17]. В свою очередь, амилоидный белок способен активировать NMDA-рецепторы или увеличивать их чувствительность, что создает замкнутый круг с непрерывным развитием патологического процесса[28].
Активизация амилоидогенеза при БА как следствие работы ферментов, участвующих в метаболизме ацетилхолина, и ускорение клеточной гибели вследствие активации системы глутамата взаимно дополняют и усиливают друг друга. В одной из ранних статей, посвященных патогенезу БА, авторы образно написали, что «…глутамат может быть исполнителем нейродегенеративного процесса, а холинергические нейроны — одной из его жертв»[14]. Таким образом, замедления прогрессии БА следует ожидать как при назначении ингибиторов ацетилхолинэстеразы (АХЭС), так и при использовании антагонистов NMDA-рецепторов.
Антагонист NMDA-рецепторов мемантин (1-амино-3,5-диметил-адамантан) под торговым названием Акатинол Мемантин был зарегистрирован в Германии в 1978 г., основными показаниями к его назначению являлись болезнь Паркинсона и спастичность при различных неврологических заболеваниях. Открытие ключевого механизма действия препарата состоялось лишь 10 лет спустя[28, 29], с того времени многочисленные клинические исследования убедительно показали его эффективность в лечении когнитивных расстройств различной этиологии[2–5, 10, 14, 29, 34].
Наиболее ранние исследования были проведены у пациентов с деменцией сосудистой и нейродегенеративной природы умеренной и тяжелой степени выраженности[10, 16, 27, 31, 32, 34]. Многочисленные клинические, преимущественно двойные слепые рандомизированные плацебо-контролируемые, исследования убедительно показали эффективность мемантина в лечении как сосудистой деменции, так и БА (табл. 1). Эффективность лечения подтверждалась не только уменьшением выраженности когнитивных нарушений, но и положительной динамикой поведенческих расстройств, улучшением адаптации пациентов, снижением потребности в психотропных препаратах. Фармакоэкономические исследования продемонстрировали, что при применении мемантина значимо сокращаются прямые и непрямые расходы на лечение: снижается потребность в других лекарственных средствах, уменьшается время, необходимое для ухода за пациентом, укорачиваются сроки госпитализации и т. д.
Таблица 1
Клинические исследования эффективности мемантина при деменции различной природы[11, 19, 30]
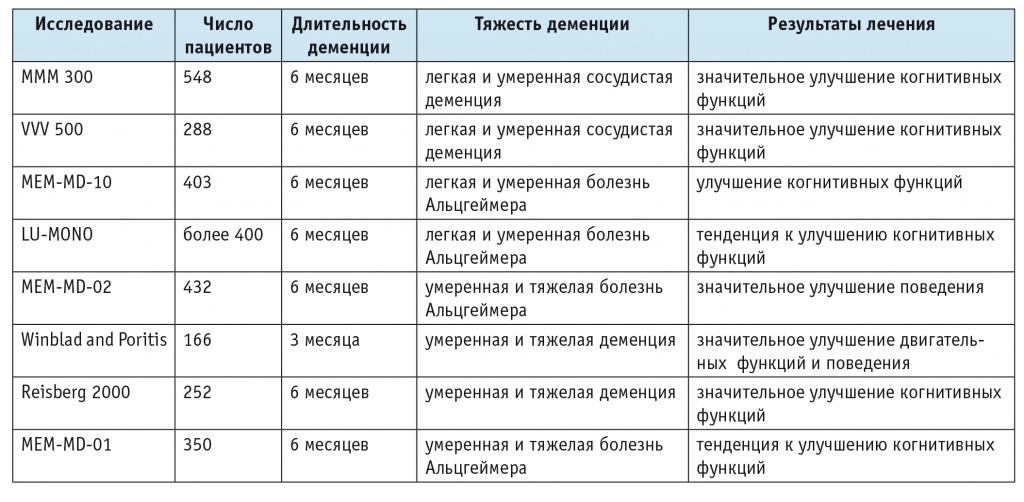
Полученные результаты легли в основу всемирно принятых рекомендаций[2, 4, 17, 34], согласно которым для лечения БА на стадиях легкой и умеренной деменции препаратами выбора являются ингибиторы АХЭС, в то время как для лечения сосудистой деменции, особенно на умеренной и тяжелой стадиях, а также у пациентов с умеренной и тяжелой БА следует использовать антагонисты NMDA-рецепторов. В последующих исследованиях антагонисты NMDA-рецепторов продемонстрировали свою эффективность и у пациентов с БА на стадиях легкой и умеренной деменции[5, 9, 11, 19, 30]. Было отмечено также их значимое положительное влияние на выраженность когнитивных расстройств у пациентов с легкой и умеренной деменцией сосудистой этиологии. В то же время исследования не показали убедительного эффекта ингибиторов АХЭС у пациентов с сосудистой деменцией. В результате антагонисты NMDA-рецепторов стали препаратами выбора при сосудистой деменции, БА умеренной и тяжелой степени выраженности и препаратами, возможными к применению при БА легкой и умеренной степени.
По данным исследований, как у пациентов с БА, так и у больных сосудистой деменцией улучшение начинается уже через 2 недели после завершения подъема дозы мемантина[3–5, 19, 31, 33]. В дальнейшем динамика когнитивных функций различается: при БА обычно происходит уменьшение выраженности когнитивных нарушений в течение 3–6 первых месяцев лечения с последующей стабилизацией когнитивных нарушений; при сосудистой деменции возможно уменьшение выраженности когнитивных расстройств и на более поздних сроках лечения.
Интересные результаты получены при сравнительном анализе эффективности мемантина у пациентов с БА, сосудистой и смешанной деменцией[5]. В этом исследовании максимальная клиническая эффективность мемантина у пациентов с БА достигалась на 3-м месяце лечения, сохранялась до 6-го месяца, затем происходило постепенное нарастание выраженности когнитивных нарушений. У пациентов с сосудистой и, особенно, со смешанной деменцией эффект также был достигнут через 3 месяца от начала лечения, но затем когнитивные симптомы продолжали уменьшаться в течение последующего периода наблюдения. Наибольшая эффективность препарата отмечалась при сочетании БА и сосудистых факторов риска[5]. Можно выдвинуть две гипотезы, объясняющие преимущественное действие мемантина у этой группы пациентов: 1) препарат одновременно влияет на дефицит ацетилхолина и церебральную ишемию; 2) играет роль тот факт, что при сочетании церебральной и нейродегенеративной патологии обычно усиливается выраженность когнитивных нарушений, тогда как сами патологические процессы, как правило, бывают менее выраженными, чем только церебральная нейродегенерация (без сосудистого поражения головного мозга) или только церебральная ишемия (без нейродегенерации) с аналогичной степенью когнитивных расстройств.
Следует подробно обсудить возможности применения мемантина у пациентов с деменцией с тельцами Леви (ДТЛ) — второй после БА по частоте встречаемости нейродегенеративной деменцией, клинически проявляющейся сочетанием паркинсонизма, деменции, зрительных галлюцинаций и колебаний выраженности когнитивных, двигательных и поведенческих симптомов (так называемых флюктуаций)[6, 21, 23–25]. Описан выраженный ацетилхолинергический дефицит при этом заболевании, предположительно именно грубая недостаточность ацетилхолина лежит в основе развития как когнитивных и психических симптомов, так и флюктуаций[25]. В этой связи основными препаратами, рекомендованными для лечения ДТЛ, являются представители группы ингибиторов АХЭС.
Нами выполнено исследование эффективности мемантина у больных ДТЛ[6, 8]. В исследование были включены 30 пациентов с вероятной ДТЛ (16 мужчин и 14 женщин) и 15 пациентов с БА (6 мужчин и 9 женщин). Средний возраст больных составил 73,5 ± 2,8 года в группе ДТЛ и 65,3 ± 4,9 года в группе БА. Эффективность мемантина анализировали с помощью стандартных нейропсихологических шкал через 1,5; 3; 6 месяцев лечения.
Уже через 1,5 месяца приема мемантина у пациентов с БА статистически значимо уменьшилась выраженность когнитивных нарушений (р < 0,05). Наибольшую положительную динамику продемонстрировали ориентация, запоминание предъявляемого материала, прямой и обратный счет (р < 0,05). Отмечались уменьшение выраженности нарушений внимания (р = 0,013) и мнестических расстройств (р = 0,023), некоторое нарастание беглости психических процессов (р = 0,038). На фоне лечения мемантином у пациентов с БА было достигнуто небольшое, но значимое снижение выраженности лобной дисфункции (р = 0,048). На 3-м и 6-м месяцах лечения ни позитивной, ни негативной динамики когнитивных нарушений у больных БА не обнаружено.
У пациентов с ДТЛ через 1,5 месяца лечения мемантином также наблюдалось статистически значимое уменьшение выраженности когнитивных нарушений (р < 0,05). Положительная динамика была отмечена прежде всего в отношении выраженности зрительно-пространственных расстройств (p = 0,012), беглости психических процессов (р = 0,015), инициации психической деятельности (р = 0,011). В меньшей степени снижалась выраженность мнестических нарушений (р = 0,034). На 3-м и 6-м месяцах лечения у пациентов с ДТЛ, в отличие от больных БА, происходило дальнейшее значимое уменьшение выраженности когнитивных нарушений, что проявлялось в снижении выраженности лобной дисфункции (p < 0,05) и зрительно-пространственных нарушений (p < 0,05), увеличении беглости речи (p < 0,05), нарастании темпа нейродинамических процессов (p < 0,05).
Сравнительный анализ эффективности терапии мемантином при ДТЛ и БА показал, что на фоне лечения у больных БА более выраженную позитивную динамику имеют ориентация в пространстве и времени (р = 0,034), мнестические нарушения (р = 0,022), диспраксия (р = 0,018), в то время как у пациентов с ДТЛ более значительный эффект достигается в отношении зрительно-пространственных функций (р = 0,008), внимания (р < 0,001), инициации психической деятельности (р = 0,003), беглости речи (р = 0,015), способности к обобщению (р = 0,019) и выстраиванию программы действия (р = 0,035).
При изучении возможного влияния терапии мемантином на частоту развития и тяжесть галлюцинаций нами обнаружено, что у пациентов с ДТЛ, принимающих и не принимающих мемантин, галлюцинации развиваются одинаково часто, однако выраженность их на фоне лечения мемантином значимо меньше (р = 0,012).
Серьезного внимания заслуживает вопрос о перспективности применения мемантина у пациентов с когнитивными нарушениями при болезни Паркинсона. Исследования, проведенные среди таких больных, выявили возможность некоторого уменьшения выраженности когнитивных нарушений при лечении мемантином и у пациентов с деменцией, и у пациентов с умеренными когнитивными расстройствами (УКР)[4, 5, 8]. Механизм действия в данном случае может состоять как в опосредованном влиянии на церебральную дофаминергическую систему (у пациентов с УКР), так и в сочетанном влиянии на систему дофамина и ацетилхолина.
Учитывая физиологическое действие глутамата, антагонисты NMDA-рецепторов должны снижать способность пациентов к обучению и усвоению новой информации, однако результаты многочисленных клинических исследований свидетельствуют об обратном эффекте. Этот парадокс пытались разъяснить многие нейрофизиологи. Так, C. Parsons и соавт. указывали, что отмеченное в эксперименте нарушение процесса обучения животных возникает лишь при концентрации мемантина, в несколько раз превышающей концентрацию, которая достигается в клинической практике (2,5–5 μM и 0,5 μM соответственно)[28, 29]. Взаимодействие мемантина (в терапевтических концентрациях) с рецепторами не нарушает нормальное функционирование глутаматергических синапсов, напротив, оно предотвращает их избыточную активацию[4, 14, 20]. Действие мемантина обратимо и зависит от состояния NMDA-рецепторов: при физиологических церебральных процессах препарат высвобождает ранее заблокированные NMDA-рецепторы, при патологической активации сохраняет свое блокирующее действие[4, 11, 13, 20, 22, 28, 29].
Многочисленные исследования свидетельствуют о нейропротективных свойствах мемантина[4, 14, 15, 18, 22, 26, 29, 32]. Так, исследования, выполненные in vitro, показали, что этот препарат значимо повышает выживаемость нейронов в условиях церебральной ишемии. Клинические исследования, проведенные у пациентов с БА разной степени тяжести, продемонстрировали, что своевременное назначение мемантина приводит к значимому замедлению прогрессии деменции, особенно при БА, развившейся после 65 лет (так называемой БА с поздним началом, или сенильной БА). Крайне интересны результаты, полученные О. В. Успенской и соавт.[9]. В исследование были включены пациенты с УКР, соответствовавшими критериям амнестического варианта УКР (преддементная стадия БА), у которых изучались уровни белков — маркеров БА до лечения мемантином и на фоне терапии. В работе показаны значимое увеличение концентрации амилоидного белка и, напротив, значимое снижение концентрации тау-протеина в цереброспинальной жидкости на фоне лечения, что убедительно свидетельствует о снижении скорости нейродегенеративного процесса (при прогрессии БА отмечаются обратные изменения — снижение концентрации амилоидного белка в ликворе и реципрокное повышение уровня тау-протеина).
Отдельно следует обсудить важный вопрос о возможном влиянии терапии антагонистами NMDA-рецепторов на выраженность и прогрессию недементных когнитивных расстройств. Клинические исследования большинства препаратов, рекомендованных для лечения деменции, не показали убедительной эффективности в лечении легких и умеренных когнитивных расстройств. К методам лечения УКР отнесены поддержание умственной и физической нагрузки, контроль за сердечно-сосудистыми заболеваниями, отказ от курения, диета и контроль веса, выявление и своевременное лечение тревожно-депрессивных расстройств. Широко рекомендуется выполнение когнитивного и когнитивно-моторного тренинга, когнитивно-поведенческой психотерапии.
Целесообразно привести результаты открытого рандомизированного многоцентрового исследования эффективности мемантина[5]. Критериями включения в исследование были возраст от 55 лет, наличие легких, умеренных когнитивных нарушений или легкой деменции. В исследование не включались больные с тяжелой соматической или неврологической патологией, а также клинически значимой депрессией. Участниками исследования стали 240 человек, которые в дальнейшем были рандомизированы в две группы: пациенты основной группы (n = 148) получали мемантин, в группе сравнения (n = 92) применялось лечение другими препаратами по выбору врача-исследователя, кроме ноотропов, дофаминергических препаратов, антидепрессантов, ингибиторов АХЭС.
Все обследованные имели УКР или очень легкую деменцию, при этом этиология когнитивных расстройств не анализировалась. Средний возраст пациентов составил 69,5 ± 5,5 года [62–74], в основной группе — 69,2 ± 5,7 года [63–75] и в группе сравнения — 67,6 ± 6,1 года[61–72]. Статистически значимых различий между группами пациентов по возрасту не было. Пациенты основной группы и группы сравнения не различались также по уровню образования, наличию таких факторов риска, как атеросклероз, ишемическая болезнь сердца, гипертоническая болезнь, сахарный диабет, ЧМТ в анамнезе, наследственная отягощенность по деменции.
Эффективность терапии оценивали при помощи батареи нейропсихологических тестов с количественной оценкой результатов. Количественное нейропсихологическое тестирование выполнялось до включения пациентов в исследование, через 1,5; 3; 6 месяцев на фоне приема мемантина (основная группа) или другой терапии (группа сравнения). Пациенты обеих групп на момент включения в исследование были сопоставимы по выраженности когнитивных расстройств.
В основной группе уже после трех месяцев приема мемантина отмечался значимый регресс выраженности когнитивных симптомов лобной дисфункции (p < 0,000001). В группе сравнения динамики когнитивных показателей лобной дисфункции не наблюдалось. Различия между пациентами основной и контрольной групп по указанным показателям через 3 и 6 месяцев наблюдения были статистически значимы (t-test, p < 0,05).
Анализ динамики мнестических расстройств показал, что на фоне терапии мемантином у пациентов происходит значимое уменьшение выраженности нарушений памяти, проявляющееся как увеличением числа запоминаемых слов при заучивании материала, так и воспроизведением большего количества слов после проведения интерференции (p < 0,000001). В группе сравнения не отмечалось какой-либо динамики мнестических расстройств на всем протяжении периода наблюдения. Различия между группами достигали статистической значимости через 3 месяца лечения и сохранялись в течение всего последующего наблюдения (t-test, p < 0,05).
На фоне лечения мемантином у пациентов отмечались увеличение беглости речи (p < 0,000001), нарастание уровня внимания (p < 0,000001) и уменьшение выраженности зрительно-пространственных расстройств (p < 0,000001). Эффект терапии был констатирован на 3-й месяц лечения и продолжал нарастать в дальнейшем. В группе сравнения значимой динамики указанных когнитивных нарушений не отмечалось. Различия между выраженностью зрительно-пространственных расстройств, нарушений беглости речи и уровня внимания у пациентов исследуемых групп достигали статистической значимости на 3-й месяц наблюдения и сохранялись в дальнейшем (t-test, p < 0,05).
Для оценки динамики когнитивных нарушений в зависимости от их тяжести пациенты основной группы были разделены на две подгруппы. Выраженность когнитивных нарушений в первой подгруппе (n = 96) соответствовала легкой деменции, во второй (n = 52) — степени УКР. Подгруппы пациентов не имели значимых различий по возрасту: в первой подгруппе средний возраст составил 66,5 ± 6,4 года [62–74], во второй — 67,3 ± 6,8 года [61–75].
Пациенты с исходно большей выраженностью когнитивных нарушений в целом лучше реагировали на лечение (p = 0,044). Однако в подгруппе с изначально более легким снижением когнитивных функций отмечалась более выраженная динамика нарушений памяти (зрительная и слухоречевая память: p = 0,048 и p = 0,044 соответственно) и беглости речи (p = 0,009).
Был проведен корреляционный анализ эффективности терапии в зависимости от наличия сосудистых факторов риска: артериальной гипертензии, атеросклероза, ишемической болезни сердца, инсульта в анамнезе, сахарного диабета — и отягощенного наследственного анамнеза по деменции. Результаты анализа не показали зависимости между эффективностью терапии мемантином и наличием или отсутствием указанных сосудистых факторов риска, равно как и наличием или отсутствием наследственной отягощенности по деменции.
Исследование убедительно показало, что мемантин эффективен в лечении УКР как нейродегенеративной, так и сосудистой природы. Полученные данные позволили нам рекомендовать его в качестве основного лекарственного препарата для лечения недементных когнитивных расстройств.
Анализируя результаты применения мемантина у пациентов с сосудистыми когнитивными нарушениями, следует подчеркнуть его эффективность как на стадии УКР, так и при наличии деменции любой степени выраженности[3–5, 32–34]. Положительное действие мемантина отмечено у пациентов с сосудистой деменцией различной природы. Сосудистая деменция гетерогенна; по сути, развитие деменции является клиническим проявлением декомпенсации вследствие поражения большого объема головного мозга либо зон, важных для нормального когнитивного функционирования (базальные ганглии, таламус, ствол головного мозга, гиппокамп, лобные доли), при сердечно-сосудистой патологии. Универсальное действие на глутаматергическую систему и, опосредованно, на другие церебральные медиаторные системы наделяет мемантин несомненным преимуществом и лежит в основе его эффективности в отношении когнитивных симптомов при сосудистой деменции независимо от причин ее развития.
В рамках профилактики развития когнитивных нарушений следует рассмотреть влияние мемантина на когнитивные симптомы у пациентов в острейшем и остром периоде нарушения мозгового кровообращения. Инсульт считается важнейшим и основным механизмом развития сосудистых когнитивных расстройств любой степени выраженности, в этой связи чрезвычайно важно как предотвращать его развитие, так и проводить максимальную лекарственную и нелекарственную коррекцию когнитивных, двигательных, эмоциональных симптомов заболевания начиная с ранних стадий.
На базе кафедры нервных болезней и нейрохирургии Первого Московского государственного медицинского университета им. И. М. Сеченова выполнено исследование эффективности мемантина у пациентов с ишемическим острым нарушением мозгового кровообращения (ОНМК)[1]. Больные были разделены на группы лечения мемантином (препарат назначался на первые сутки заболевания) и контроля (без приема мемантина). Группы включали по 20 больных и являлись сопоставимыми по тяжести инсульта, степени инвалидизации, а также выраженности когнитивных расстройств (табл. 2).
Таблица 2
Характеристика пациентов исследуемых групп, в баллах[1]

Эффективность лечения оценивали на 7–10-е сутки и через 3 месяца от развития ОНМК. Состояние пациентов на 7–10-е сутки не различалось. Анализ состояния пациентов, выполненный через 3 месяца, убедительно показал, что на фоне лечения мемантином происходит уменьшение выраженности когнитивных нарушений и инвалидности пациентов в целом (анализ по шкале Рэнкина, p < 0,05).
Отдельного внимания заслуживают исследования эффективности мемантина у пациентов с перенесенной ЧМТ. Большинство из них показывают, что на фоне лечения мемантином качество реабилитации таких больных существенно улучшается, данная закономерность касается как когнитивных, так и двигательных расстройств. Отмечается также значимое сокращение сроков реабилитации[4, 5].
Мемантин хорошо переносится: исследования показали, что побочные эффекты развиваются в единичных случаях[2, 4, 5, 10, 16, 26, 27, 31, 34]. Самыми частыми симптомами являются беспокойство, нарушение сна и головокружение. Развитие побочных эффектов обычно бывает связано со слишком быстрым повышением дозы препарата.
Стандартной рекомендованной схемой является постепенное наращивание дозы мемантина до 20 мг/сут с шагом титрации 5 мг: в 1-ю неделю пациенты принимают 5 мг, во вторую — 10 мг, в третью — 15 мг, начиная с 4-й недели доза лекарственного препарата составляет 20 мг. Применение препарата в дозах менее 20 мг не рекомендуется. Препарат не следует назначать пациентам с эпилепсией и с осторожностью надо применять у пациентов с почечной недостаточностью. В настоящее время рекомендуется принимать мемантин один раз в день, с утра: исследования показали, что прием 10 мг мемантина утром и 10 мг днем не дает никакой дополнительной эффективности по сравнению с однократным утренним приемом 20 мг препарата[2].
ЗАКЛЮЧЕНИЕ
Таким образом, результаты проведенных исследований убедительно свидетельствуют о широком спектре активности мемантина у пациентов с когнитивными нарушениями различной природы и разной степени выраженности.








