Настоящий обзор имеет своей целью обобщение научных данных о вкладе генетических факторов в развитие эссенциального тремора (ЭТ). Проанализирована доступная медицинская литература по изучению генетики ЭТ с использованием баз данных PubMed, eLIBRARY.RU. В обзор преимущественно включены работы, изданные за последние 10 лет, с учетом их высокой информативности.
ЭТ (или болезнь Минора) — хроническое прогрессирующее заболевание нервной системы, классическая «модель» дрожательного гиперкинеза и один из центральных объектов любых исследований в области двигательных расстройств [1]. Отличительной особенностью ЭТ является кинетический тремор (тремор, возникающий во время произвольных движений, таких как письмо, прием пищи и др.) частотой 4–12 Гц, который захватывает верхние конечности и может распространяться на голову, челюсть и другие части тела [2].
Распространенность ЭТ в разных странах и популяциях колеблется в широких пределах. Средняя распространенность заболевания во всех возрастных группах составляет 0,9%, достигая 4,6% у лиц старше 64 лет и превышая 20% среди лиц в возрасте 95 лет и старше [3].
Семейный характер значительной части случаев ЭТ неоднократно демонстрировался при проведении генеалогических, близнецовых и сегрегационных исследований [1]. Показано, что для 50–70% больных ЭТ характерен аутосомно-доминантный тип наследования с неполной возрастзависимой пенетрантностью и вариабельной экспрессивностью мутантного гена [1].
Частота выявления положительного семейного анамнеза обратно пропорциональна возрасту начала болезни, семейные формы заболевания характеризуются более ранним началом по сравнению со спорадическими формами [4]. Роль наследственности подтверждена в исследованиях близнецовых пар с ЭТ, высокая конкордантность для монозиготных и дизиготных близнецов обнаружена в датско-германском исследовании (0,93 и 0,29 соответственно), а также в исследовании, проведенном в США [5, 6].
В ряде семей отмечен феномен антиципации, т. е. заболевание в последующих поколениях дебютировало в более молодом возрасте и имело более выраженную форму [7].
Доля спорадических форм ЭТ варьирует от 17% до 70%. Существование спорадических случаев, изменение возраста манифестации ЭТ в семейных наблюдениях и отсутствие полной идентичности клинической картины заболевания у монозиготных близнецов свидетельствуют о влиянии экзогенных факторов, включая воздействие свинца и алкалоидов β-карболина [8].
Предполагается, что спорадические и семейные формы ЭТ могут иметь общую генетическую структуру и не всегда являются взаимоисключающими. Генетическая структура спорадических и семейных форм ЭТ может объясняться несколькими способами наследования, в том числе как менделевскими, так и сложными формами передачи [9].
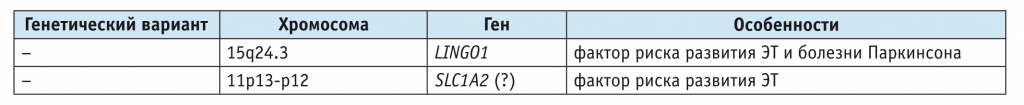
Наличие клинической и генетической гетерогенности ЭТ затрудняет идентификацию генов. Несмотря на проведение исследований в области генетики ЭТ, высокую распространенность и наследственный характер заболевания, отмечается медленный прогресс в идентификации генов, ответственных за его развитие [2]. Известные гены и гены-кандидаты, связанные с ЭТ, представлены в таблицах 1, 2 [1].
Таблица 1
Гены, связанные с развитием эссенциального тремора: моногенное наследование (анализ сцепления) [1]
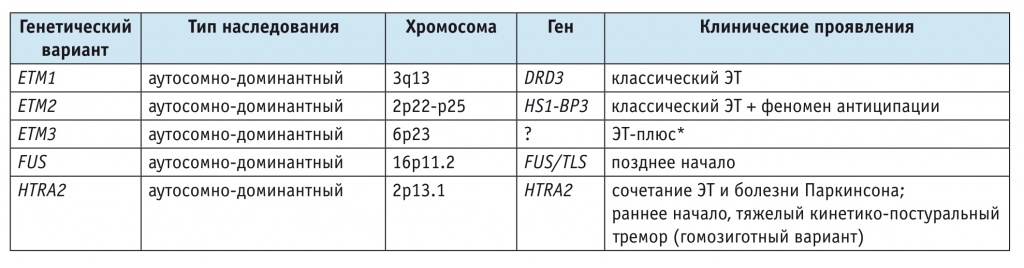
* Согласно клиническим рекомендациям Международного общества болезни Паркинсона и двигательных расстройств (англ. International Parkinson and Movement Disorder Society), 2017.
Примечание. В таблицах 1, 2 ЭТ — эссенциальный тремор.
Таблица 2
Гены, связанные с развитием эссенциального тремора: полногеномный поиск ассоциаций [1]
РЕЗУЛЬТАТЫ ПОИСКА МЕНДЕЛИРУЮЩИХ ГЕНОВ ЭССЕНЦИАЛЬНОГО ТРЕМОРА
На сегодняшний день опубликованы результаты исследований, в которых идентифицированы локусы ETM1 (англ. Essential Tremor Mutated) на хромосоме 3q13, ETM2 на хромосоме 2p22-p25, ETM3 на хромосоме 6p23 [10–12].
Локус ETM1 (OMIM 190300) был картирован на хромосоме 3q13 в 16 небольших исландских семьях (LOD 3,71) [10].
При исследовании 23 французских семей с ЭТ продемонстрирована ассоциация болезни с полиморфным аллельным вариантом 312 G>A Ser9Gly (rs6280) в гене DRD3 [13], выявленная также у испанских и американских пациентов с ЭТ [14, 15]. Наряду с этим в испанских семьях была обнаружена ассоциация генотипов DRD3 Ser/Gly и DRD3 Gly/Gly, а также патологической аллели DRD3 Gly с ранним началом болезни и наличием тремора голоса в клинической картине ЭТ [14].
Локус ETM2. В американской семье чешского происхождения определен второй локус, связанный с ЭТ, — ETM2 (OMIM 602134) на хромосоме 2p22-p25, ген HS1-BP3 (OMIM 609359), LOD 5,92 [11, 16]. В локусе ETM2 у 16,4% обследованных больных ЭТ и у 3% пациентов с болезнью Паркинсона обнаружена гетерозиготная мутация — замена 828 С>G (Ala265Gly) в 7-м экзоне гена HS1-BP3 [17]. Описанная J.J. Higgins и соавт. (2006) замена в гене HS1-BP3 может иметь функциональное значение для патогенеза не только ЭТ, но и других заболеваний с дрожательным фенотипом. Продукт гена HS1-BP3 связан с белками, имеющими высокий уровень экспрессии в клетках Пуркинье и двигательных нейронах и регулирующими активность ключевых ферментов метаболизма тирозина и триптофана — предшественников ряда двигательных нейротрансмиттеров (катехоламинов и серотонина) [17].
Российскими учеными были опубликованы результаты оценки встречаемости мутации Ala265Gly в гене HS1-BP3 и полиморфизма Ser9Gly в гене DRD3 [18]. Исследованием были охвачены 92 пациента, соответствовавшие критериям достоверного ЭТ, и 96 волонтеров без ЭТ, сопоставимых по возрасту и этническому происхождению. В результате мутантная аллель НS1-BP3 была обнаружена у 7 пациентов, а предрасполагающая к заболеванию аллель DRD3 — у 48. Частота носительства мутантных аллелей НS1-BP3 и DRD3 среди больных составила 4,9% (9 хромосом из 184) и 28,3% (52 хромосомы из 184) соответственно. Четыре пациента оказались носителями как мутации Ala265/Gly265, так и преморбидного полиморфизма Ser9/Gly9, при этом каких-либо клинических особенностей течения заболевания, кроме депрессии у двух пациентов с гетерозиготностью по обоим вариантам, установить не удалось. Авторы продемонстрировали гомозиготное носительство мутации Ala265Gly в гене HS1-BP3, ассоциированное с ЭТ в изучаемой когорте, а также отсутствие влияния полиморфизма Ser9Gly на развитие ЭТ [18].
Локус ETM3 был идентифицирован на хромосоме 6p23 в одной большой американской семье [12]. Четыре последующих независимых исследования, где была изучена 21 семья с ЭТ, связи болезни с данным локусом не выявили [19].
В нескольких работах были предприняты безуспешные попытки реплицировать связи с ETM1 [13, 20, 21], ETM2 [17, 20] и ETM3 (LOD > 2,0) [12]; но гены и причинные мутации в этих локусах еще не определены, несмотря на то что исследования проводились много лет назад [9].
Ген FUS. С помощью секвенирования экзома в одной франко-американской семье обнаружена мутация c.868 C>T (p.Q290X) в 9-м экзоне гена FUS (ген «слияния в саркоме», англ. Fusion in Sarcoma), которая отсутствовала среди лиц контрольной группы [22]. Ген FUS принимает участие в развитии бокового амиотрофического склероза и лобно-височной деменции, представляет собой ДНК/РНК-связывающий нуклеопротеин и участвует в репарации ДНК, регулировании транскрипции, сплайсинга и транспорта мРНК от ядра к цитоплазме. При дальнейшем скрининге случаев ЭТ были идентифицированы два дополнительных полиморфных аллельных варианта в 6-м (c.646 C>T; p.R216C) и 12-м (c.1292 C>T; p.P431L) экзонах. Вариант c.1292 C>T (p.Pro431Leu) был выявлен среди семейных форм ЭТ и отсутствовал в контрольной группе. Вариант c.646 C>T (p.Arg216Cys) был идентифицирован в 2 случаях ЭТ (в спорадическом и семейном вариантах), а также в контрольной группе [22].
Позднее в гене FUS идентифицировали новую гетерозиготную мутацию c.1129 C>T (p.R377W) у пациента с семейной формой болезни [23]. Показано, что мутации в гене FUS являются чрезвычайно редкими и отвечают за развитие семейных форм ЭТ, патогенность мутаций p.Q290X и p.R377W, обнаруженных у одного пациента с семейной формой ЭТ, без функциональных исследований остается невыясненной [24, 25].
Ген HTRA2. В исследовании H. Unal Gulsuner и соавт., проведенном среди турецких семей с ЭТ и болезнью Паркинсона, выделен полиморфный аллельный вариант p.G399S гена HTRA2, кодирующего сериновую протеазу, и показана ассоциация гетерозиготного носительства этого полиморфизма с обоими фенотипами (ЭТ и болезнь Паркинсона). Гомозиготное носительство минорной аллели оказалось ассоциировано с более ранним возрастом манифестации ЭТ, тяжелым постуральным и кинетическим тремором [26].
ИССЛЕДОВАНИЯ ГЕНЕТИЧЕСКОЙ АССОЦИАЦИИ ГЕНОВ-КАНДИДАТОВ
Ген TREM2. В результате многоцентрового международного исследования, включавшего разные популяции (Италия, Германия, Северная Америка, Тайвань), был идентифицирован полиморфный аллельный вариант p.R47H (rs75932628) гена TREM2 как фактор риска развития ЭТ у испанской популяции (ОШ = 5,97; 95%-й ДИ [1,203–29,626]; p = 0,042) [27]. Показано, что полиморфизм p.R47H также играет роль в развитии болезни Альцгеймера, болезни Паркинсона, лобно-височной деменции и бокового амиотрофического склероза [28–30]. Однако ассоциация полиморфизма p.R47H с ЭТ не была воспроизведена в других популяциях, что может указывать на специфические популяционные различия и аллельную гетерогенность гена TREM2 [27].
В качестве генов-кандидатов ЭТ исследовались гены SNCA [31], LRRK2 [32], GBA [32], MAPT [33], а также были предприняты попытки идентифицировать патогенные повторные экспансии в локусах SCA-1 (ATXN1), SCA-2 (ATXN2), SCA-3 (ATXN3), SCA-6 (CACNA1A), SCA-7 (ATXN7), SCA-8 (ATXN8OS), SCA-10 (ATXN10), SCA-12 (PPP2R2B), SCA-17 (TBP), DRPLA (ATN1) и FRAXA [2], но ни в одном из этих исследований не было получено убедительного результата.
На сегодняшний день опубликованы результаты полногеномного поиска ассоциаций, которые выявили в том числе однонуклеотидный полиморфизм в гене LINGO1 и интронный вариант в гене SLC1A2, связанные с повышенным риском развития ЭТ [9].
Ген LINGO1, расположенный в 3-м интроне хромосомы 15q24.3, кодирует трансмембранный гликопротеин ЦНС, который играет роль в поддержании оптимального уровня нейропластичности. Установлены повышение экспрессии гена LINGO1 при повреждении нейронов, негативное влияние данного гена на их выживаемость, дифференциацию олигодендроцитов и регенерацию аксонов [34]. В 2009 г. была обнаружена взаимосвязь гена LINGO1 с риском развития ЭТ у исландской группы пациентов. В результате полногеномного скрининга удалось идентифицировать два однонуклеотидных полиморфизма (rs9652490 и rs11856808), ассоциированных с риском развития заболевания [34]. Позднее данная ассоциация была подтверждена в исследованиях, проведенных в США, Германии, Франции и странах Азии [35–38]. Противоречивые данные получены среди пациентов Австрии, Польши и Германии [39–42]. В ходе проведенных исследований было обнаружено, что полиморфизм rs9652490 гена LINGO1 ассоциирован с семейными формами и ранним началом ЭТ [43, 44]. Позже при расширенном многоцентровом исследовании были идентифицированы дополнительные полиморфизмы в гене LINGO1 (rs4886887, rs3144 и rs12905478) и один полиморфизм в гене LINGO2 (rs1412229), достоверно связанные с риском развития ЭТ [45]. Кроме того, была показана взаимосвязь данных полиморфных аллельных вариантов с риском развития болезни Паркинсона [45]. Однако некоторые исследователи не смогли идентифицировать связь между вариантами LINGO1 и ЭТ в других популяциях [37, 46], что подтверждает гипотезу о существовании популяционно-специфичных различий и повышает значимость расширенных популяционных исследований.
Ген SLC1A2. В результате полногеномного скрининга, проведенного в европейской и немецкой популяциях, был установлен новый вариант однонуклеотидного полиморфизма rs3794087 в гене SLC1A2, который участвует в обратном захвате глутамата в головном мозге, увеличивая риск ЭТ в 1,4 раза по сравнению со среднепопуляционным [47]. Ассоциация полиморфизма rs3794087 с ЭТ подтвердилась в двух азиатских когортах [48, 49], но статистическая значимость выявленной ассоциации не была обнаружена в ходе метаанализа [19].
ЗАКЛЮЧЕНИЕ
Несмотря на проведение генетических исследований в разных странах и популяциях, ген, ответственный за развитие эссенциального тремора (ЭТ), до настоящего времени не идентифицирован. Выявленные ранее локусы (ETM1, ETM2, ETM3) не подтвердили своего значения в развитии моногенного ЭТ. Новая мутация в гене FUS может рассматриваться как редкий вариант семейных форм заболевания. На сегодняшний день определены два генетических фактора риска развития ЭТ (полиморфные варианты генов LINGO1 и SLC1A2), которые могут оказаться важными в будущих исследованиях.
Предпринятые ранее неудачные попытки идентификации генов-кандидатов ЭТ можно связать с отсутствием стратифицированных биомаркеров ЭТ, характерных нейровизуализационных признаков рассматриваемого заболевания, а также единого подхода к фенотипированию и имеющимися сложностями дифференциальной диагностики с другими неврологическими заболеваниями, сопровождающимися тремором (например, с болезнью Паркинсона, дистонией, тремором при эндокринопатиях и др.).
Возможно, применение новых подходов в исследовании генетики ЭТ, таких как полногеномное секвенирование, изучение вариаций числа копий и эпигенетических изменений, приведет к идентификации новых генов [2].








