Ишемический инсульт (ИИ) представляет исключительно серьезную медико-социальную проблему вследствие широкой распространенности, высокой летальности и значительной частотой стойкой инвалидизации [1, 2]. Наиболее частыми причинами летального исхода при ИИ являются нарастающий отек головного мозга и его дислокация, приводящие к вклинению в большое затылочное отверстие или вырезку намета мозжечка, а также соматические осложнения, в первую очередь воспалительные заболевания и тромбоэмболия легочной артерии.
Среди воспалительных заболеваний, осложняющих течение острого периода ИИ, чаще всего отмечаются инфекции нижних дыхательных путей, которые ассоциированы с более высокой летальностью, формированием стойкого неврологического дефицита, увеличением сроков пребывания на больничной койке, в частности в условиях отделения интенсивной терапии, повышением риска развития повторного ИИ [3]. Развитие пневмонии у больного с ИИ, кроме того, сопряжено со значительными материальными затратами, которые складываются из стоимости лекарственных препаратов (прежде всего противомикробных), необходимости более длительного пребывания в условиях стационара, большей степени инвалидизации [4].
В зависимости от ряда факторов, в частности от ведущего механизма развития, пневмония у пациента с инсультом может рассматриваться как внутрибольничная, вентиляторассоциированная, аспирационная и пр. Для описания пневмонии, развивающейся на протяжении первых 7 суток от момента развития инсульта, в настоящее время предложен термин «инсультассоциированная пневмония» (ИАП) [5]. К ключевым механизмам развития бронхолегочных воспалительных осложнений при инсульте относятся аспирация материала из ротовой полости, расстройства глотания (дисфагия), нарушения иммунитета, обусловленные непосредственно поражением мозгового вещества, а также системной реакцией организма на возникновение очага некроза ткани [6].
Основными направлениями предупреждения воспалительных бронхолегочных осложнений острого инсульта являются немедикаментозные мероприятия, включающие туалет ротовой полости, правильный режим питания, в том числе установку назогастрального зонда, дыхательную гимнастику и раннюю активизацию больного. Сохраняет свою актуальность вопрос о целесообразности превентивного назначения антибиотиков у пациентов с острым инсультом. В частности, результаты исследования PASS (англ. Preventive Antibiotics in Stroke Study) показали, что раннее назначение антибиотиков снижает частоту развития различных инфекционных осложнений инсульта, однако не оказывает существенного влияния на функциональный исход заболевания [3]. Вместе с тем указанные направления терапии не в состоянии обеспечить коррекцию иммунного статуса, нарушенного вследствие острого нарушения мозгового кровообращения [7].
Для лечения больных с острым ИИ в ряде стран, в том числе в Российской Федерации, применяются препараты, оказывающие разнообразные воздействия на обмен веществ в головном мозге, повышающие его устойчивость к гипоксии и ишемии, активизирующие репаративно-восстановительные процессы, которые развиваются в нем после повреждения.
Одним из таких препаратов является Цитофлавин, эффективность которого достаточно подробно изучена у больных с острым инсультом. Так, имеются данные о том, что применение препарата способствует нормализации энергетического метаболизма головного мозга в условиях ишемии, устраняет избыточное образование свободных радикалов, препятствуя развитию оксидантного стресса [8, 9]. Результаты серии клинических исследований показали, что применение Цитофлавина у больных с острым ИИ обеспечивает уменьшение зоны инфаркта, сопровождается более полным восстановлением двигательных и когнитивных функций, нормализацией эмоционального состояния пациентов [10, 11]. Работ по изучению влияния препарата на частоту развития воспалительных осложнений ранее не проводилось.
Цель исследования: изучение влияния препарата Цитофлавин на частоту развития пневмонии в остром периоде ишемического инсульта.
МАТЕРИАЛЫ И МЕТОДЫ
Наблюдался 101 пациент, госпитализированный в нейрореанимационные отделения и отделения для лечения больных с острым нарушением мозгового кровообращения ГБУЗ ГКБ им. Н.И. Пирогова ДЗ Москвы, ГБУЗ ГКБ им. В.М. Буянова ДЗ Москвы, ГБУЗ БСМП им. Н.А. Семашко (г. Орел), ГБУЗ КБ (г. Махачкала) по поводу острого ИИ.
Критерии включения: острый нелакунарный ИИ; госпитализация в первые 24 часа от момента развития заболевания; первичный или повторный ИИ; диагноз ИИ, подтвержденный методами нейровизуализации (КТ или МРТ головного мозга).
Критерии невключения: геморрагический или смешанный инсульт; ИИ в вертебрально-базилярной системе; лакунарный инфаркт головного мозга; острое воспалительное или инфекционное заболевание, предшествовавшее развитию настоящего инсульта; системные заболевания, сопровождающиеся воспалительной реакцией организма; органические заболевания ЦНС (травматические, воспалительные, опухолевые), предшествовавшие настоящему ИИ.
Из числа обследованных 48 больных получали препарат Цитофлавин в соответствии с инструкцией по медицинскому применению — по 20 мл на 200 мл изотонического раствора внутривенно (первая группа), у 53 больных с острым ИИ Цитофлавин не применяли (вторая группа). Всем пациентам проводили унифицированную терапию по поводу ИИ в соответствии с клиническими рекомендациями.
Основные клинико-демографические характеристики участников исследования приведены в таблице 1.
Таблица 1
Клинико-демографические характеристики больных
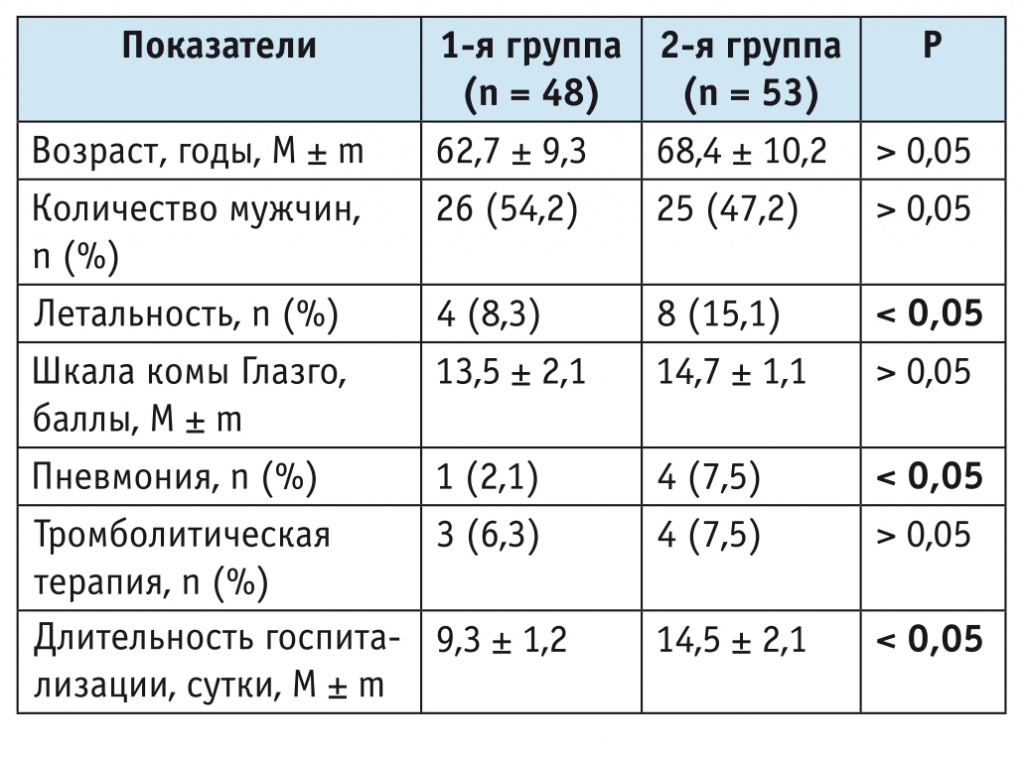
Обследование проводилось на 1-е, 5-е и 9-е сутки заболевания. У всех пациентов оценивали выраженность неврологического дефицита: уровень бодрствования на момент госпитализации по Шкале комы Глазго, состояние по Шкале оценки тяжести инсульта Национального института здоровья США (англ. National Institutes of Health Stroke Scale, NIHSS), степень независимости на момент выписки из стационара по индексу Бартел. Диагноз ИАП устанавливали на основании клинико-лабораторных критериев: по формуле крови, уровню С-реактивного белка (СРБ), рентгенограмме/КТ легких [12].
Исследовали лейкоцитарную формулу периферической крови, концентрации фибриногена и СРБ. Рассчитывали индекс сдвигов лейкоцитов крови (ИСЛК) по формуле:
(эозинофилы + базофилы + нейтрофилы)/(моноциты + лимфоциты).
Увеличение ИСЛК является маркером воспаления и прогностическим критерием неблагоприятного исхода ИИ, нормальные значения показателя составляют 1,96 ± 0,56 [13].
Данные статистически обработаны с использованием параметрических критериев при помощи программы SPSS 17.0. Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
По основным клинико-демографическим показателям группы больных были сопоставимы (см. табл. 1). За период наблюдения в первой группе умерли 4 пациента (8,3%), во второй — 8 (15,1%) (p < 0,05). Причинами летальных исходов в обеих группах оказались нараставший отек головного мозга, тромбоз глубоких вен голеней с последовавшей тромбоэмболией легочной артерии (различия между группами выявлены не были). Пневмония развилась у одного больного в первой группе и у четверых — во второй (p < 0,05). Тромболитическую терапию прошли по 2 пациента каждой группы.
На фоне лечения в обеих группах имела место положительная динамика в виде уменьшения выраженности неврологического дефицита (шкала NIHSS), при этом на 9-е сутки различия между группами приобретали статистически значимый характер (p < 0,05). На 9-е сутки наблюдения у больных первой группы были констатированы также статистически значимо более высокие значения индекса Бартел (p < 0,05), что свидетельствовало о более полном восстановлении нарушенных неврологических функций и о более высоком уровне адаптации к повседневной жизни (табл. 2).
Таблица 2
Результаты наблюдения больных, M ± m

Примечания. 1. СОЭ — скорость оседания эритроцитов; CРБ — C-реактивный белок; NIHSS — Шкала оценки тяжести инсульта Национального института здоровья США (англ. National Institutes of Health Stroke Scale).
2. Знаком (*) отмечены статистически значимые различия со второй группой в соответствующий день обследования: p < 0,05.
У больных обеих групп диагноз пневмонии был подтвержден результатами рентгенологического обследования. Данные исследования клеточного состава периферической крови, а также СРБ (работа проведена у части больных) свидетельствуют о том, что исходные значения в группах не различались. К 5-м суткам наблюдения имело место нарастание показателей, более выраженное у больных второй группы (различия между группами на этот момент носили статистически значимый характер: p < 0,05). К 9-м суткам показатели лейкоцитоза, количества нейтрофилов, ИСЛК, СОЭ и СРБ у больных первой группы возвращались к исходным уровням. У больных второй группы имела место тенденция к уменьшению значений рассматриваемых показателей, однако они превышали исходные уровни и статистически значимо отличались от соответствующих показателей в первой группе.
Нежелательных эффектов, которые могли бы быть связаны с применением Цитофлавина, отмечено не было.
ОБСУЖДЕНИЕ
Воспалительные заболевания, развивающиеся у больного с острым ИИ, значительно осложняют течение инсульта, их наличие ассоциировано с более высокой летальностью, стойкой инвалидизацией, потребностью в более длительном лечении. Кроме того, показано, что наличие очага воспаления в организме достоверно повышает риск развития последующих атеротромботических событий [14, 15].
Данные проведенного исследования свидетельствуют о том, что включение Цитофлавина в комплексную терапию больных с нелакунарным ИИ приводит к более полному восстановлению нарушенных неврологических функций. Эти наблюдения соответствуют результатам ранее проведенных исследований и подтверждают метаболические эффекты препарата в головном мозге в условиях острой ишемии [10, 11]. Соответственно, более полное восстановление нарушенных функций и связанная с этим бо́льшая возможность социальной адаптации, подтвержденная нарастанием индекса Бартел на момент выписки из стационара, были ожидаемыми результатами.
Важным и исключительно интересным итогом исследования явилось установление статистически значимо меньшей частоты развития пневмонии у больных, получавших Цитофлавин. Прежде подобный эффект препарата не отмечался. Можно предположить, что раннее и более полное восстановление двигательных функций, нарушенных вследствие перенесенного ИИ, у больных, получавших Цитофлавин, приводило к снижению риска развития застойных явлений в легких, устраняло влияние гипокинезии, а это способствовало предупреждению развития ИАП. Возможно, в данной ситуации положительный эффект препарата реализовывался за счет активного воздействия на метаболические процессы не только в тканях головного мозга, но и в других органах. Это предположение в определенной степени подтверждается сведениями о широком спектре фармакологических эффектов янтарной кислоты, в частности о ее гормоноподобном действии [16].
ЗАКЛЮЧЕНИЕ
Ограничениями настоящего исследования являются относительно небольшое число включенных в него пациентов и неприменение дизайна двойного слепого исследования. Полученные результаты являются основанием для дальнейшего изучения механизмов влияния препарата Цитофлавин на частоту развития пневмонии у больных с ишемическим инсультом, а также для детальной оценки эффективности такого рода терапии.








