Несмотря на множество исследований, патогенез ДПН изучен не до конца. В настоящее время существует несколько теорий, объясняющих развитие ДПН, в частности метаболическая, сосудистая, наследственная, дизиммунная, которые рассматривают многоуровневый каскад патологических реакций, связанных с гипергликемией [10, 12, 19, 21].
Нервная ткань, наряду с эритроцитами крови и хрусталиком глаза, относится к инсулиннезависимым тканям, следовательно, эти структуры наиболее чувствительны к гипергликемии [12, 18]. Избыток глюкозы ведет к активации полиолового пути метаболизма с накоплением токсических продуктов (сорбитола, фруктозы), инактивацией Na/К-АТФазы, истощением никотинамидадениндинуклеотида и глутатиона и, как следствие, нарушением работы антиоксидантной системы в целом. Недостаток инозитола вызывает энергетический дефицит, нарушает аксоплазматический ток и провоцирует разобщение аксоглиальных синапсов. Цитотоксические эффекты возникают из-за накопления конечных продуктов гликирования. Повреждение нервных структур усугубляется вследствие эндоневральной гипоксии, обусловленной дефицитом оксида азота, констрикцией vasa nervorum, ремоделированием сосудов за счет отложения фибрина и изменением реологических свойств крови. В итоге все компоненты патогенетического каскада объединяются в ключевой механизм окислительного стресса [4, 8, 12, 14].
Дисметаболические и микроангиопатические нарушения приводят к симметричному поражению периферических нервных волокон по типу аксонопатии [8, 12]. Уязвимость нервных волокон напрямую зависит от их длины, поэтому при ДПН прежде всего поражаются наиболее длинные аксоны (общий малоберцовый нерв — n. fibularis [peroneus] profundus, икроножный нерв — nervus suralis) [8]. При этом наиболее часто в процесс вовлекаются слабо- и немиелинизированные волокна, что определяет особые закономерности в развитии клинических проявлений [15, 17]. На ранних стадиях клиническая картина представлена расстройствами поверхностной чувствительности. В эту группу входят симптомы раздражения (нейропатический болевой синдром, парестезии) и выпадения (снижение болевой и температурной чувствительности). Кроме того, на ранних стадиях выражены вегетативные расстройства [3, 6, 20].
Ранние электронейромиографические признаки поражения аксона включают снижение амплитуды М-ответа и нормальную или незначительно сниженную скорость распространения возбуждения. На поздних стадиях ДПН присоединяется вторичная демиелинизация нервного волокна, которая проявляется при электронейромиографии (ЭНМГ) увеличением латентности М-ответа и снижением скорости проведения импульса [8, 11].
Стоит отметить, что аксональная дегенерация потенциально обратима, хотя восстановление идет гораздо медленнее, чем при демиелинизирующем процессе [4, 8]. Восстановление занимает от нескольких месяцев до нескольких лет, оно заключается в регенерации поврежденных аксонов благодаря увеличению выработки трофических факторов и разрастанию концевых веточек соседних аксонов (аксональный спраутинг).
При лечении ДПН эффективны несколько классов лекарственных средств, однако они не останавливают прогрессирование ДПН на поздних стадиях [1, 13, 16]. Необходимо применение многокомпонентных препаратов, воздействующих на разные звенья патогенеза полинейропатии.
В качестве симптоматического средства лечения ДПН на территории РФ зарегистрирован препарат Кокарнит, представляющий собой сбалансированный комплекс метаболических веществ и витаминов группы В. Препарат выпускается в форме лиофилизата для приготовления раствора для внутримышечного введения. В состав Кокарнита входят трифосаденин, кокарбоксилаза, цианкобаламин и никотинамид.
Трифосаденин служит естественным стимулятором метаболических и энергетических процессов, оказывает сосудорасширяющее действие, улучшает трофику и жизнеспособность тканей.
Кокарбоксилаза — тиаминсодержащий кофермент, участвующий в окислительном и неокислительном декарбоксилировании α-кетокислот (пировиноградной и α-кетоглютаровой), обмене α-кетосахаров, оказывает регулирующее воздействие на обменные и трофические процессы и на перенос ионов Na+ через мембрану нейрона. Кроме того, кокарбоксилаза улучшает усвоение глюкозы, опосредованно способствует синтезу нуклеиновых кислот, белков и липидов, модулирует передачу нервного импульса.
Цианокобаламин (витамин В12) играет важную роль в построении миелиновой оболочки нейронов, улучшает метаболизм углеводов и липидов.
Никотинамид входит в состав коферментных групп (кодегидрогеназной системы — коэнзимов I и II), принимающих участие в окислительно-восстановительных и других обменных процессах в организме, он улучшает углеводный и азотистый обмен.
Ранее эффективность и безопасность препарата Кокарнит исследованы учеными Беларуси и Молдавии [2, 9].
Цель настоящего исследования: изучение влияния препарата Кокарнит на электронейрофизиологические показатели периферических нервов и на качество жизни больных ДПН.
МАТЕРИАЛЫ И МЕТОДЫ
Нами обследованы 20 пациентов (12 женщин и 8 мужчин) с ДПН в возрасте от 51 года до 67 лет (средний возраст — 58,2 ± 5,1 года). Средняя длительность СД составила 15,3 ± 8,2 года, ДПН — 6,4 ± 1,8 года. Три пациента страдали СД 1 типа, 17 — СД 2 типа. У всех участников наблюдали сенсомоторный дистальный вариант ДПН.
Болевые ощущения испытывали все больные, парестезии имели место у 16 человек. Снижение и выпадение ахилловых рефлексов отмечены у 15 обследованных, коленных — у 5.
Степень компенсации углеводного обмена определяли по концентрации глюкозы в крови. Уровень гликемии — в среднем 9,7 ± 2,97 ммоль/л.
Клиническое исследование включало изучение жалоб и данных анамнеза, а также неврологическое обследование с использованием шкал Total Symptom Score (ТSS), Neurological Symptom Score (NSS) и Neuropathy Disability Score (NDS), с помощью которых оценивали болевую, тактильную, температурную, вибрационную чувствительность, сухожильные рефлексы нижних конечностей. Динамику качества жизни определяли по опроснику Medical Outcomes Study 36-Item Short Form Survey (SF-36), включающему субъективную оценку больным своего физического, психологического, эмоционального и социального функционирования.
При ЭНМГ нижних конечностей исследовали скорость распространения возбуждения по периферическим нервам и амплитуду М-ответа на приборе Viking Quest (Nicolet, США). Изучали показатели малоберцового нерва в трех стандартных точках: на уровне подколенной ямки (poplitea fossa), под головкой малоберцовой кости (fibula head) и на уровне латеральной лодыжки (ankle). Оценивали также показатели S-ответа с учетом изменений дистальной латентности для икроножного нерва.
Все пациенты участвовали в наблюдательной многоцентровой программе «Оценка эффективности и безопасности комплексного препарата Кокарнит у пациентов с ДПН» и получали Кокарнит в дозе 2 мл 1 раз в сутки в/м в течение 9 дней. За больными наблюдали на протяжении четырех визитов: до, через неделю, месяц и 3 месяца после курсового лечения. Критерии включения в программу: подписание информированного согласия на участие; СД 1 или 2 типа; подтвержденный диагноз ДПН; возраст старше 18 лет; выраженный болевой синдром.
Во время всех четырех визитов проводили полное клиническое обследование согласно дизайну исследования. Показатели ЭНМГ измеряли дважды: до курсового лечения и через 3 месяца после его окончания.
Статистическую обработку результатов проводили на IBM PC с помощью интегрированного пакета программ для статистического анализа Statistica v.10. Поскольку распределение исходных данных для сравниваемых групп не всегда соответствовало нормальному, параметрические методы исследования оказались неприменимы. Для сравнения независимых выборок непараметрических данных использовали критерий Манна — Уитни, для сравнения показателей до и после лечения — критерий Вилкоксона. При исследовании корреляционной зависимости применяли коэффициент Спирмена (R). Критический уровень значимости при проверке статистических гипотез принимали равным 0,05.
РЕЗУЛЬТАТЫ
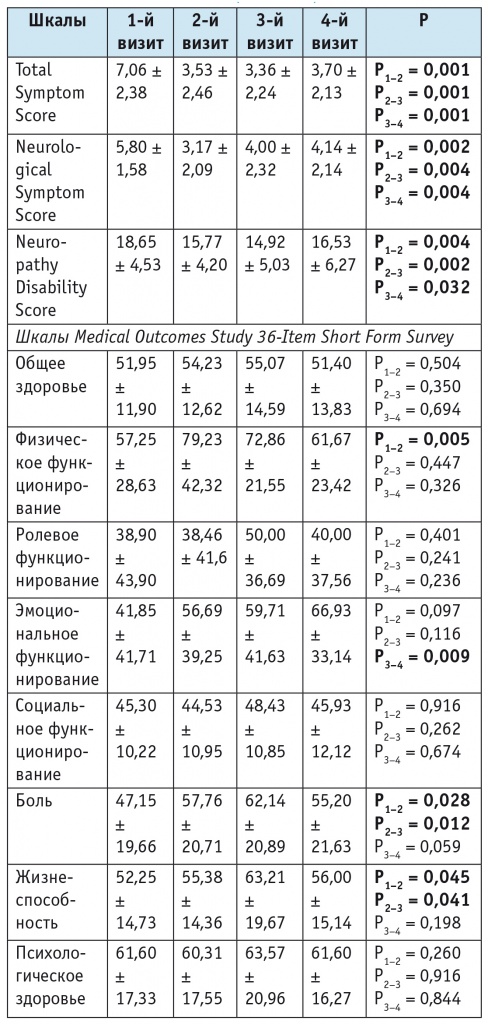
По данным 1-го визита (до лечения), выраженность субъективных симптомов нейропатии по шкалам ТSS и NSS оценивалась на 7,06 ± 2,38 и 5,80 ± 1,58 балла соответственно. Средний балл по шкале NDS (объективная оценка неврологического статуса) составил 18,65 ± 4,53, что соответствует выраженной степени нейропатии (табл. 1). При изучении качества жизни больных ДПН по опроснику SF-36 выявлено снижение показателей по семи шкалам из восьми.
Таблица 1
Выраженность диабетической полинейропатии и качество жизни обследованных пациентов до и после лечения препаратом Кокарнит, баллы (M ± SD)
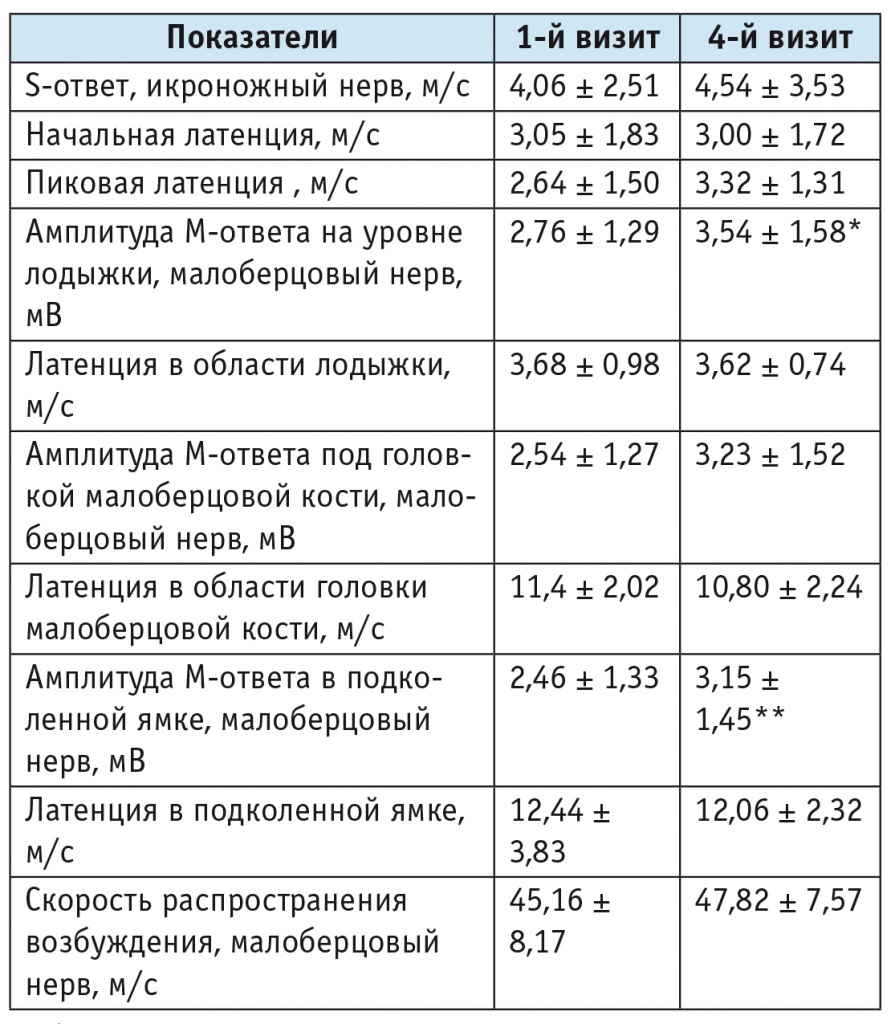
Проведенная до лечения ЭНМГ позволила установить признаки аксонального поражения (уменьшение амплитуды М-ответа при нормальной или незначительно сниженной скорости распространения волны) у всех пациентов, кроме того, у 5 человек обнаружили признаки вторичной демиелинизации (табл. 2).
Таблица 2
Результаты электронейрофизиологического обследования пациентов с диабетической полинейропатией до и после лечения препаратом Кокарнит (M ± SD)
При корреляционном анализе выявлена прямая зависимость между длительностью и выраженностью ДПН, оцененной с помощью шкалы NDS (R = 0,538, p < 0,05). Помимо этого, определена обратная корреляционная связь между длительностью ДПН и степенью аксонального поражения по данным ЭНМГ (R = –0,6001, p < 0,05). Уровень гликемии был обратно пропорционален показателям амплитуды М-ответа n. peroneus в дистальном отделе на уровне лодыжки (R = –0,557, p < 0,05) и под головкой малоберцовой кости (R = –0,510, p < 0,05).
При 2-м, 3-м и 4-м визитах у пациентов зафиксированы статистически значимое снижение степени нейропатии по шкале NDS и улучшение клинического состояния по данным опросников TSS и NSS (см. табл. 1). Анализ изменения показателей ЭНМГ после лечения показал значимое увеличение амплитуды М-ответа для n. peroneus на уровне лодыжки и в подколенной ямке (см. табл. 2).
При 2-м визите зарегистрировано повышение качества жизни согласно опроснику SF-36 по шкалам физического функционирования, боли и жизнеспособности. При последнем визите подобные результаты не получены, однако эмоциональное функционирование пациентов статистически значимо улучшилось.
Корреляционный анализ данных 2-го и 3-го визитов позволил установить обратные зависимости между показателями аксонального повреждения и признаками нейропатии по шкале NDS (R = –0,815 (p = 0,001) для n. peroneus на уровне лодыжки, R = –0,807 (p = 0,001) для n. peroneus на уровне головки малоберцовой кости, R = –0,853 (р = 0,002) для n. peroneus на уровне подколенной ямки).
Увеличение значений М-ответа n. peroneus после курса лечения прямо коррелирует с изменением социального функционирования во время 2-го визита (R = 0,586, p = 0,001) и уменьшением боли на момент 3-го визита (R = 0,649, p = 0,002).
ОБСУЖДЕНИЕ
При комплексном обследовании пациентов до лечения была выявлена выраженная степень нейропатии по шкале NDS, которая коррелировала с длительностью ДПН и уровнем гликемии. Кроме того, нейропатия сопровождалась явными признаками аксонального поражения на ЭНМГ.
Короткий курс терапии Кокарнитом способствует снижению интенсивности нейропатической боли и повышению качества жизни пациентов. В более отдаленном периоде наблюдения (через 3 месяца после курсового лечения) зафиксировано статистически значимое улучшение аксональных электрофизиологических показателей, но при этом некоторые параметры качества жизни, в частности ролевое и социальное функционирование, а также боль, не имели положительных сдвигов относительно 3-го визита.
Важно отметить, что положительная динамика клинической картины, наблюдавшаяся на 4-м визите, отражает процесс аксональной регенерации. По данным Ф. И. Девликамовой [5], изучавшей электрофизиологические показатели при диабетической сенсомоторной нейропатии, Кокарнит воздействует преимущественно на более грубо измененные волокна. Под действием компонентов препарата улучшаются энергообеспечение и трофика нервной ткани, повышаются резервы антиоксидантной и эндогенной антиноцицептивной систем. За более продолжительный период наблюдения пациентов (через 3 месяца) отмечена способность препарата к восстановлению нервных волокон и улучшению нервной проводимости, что позволяет предположить участие основных компонентов Кокарнита в механизмах нейропластичности.
ЗАКЛЮЧЕНИЕ
Влияние Кокарнита на ключевое звено диабетической полинейропатии — окислительный стресс — обеспечивает его нейрометаболическое и ангиопротекторное действие. Для достижения максимального эффекта рекомендовано как можно более раннее назначение Кокарнита, а также проведение курсов лечения несколько раз в год.








