ВВЕДЕНИЕ
Болезнь Паркинсона (БП) является одним из наиболее часто встречающихся нейродегенеративных заболеваний у пожилых людей. Проблема усугубляется тем, что в настоящее время наблюдается тенденция к уменьшению среднего возраста лиц с данной патологией. Этиология БП достоверно не известна, факторами риска считаются пожилой возраст, генетическая предрасположенность, воздействие неблагоприятных факторов окружающей среды. Патогенез БП связан с гибелью нейронов, составляющих важнейшую часть экстрапирамидной системы и вырабатывающих дофамин (ДА). БП характеризуется не только двигательными, но и когнитивными, вегетативными, психическими нарушениями, сенсорными и диссомническими симптомами.
В настоящее время основной является теория длительного латентного периода БП[1, 2], что делает актуальной задачу ее диагностики на доклинической стадии.
Один из наиболее современных и перспективных методов диагностики БП и ряда других заболеваний — позитронно-эмиссионная томография (ПЭТ). В основе ПЭТ лежит регистрация гамма-квантов, которые излучаются при аннигиляции электрона с позитроном, возникающим при распаде радиофармпрепарата (РФП). РФП состоит из биологически активного вещества (БАВ), меченного позитрон-излучающим радиоизотопом. Основная задача при диагностике заболеваний с помощью ПЭТ заключается в выборе РФП, БАВ которого активно задействовано в метаболизме конкретного органа или новообразования. Важными требованиями к используемому изотопу являются короткий период полураспада и слабое поглощение тканями излучения низкой энергии, что необходимо для обеспечения минимальной лучевой нагрузки на организм человека, а также высокого разрешения получаемого изображения.
Достоинством ПЭТ в диагностике БП является высокая чувствительность к изменениям метаболизма визуализируемых структур до наступления атрофии. ПЭТ-исследование позволяет однозначно определить недостаток ключевого звена в патогенезе БП — ДА, что дает возможность обнаружить болезнь даже на ранних стадиях ее развития.
Оптимальный РФП для исследования дофаминергической системы — леводопа, меченная фтором-18 (18F-DOPA). С помощью этого препарата можно оценить активность фермента допадекарбоксилазы в пресинаптических дофаминергических терминалях, а также накопление ДА в нейронах полосатого тела. Леводопа является аминокислотой, непосредственным предшественником ДА. В отличие от ДА, она способна проникать через гематоэнцефалический барьер (ГЭБ) с помощью переносчика. По степени накопления 18F-DOPA в клетках головного мозга, в частности в клетках черной субстанции, можно судить о работе дофаминергических нейронов.
Клиническое использование 18F-DOPA до настоящего времени является ограниченным, так как согласно общераспространенной практике оценка активности этого РФП у пациентов с БП проводится с использованием сложных кинетических моделей. Такой подход требует длительного (не < 90 минут) динамического сканирования, что, как правило, приводит к снижению качества получаемых изображений из-за двигательных артефактов. Однако в работе I.L. Alves и соавт. показано, что протоколы статического сканирования с исследованием активности ДА в подкорковых структурах не уступают динамическим протоколам в точности количественной оценки пресинаптической дофаминовой функции[3]. Это делает применение 18F-DOPA эффективным методом обследования пациентов с нарушениями дофаминергической системы.
Являясь мощным средством исследования состояния больного, ПЭТ сама по себе не влечет за собой постановки окончательного диагноза либо выработки рекомендаций по лечению. Конкретная характеристика того или иного процесса при применении этого метода определяется выбором радиолиганда. Результатом обследования является набор числовых значений различных показателей, в частности характеризующих метаболизм ДА в головном мозге пациента, которые помогают врачу сделать вывод о состоянии больного и определить тактику лечения. Для интерпретации данных, полученных с помощью ПЭТ, необходимы представления о том, в каких пределах лежат нормальные значения показателей. При этом значения нормы зависят как от точности используемого прибора, так и от популяционной изменчивости показателей.
Наиболее распространенным РФП для ПЭТ-диагностики БП является 18F-фтордезоксиглюкоза (18F-ФДГ), однако применение этого препарата не позволяет решить ряд задач, связанных с ранней диагностикой БП, поскольку дает неспецифические результаты[4]. 18F-DOPA обеспечивает эффективное решение задач ранней диагностики БП, но, как отмечено выше, распространенность этого препарата в медицинских исследованиях в настоящее время невысока. Разрабатываются также другие РФП, одним из наиболее перспективных считается [18F]LBT-999 — производное кокаина[5].
18F-DOPA, являясь аналогом леводопы, связывается с декарбоксилазой ароматических аминокислот и генерирует позитронный выброс. Уровень захвата 18F‑DOPA определяется проникновением РФП через ГЭБ, декарбоксилированием до фтордофамина и накоплением в терминалях нейронов[6]. Снижение метаболизма ДА начинается в дорсокаудальном отделе скорлупы на стороне, противоположной клиническому поражению. Значительные изменения метаболизма видны на ранних этапах развития БП, когда клинические проявления еще отсутствуют. Накопление 18F-DOPA в полосатом теле коррелирует с числом клеток черной субстанции и активностью тирозингидроксилазы, содержащейся в полосатом теле. Кроме того, поглощение 18F-DOPA коррелирует с возрастанием суммы баллов при оценке брадикинезии и ригидности. При этом не наблюдается сколько-нибудь значимой корреляции с показателями тремора, что указывает на то, что патогенез тремора связан не только с дофаминергической системой[7].
P.В. Jokinen и соавт. представлено исследование с применением 18F-DOPA, в котором регистрировались значения стриатально-затылочного отношения и константа притока в задней части путамена на стороне, противоположной клиническим проявлениям, — в группе БП они были значительно ниже, чем у здоровых людей[8]. В работе[8] при помощи ROC-анализа было показано, что исследование задней части путамена диагностически более ценно, чем исследование хвостатого ядра и передней части стриатума, о чем свидетельствуют и другие авторы[9]. 18F-DOPA применяется также для дифференциальной диагностики атипичного паркинсонизма и идиопатического синдрома паркинсонизма. При этом последний отличается прежде всего более линейным снижением метаболизма ДА от передней к задней части путамена[10].
В работе Ю.Г. Хоменко и соавт. сопоставлены данные магнитно-резонансной спектроскопии и ПЭТ с 18F-ФДГ — показана обратная зависимость скорости метаболизма глюкозы (СМГ) от отношения концентрации холина к концентрации креатинина у больных БП[11]. Такая взаимосвязь не была обнаружена при других неврологических патологиях, что позволяет установить истинный патогенез БП. Изменение СМГ наблюдается уже на ранних этапах нарушения функции лобных долей. Кроме того, показана бо́льшая чувствительность теста батареи лобной дисфункции к когнитивным нарушениям у больных БП в сравнении с методикой краткой оценки психического статуса[12]. Для уточнения диагноза БП и обоснования применения заместительной терапии ДА может использоваться нейровизуализация переносчиков ДА с помощью ПЭТ и однофотонной эмиссионной компьютерной томографии[13].
При БП наблюдается большое количество поведенческих осложнений, патогенез которых до конца не изучен; к таким осложнениям относятся беспокойство, депрессия, апатия и психоз[14]. Исследование депрессии и тревоги как неспецифических симптомов БП показало, что они могут быть связаны со специфической потерей ДА и норадреналина в лимбической системе[15]. Продемонстрирована связь депрессии при БП с недостатком серотонина в ядрах шва и лимбических структурах[16]. В число наиболее изученных немоторных проявлений БП входит также ольфакторная дисфункция. В работе M. Löhle и соавт. описаны значимые умеренные корреляции между эффективным объемным соотношением ДА и комплексной оценкой обоняния[17]. Более подробное обсуждение этих работ выходит за рамки данной публикации.
В настоящее время не существует единых показателей нормы для интерпретации результатов ПЭТ, проводимой на разных аппаратах и с разными РФП. Необходимость установления нормы для различных аппаратов и РФП обусловливается конструктивными и технологическими особенностями используемых аппаратов и различиями в фармакокинетике РФП. Для получения нормативных показателей следует провести обследование контрольной группы условно здоровых пациентов и по его результатам определить значения показателей, которые могут считаться нормальными, а также указать диапазон их изменчивости, в пределах которого пациент может считаться здоровым. Если исходить из того, что точность используемых приборов заведомо достаточна для проведения любых обследований, необходимо сконцентрироваться на вопросе о популяционной вариабельности показателей и определении нормы для них. При этом одной из важных проблем становится установление величины выборки контрольной группы, по которой будет определяться норма для показателей, получаемых с помощью ПЭТ.
Цель исследования: определение нормативных значений для показателей ПЭТ головного мозга с применением 18F-DOPA по результатам обследования условно здоровых лиц.
Основные задачи: определение показателей ПЭТ-обследования у условно здоровых лиц, а также установление величины выборки, по которой можно с достаточной степенью надежности судить о норме того или иного показателя.
МАТЕРИАЛЫ И МЕТОДЫ
Работа проведена в период с 2017 по 2020 г. на базе Федерального Сибирского научно-клинического центра (ФСНКЦ) ФМБА России (генеральный директор центра — Баранкин Б.В.). Непосредственно ПЭТ-исследования выполнялись на базе структурного подразделения ФСНКЦ ФМБА России — Центра ядерной медицины (директор — Чанчикова Н.Г.), МРТ-исследования — на базе диагностического центра «МРТ-Эксперт Красноярск» (директор — Елистратова Е.А.). Работы по синтезу РФП и проведение МРТ финансировались за счет государственного задания «Использование молекулярно-генетического анализа для оценки риска раннего развития нейродегенеративных заболеваний» (78.001.17.800).
Все аспекты исследования полностью соответствовали стандартам надлежащей клинической практики (англ. Good Clinical Practice). Программа исследования, форма информированного согласия и форма информационного листка пациента были предварительно одобрены на заседании локального этического комитета при ФСНКЦ ФМБА России. Все предусмотренные процедуры проводились строго после подписания обследуемыми информированного согласия.
Критериями включения в исследование были:
- возраст старше 18 лет;
- способность прочитать информацию, изложенную в информационном листке пациента, и подписать форму информированного согласия;
- отсутствие диагностированных органических поражений головного мозга (текущих или в анамнезе);
- отсутствие неврологических жалоб на момент включения в исследование.
Критериями исключения являлись:
- обнаружение признаков неврологической патологии при осмотре;
- противопоказания к проведению МРТ (включая наличие имплантируемых кардиостимуляторов и металлоконструкций, клаустрофобии);
- беременность и кормление грудью;
- соматические заболевания в стадии декомпенсации;
- признаки психических расстройств на момент включения в исследование.
У обследуемого должны были присутствовать все критерии включения и отсутствовать все критерии исключения.
Сформированная группа исследования состояла из 33 человек — 21 женщины и 12 мужчин, не имевших выраженных соматических заболеваний. Возраст участников колебался от 21 года до 80 лет и в среднем составлял 51,9 ± 14,9 года.
Всем пациентам первоначально была выполнена МРТ головного мозга для исключения структурных изменений и сопоставления МРТ- и ПЭТ-изображений. МРТ проводилась на аппарате Philips Intera 1,5T (Philips, Нидерланды) по стандартной программе (FLAIR аксиальный, T2 корональный и Т1 сагиттальный срезы), дополненной Т1- и Т2-аксиальным сканированием тонкими (2-миллиметровыми) срезами с прицелом на область черной субстанции и красных ядер.
ПЭТ/КТ-исследование с 18F-DOPA выполнялось как минимум через 4 часа после последнего приема пищи. Доза вводимого в кубитальную вену РФП рассчитывалась индивидуально из расчета 110 МБк на 1 м2 площади поверхности тела и составляла от 170 до 260 МБк. Через 50 минут после введения 18F-DOPA проводилось статическое 3D-сканирование в течение 20 минут на ПЭТ/КТ-сканере Discovery 600 (GE Healthcare, США). Для коррекции аттенуации осуществлялось низкодозное КТ-сканирование (120 кВ, 80 мА) с толщиной томографического слоя 3 мм. Полученные изображения анализировали на рабочей станции AW Volum Share 5 (GE Healthcare, США) с помощью программного пакета РЕТ/CT Review (GE Healthcare, США). Для более четкого сопоставления сцинтиграфического изображения со структурами головного мозга ПЭТ-серии совмещали с Т1-аксиальными тонкосрезовыми МРТ-изображениями с помощью программы Integrated Registration (GE Healthcare, США).
Уровень аккумуляции РФП измеряли путем размещения области интереса (ROI) в бледном шаре и головке хвостатого ядра. Кроме того, была измерен уровень поглощения 18F-DOPA в затылочной коре в качестве референсной зоны, так как считается, что этот регион отличается неспецифическим накоплением радиотрейсера. Анализировали как абсолютные значения активности в килобеккерелях на миллилитр (кБк/мл), так и нормализованные показатели — соотношения активности стриатум / затылочная кора (SOR) и хвостатое ядро / затылочная кора (COR). Кроме того, учитывали отношение активности в стриатуме к активности в хвостатом ядре (SCR), так как у пациентов с нарушениями дофаминергической системы наблюдается его изменение.
Полученные данные были занесены в базу Microsoft Excel и обработаны в программе IBM SPSS Statistics 23 классическими методами статистического анализа: определяли величины среднего значения, медианы и стандартного отклонения показателей; проверяли нормальность распределения с помощью критерия Шапиро — Уилка; устанавливали собственные значения матрицы ковариаций и коэффициенты корреляции Спирмена и Пирсона. Для оценки сочетанного разброса (объясненной дисперсии) проводили анализ главных компонент. Кроме того, были использованы мера выборочной адекватности Кайзера — Мейера — Олкина и критерий сферичности Бартлетта, а также критерий «каменистой осыпи» Кеттела для определения количества факторов в модели.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты ПЭТ-обследования включают в себя данные по активности РФП в различных зонах головного мозга: скорлупе, хвостатом ядре и затылочной коре справа и слева. В исследовательских и диагностических целях используются как абсолютные значения активности, так относительные показатели. Последние представляют собой соотношения абсолютных показателей, определяемых для каждого полушария головного мозга отдельно; смысл относительных показателей заключается в измерении одних показателей в единицах других.
Чтобы избежать ошибок в восприятии результатов ПЭТ-обследования, аббревиатурами, написанными кириллицей, обозначались абсолютные значения измеряемых показателей, латиницей — относительные значения, полученные из абсолютных.
Установление размера выборки требует предварительного знания характера распределения тех данных, которые по такой выборке будут определяться. Ввиду того что в представленном исследовании данная информация отсутствовала, для оценки характера распределения и его статистической устойчивости была проведена серия измерений во все возраставшей выборке. При этом величина выборки оценивалась с использованием обеих возможных стратегий: по каждой отдельной переменной и по совокупности данных для многомерного случая, т. е. с учетом связей, наблюдавшихся в данных.
На первом этапе был проведен элементарный статистический анализ базы условно здоровых пациентов (n = 33). Для этого по каждому из 12 показателей были определены величины среднего значения, медианы и стандартного отклонения (табл. 1). Затем каждый из этих показателей был проверен на нормальность распределения с помощью критерия Шапиро — Уилка; оказалось, что все абсолютные показатели не являются нормально распределенными, а все относительные — являются.
Таблица 1
Среднее значение (N), медиана (M) и стандартное отклонение (σ) исследованных показателей
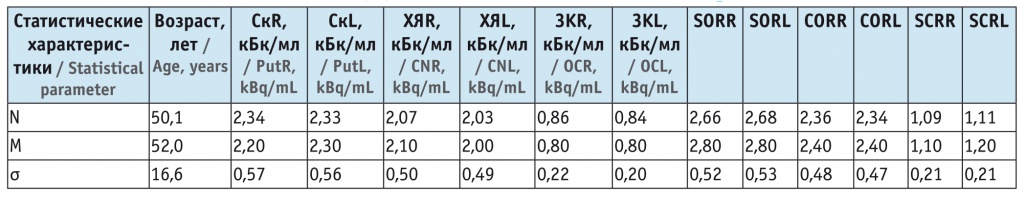
Примечание. В таблицах 1–6: Ск — скорлупа головного мозга; ХЯ — хвостатое ядро; ЗК — затылочная кора; SOR, COR, SCR — отношения активности стриатум / затылочная кора, хвостатое ядро / затылочная кора и стриатум / хвостатое ядро соответственно; R — справа; L — слева.
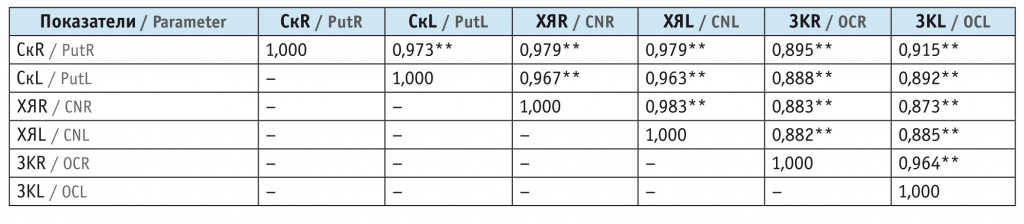
Для выявления линейных связей между показателями был проведен корреляционный анализ: подсчитывались коэффициенты ковариации и корреляции отдельно для абсолютных и относительных показателей. Собственные значения матрицы ковариаций позволяют точно оценить линейную размерность пространства исследуемых данных (табл. 2, 3).
Таблица 2
Собственные значения матрицы ковариаций абсолютных показателей
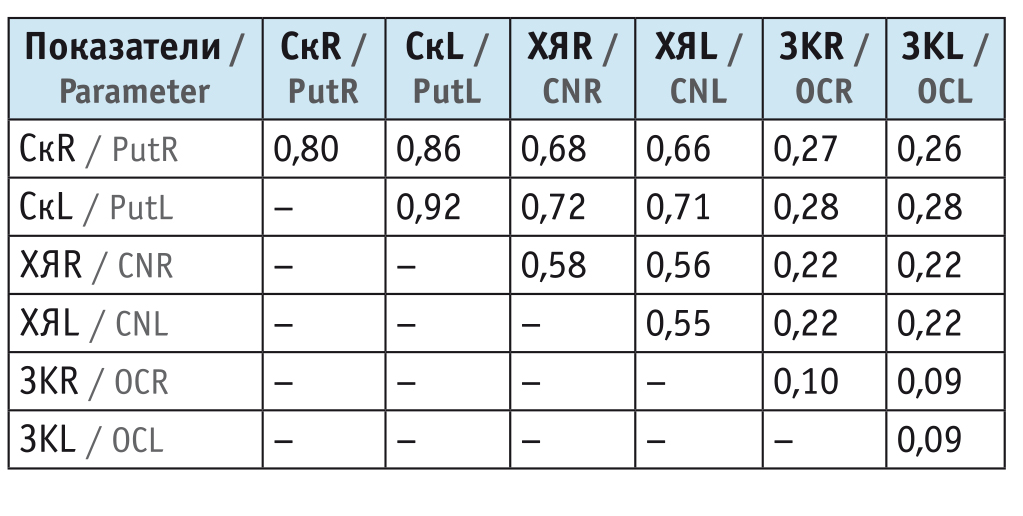
Таблица 3
Собственные значения матрицы ковариаций относительных показателей
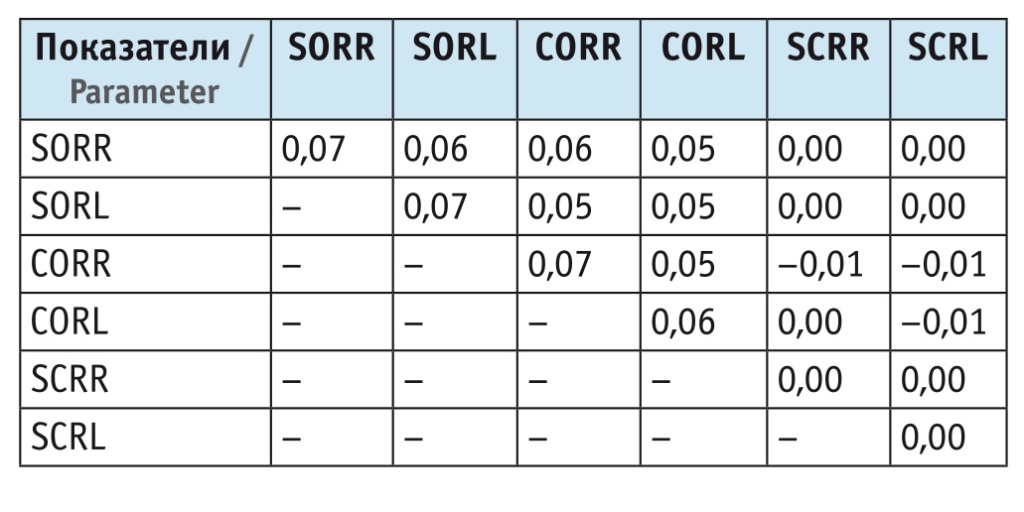
Для относительных показателей, подчинявшихся нормальному закону распределения, были определены коэффициенты корреляции Пирсона (табл. 4), а для абсолютных показателей, распределение которых статистически значимо отличалось от нормального, — коэффициенты корреляции Спирмена (табл. 5).
Таблица 4
Коэффициенты корреляции Пирсона между относительными показателями
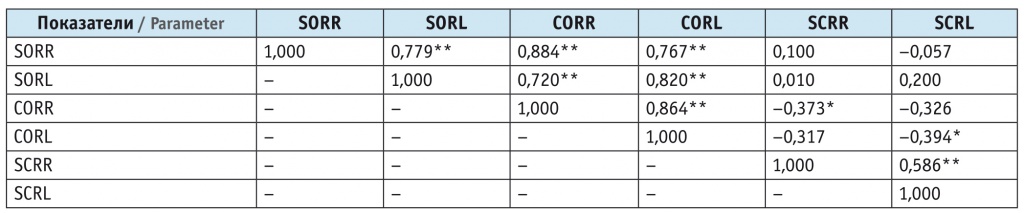
Примечание. В таблицах 4, 5: (*) — коэффициент корреляции значим на уровне 0,05; (**) — коэффициент корреляции значим на уровне 0,001.
Таблица 5
Коэффициенты корреляции Спирмена между абсолютными показателями
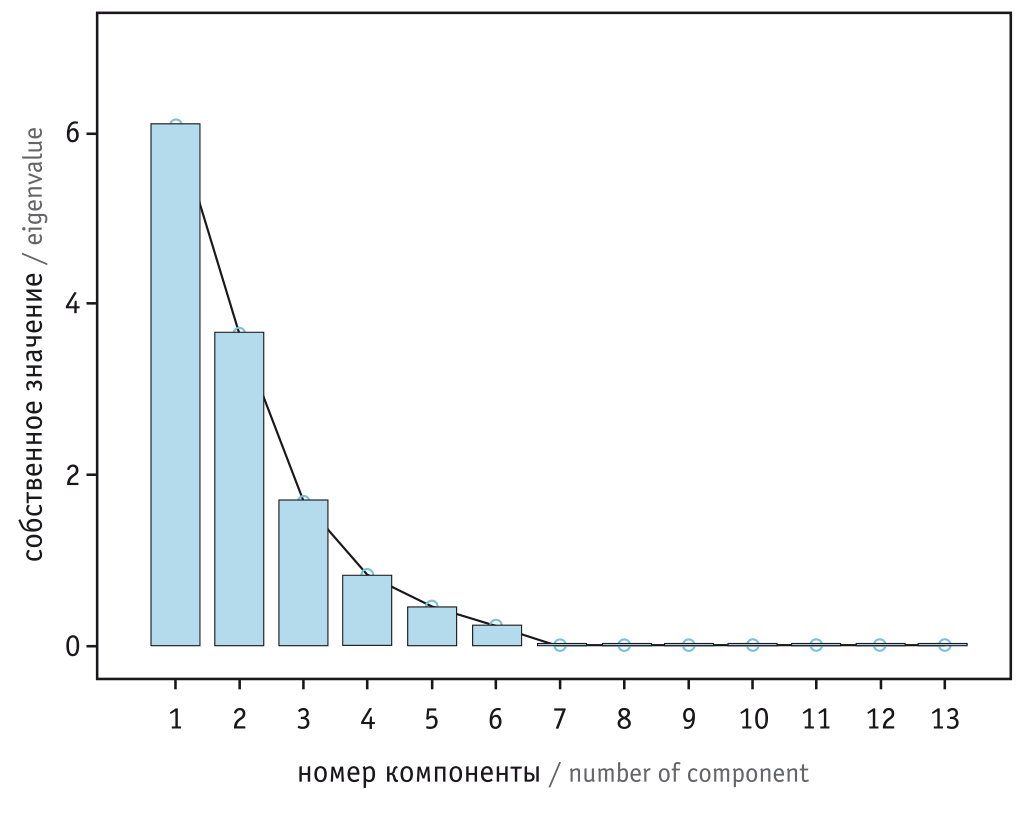
В целях оценки сочетанного разброса (объясненной дисперсии) данных был выполнен анализ главных компонент. Нулевая гипотеза о том, что частные корреляции между переменными малы, проверялась с использованием меры выборочной адекватности Кайзера — Мейера — Олкина, гипотеза о том, что корреляционная матрица является единичной матрицей, — с применением критерия сферичности Бартлетта. Обе эти гипотезы были отвергнуты, т. е. оказалось, что между данными показателями имеется связь, а значит факторная модель имеет смысл.
Количество факторов в модели определялось с помощью критерия «каменистой осыпи» Кеттела. Как видно из графика собственных значений (рис.), число выделенных факторов должно равняться трем.
Рис. График собственных значений
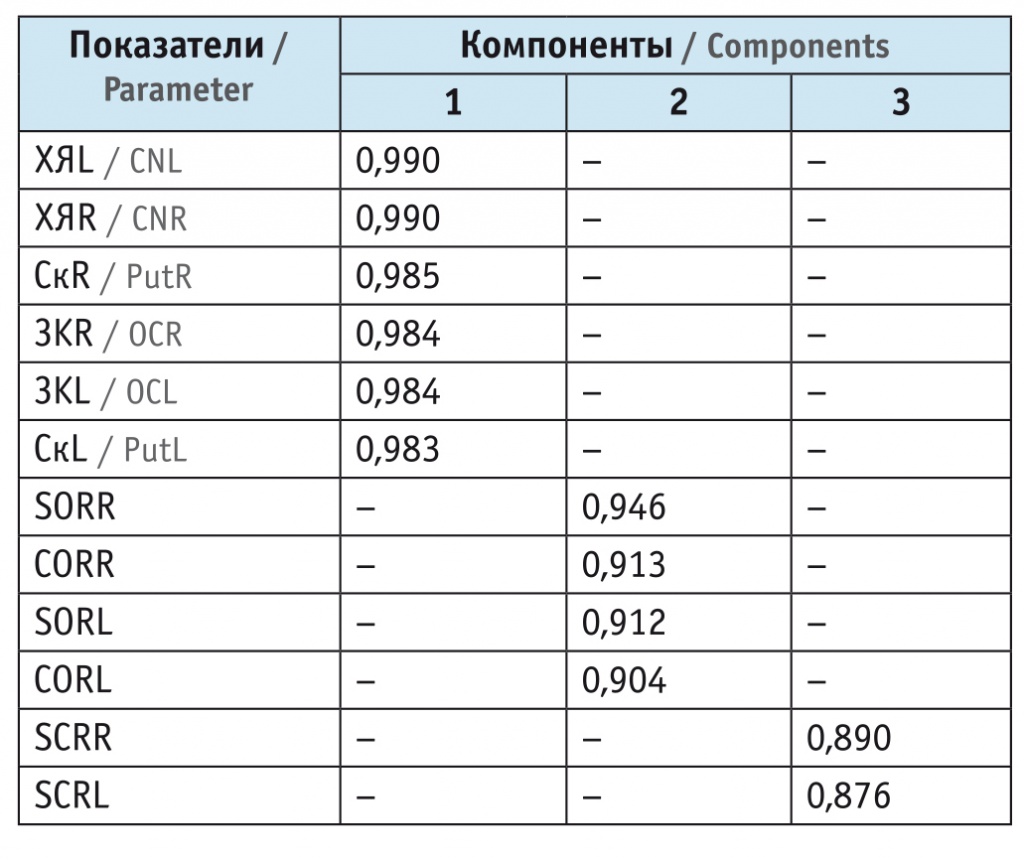
Из таблицы 6 следует, что первый фактор характеризуется самым большим вкладом во все абсолютные показатели, второй — в ряд относительных показателей (SOR и COR справа и слева), а третий фактор — в показатель SCR справа и слева.
Таблица 6
Транспонированная матрица компонентов
Для проверки устойчивости полученных результатов проводился вычислительный эксперимент, направленный на установление статистической устойчивости значений показателей, установленных у условно здоровых людей. В рамках эксперимента были сформированы три случайных выборки с меньшим числом обследуемых и для этих выборок определялись соответствующие средние либо медианные показатели. Эксперимент показал, что рост числа обследуемых не приводит к изменениям указанных показателей, и это может служить еще одним свидетельством надежности установленных нами данных при использовании в качестве показателей нормы.
Таким образом, для абсолютных показателей нормальными значениями активности РФП следует считать (медиана [1-й квартиль; 3-й квартиль]): активность в скорлупе справа — 2,24 [2,02; 2,80] кБк/мл, слева — 2,26 [2,02; 2,75]; в хвостатом ядре справа — 2,11 [1,78; 2,55] кБк/мл, слева — 2,01 [1,74; 2,49]; в затылочной коре справа и слева — 0,81 [0,71; 1,00] и 0,81 [0,74; 1,02] кБк/мл соответственно. Для относительных показателей, имеющих нормальное распределение, получены следующие значения нормы (средняя величина ± стандартное отклонение): SOR справа — 2,66 ± 0,52, слева — 2,68 ± 0,53; COR справа — 2,36 ± 0,48, слева — 2,34 ± 0,47; SCR справа — 1,09 ± 0,21, слева — 1,11 ± 0,21.
ЗАКЛЮЧЕНИЕ
Значения показателей позитронно-эмиссионной томографии с применением 18F-DOPA для различных участков головного мозга, полученные в представленном исследовании, можно считать стандартными для условно здоровых людей и использовать в качестве базовых значений, относительно которых следует определять отклонения от нормы у больных.
Поступила: 17.08.2020
Принята к публикации: 07.10.2020








