Часть 2 настоящей статьи будет опубликована в журнале «Доктор.Ру» Неврология Психиатрия. Т. 20, № 5 (2021).
Болезнь Паркинсона (БП) — это нейродегенеративное заболевание, наиболее характерное для людей пожилого и старческого возраста, приобретающее все большее социальное значение. В России насчитывается не менее 18 млн пожилых людей. По данным ООН, число лиц старше 65 лет к 2050 г. будет достигать 2 млрд. Соответственно возрастает число людей, страдающих хроническими и нейродегенеративными заболеваниями, включая БП [1].
Исследование процессов нейродегенерации позволило выявить несколько общих путей развития патологического процесса при БП, в том числе накопление аберрантных или неправильно свернутых белков, окислительный стресс, митохондриальную дисфункцию, эксайтотоксичность, синаптическую недостаточность, изменения гомеостаза клетки, недостаточность транспортной функции аксонов и дендритов, дефицит сосудисто-нервного пучка и нейрональное воспаление. Эти патологические процессы активно протекают в течение многих лет, вызывая дисфункции нейронов и приводя в итоге к их гибели еще до появления явных клинических симптомов.
Первые видимые симптомы заболевания проявляются после почти полной деградации нигростриарной дофаминергической системы и истощения компенсаторных механизмов мозга. Как следствие, лечение больных начинается, когда уже практически отсутствуют мишени для воздействия лекарственных средств[2].
С помощью цитохимических исследований выявлено, что внутринейрональные включения телец Леви могут быть обнаружены не только в нейронах черной субстанции, но и в нижних отделах ствола головного мозга, в передних отделах среднего мозга, в лимбической системе и коре. Позднее на основании данных патоморфологического исследования Н. Braak и соавт. предложили 6 стадий течения нейропатологического процесса. Согласно их данным, патологический процесс начинается с поражения обонятельной луковицы, нервного сплетения кишечника и дорсального моторного ядра блуждающего нерва (1-я стадия), что клинически может проявляться возникновением гипосмии и констипации (запоров). Затем, на 2-й стадии, патологический процесс распространяется по мозговому стволу и вовлекает голубоватое место, ядра шва и зоны, ответственные за REM-сон. Клинически могут выявляться нарушение поведения в фазу быстрого сна, депрессия.
Черная субстанция поражается лишь на 3-й стадии нейропатологического процесса. Соответственно, клиническая диагностика БП возможна лишь на 3-й или даже на 4–5-й стадиях, когда нейропатологический процесс распространяется дальше и захватывает кору больших полушарий[3].
За последние два десятилетия методы нейровизуализации, такие как позитронно-эмиссионная томография (ПЭТ), однофотонная эмиссионная компьютерная томография (ОФЭКТ), протонная магнитно-резонансная спектроскопия (МРС) и транскраниальная сонография (ТКС), все чаще используются для прижизненной диагностики БП, выяснения нейропатологических механизмов и компенсаторных реакций, лежащих в основе симптомов заболевания, а также для мониторинга прогрессирования БП[4].
МЕТОДЫ ФУНКЦИОНАЛЬНОЙ НЕЙРОВИЗУАЛИЗАЦИИ
Одной из причин развития характерных симптомов БП является прогрессивное уменьшение количества пресинаптических терминалей в нигростриарной системе. Прижизненно выявить наличие патологического процесса, характерного для БП, позволяют методы функциональной нейровизуализации — ПЭТ, ОФЭКТ, МРС. В настоящее время БП можно рассматривать как системное расстройство с многочисленными моторными и немоторными проявлениями, а также с дегенерацией множества областей ЦНС.
Методы функциональной нейровизуализации внесли значительный вклад в наше понимание БП. Кроме того, в последнее время наблюдается возобновление интереса к визуализации других органов при БП, что связано с большим количеством немоторных симптомов, обусловленных дегенерацией нервных структур за пределами ЦНС.
Такие методы визуализации могут быть разделены на два типа: исследования с использованием радиофармпрепарата, что позволяет напрямую оценить потерю симпатических или парасимпатических нервных окончаний, а также методы визуализации, определяющие транспортную функцию ЖКТ (для оценки дисфагии, функции опорожнения желудка, пищевода и кишечника с измерением транзиторного времени и аноректальной диссинергии)[5].
Позитронно-эмиссионная томография
Функцию пресинаптических дофаминергических терминалей оценивают, исследуя активность декарбоксилазы ароматических аминокислот, активность переносчика дофамина и плотность переносчиков везикулярного моноамина. Для исследования активности декарбоксилазы ароматических аминокислот используется метод ПЭТ с [18F]-флюородопой, который позволяет количественно определить дефицит синтеза и хранения дофамина.
При БП отмечается снижение захвата [18F]-флюородопы нейронами дорсо-каудального отдела скорлупы, более выраженное на противоположной стороне от двигательных расстройств. На ранних стадиях БП скорость дегенерации в хвостатом ядре меньше, чем в скорлупе[6].
Критерием БП является снижение захвата [18F]-флюородопы более чем на 30%. Скорость аккумуляции [18F]-флюородопы в стриатуме отражает процесс транспорта флюородопы в стриатные везикулы и ее последующее декарбоксилирование (рис. 1)[7]. Показано, что снижение захвата [18F]-флюородопы, коррелирующее с усилением выраженности гипокинезии и ригидности, никак не связано с выраженностью тремора.
Рис. 1. Позитронно-эмиссионная томография с [18F]-флюородопой (аксиальный срез на уровне среднего мозга) пациентки 57 лет, страдающей болезнью Паркинсона с преобладанием левосторонней симптоматики; определяется снижение захвата [18F]-флюородопы в скорлупе с обеих сторон и в правом хвостатом ядре[7]. Иллюстрации предоставлены авторами
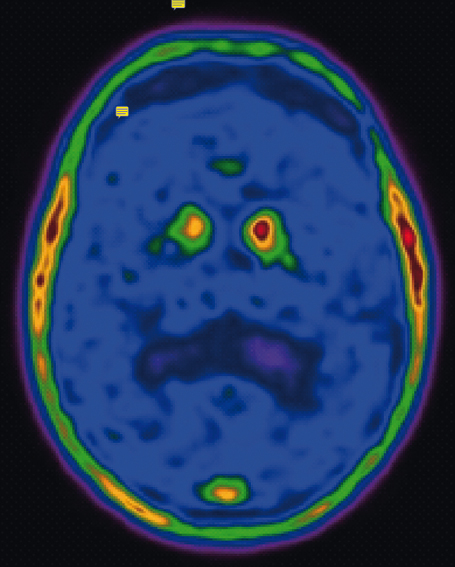
Используя метод ПЭТ с [18F]-флюородопой, возможно провести мониторинг клинического прогрессирования БП. Рассчитана средняя скорость потери дофаминергических нейронов в год, которая составляет 2–9% от первоначального уровня. Кроме того, ПЭТ с [18F]-флюородопой позволяет выявить некоторые отличия моногенных форм БП от спорадических случаев.
У пациентов с мутацией генных локусов PARK1 и/или PARK8 показано снижение поглощения [18F]-флюородопы по сравнению с таковым при идиопатической форме БП. Моногенные формы БП, обусловленные мутациями генных локусов PARK2, PARK6 и PARK7, характеризуются более симметричным поглощением [18F]-флюородопы[2].
Для исследования плотности переносчиков везикулярного моноамина используется ПЭТ с [11С]-дигидротетрабеназином. Активность переносчиков дофамина исследуется с применением [11C]-номифензина, [11C]-RT132. Показано, что на ранних стадиях БП происходит увеличение плотности D2 рецепторов, что, вероятно, является компенсаторной реакцией организма. На развернутой и поздних стадиях БП плотность D1 рецепторов уменьшается, а плотность D2 рецепторов остается относительно сохранной. Исследовать состояние D1 и D2 дофаминовых рецепторов позволяет ПЭТ или ОФЭКТ с использованием лигандов дофаминергических рецепторов: [11C]-SCH23390 для D1 рецепторов и [11С]-раклоприда для D2 рецепторов. Признаком нейродегенерации является увеличение уровня лиганда D2 рецепторов.
Известно, что симпатическая норадренергическая система сердца практически полностью подвергается дегенерации, что подтверждается данными аутопсии. Симпатическая денервация сердца может быть обнаружена in vivo при использовании ПЭТ с [18F]-метайодбензилгуанидином, [11С]-гидроксиэфедрином (hydroxyephedrine, HED). K.К. Wong и соавт. (2017) исследовали симпатическую денервацию сердца у пациентов с БП с помощью HED ПЭТ в течение 2 лет. Показано, что нейродегенеративные процессы в симпатических волокнах сердца у пациентов с БП имели умеренный темп прогрессирования на протяжении 2 лет и характеризовались выраженной гетерогенностью[8].
Y.J. Jeong и соавт. (2016) провели функциональный волюметрический анализ стриатума у пациентов с БП с использованием [18F]-флюородопы, FP-CIT и доказали его эффективность для диагностики БП, а также выявили корреляцию найденных изменений с тяжестью заболевания. Показатели функциональной волюметрии, стриарной волюметрической активности, стриатум-специфические связи (SSB) и объемно-специфический уровень захвата (VSUR) в группе пациентов с БП были значительно ниже[9].
L. Appel и соавт. (2015) изучали достоверность ПЭТ с 11C-PE2I (N-(3-iodoprop-2E-enyl)-2β-carbomethoxy-3β-(4-methyl-phenyl)nortropane) в диагностике БП с использованием двойного контроля в виде ОФЭКТ и ПЭТ (с [18F]-флюородопой). Включены 16 пациентов с БП, которым были проведены ПЭТ с [18F]-флюородопой, 123I-FP-CIT ОФЭКТ и дополнительно экспериментальное исследование 11C-PE2I ПЭТ. Полученные изображения в 11C-PE2I BPND и R1 режимах сканирования показали высокую согласованность с 123I-FP-CIT ОФЭКТ и ПЭТ с [18F]-флюородопой. Корреляции коэффициентов поглощения в скорлупе и хвостатом ядре при 11C-PE2I BPND и 123I-FP-CIT равны 0,97 и 0,76 соответственно.
Визуальная оценка доступности транспортера дофамина показала высокую степень согласованности между данными, полученными с помощью 123I-FP-CIT и 11С-PE2I BPND. Корреляция 11C-PE2I R1 и значений ПЭТ с [18F]-фтордезоксиглюкозой варьировала от умеренной до высокой, при этом более высокая корреляция найдена для корковых областей (рис. 2, 3).
Рис. 2. Сравнение изображений, полученных с помощью 11C-PE2I BPND и 123I-FP-CIT, демонстрирующих уровень транспортера дофамина у пациентов с разными формами паркинсонизма[10].
Примечание. Здесь и в рисунке 3: IPD — идиопатическая болезнь Паркинсона; MSA — мультисистемная атрофия, PSP — прогрессирующий надъядерный паралич, VP — сосудистый паркинсонизм, Normal — здоровый человек
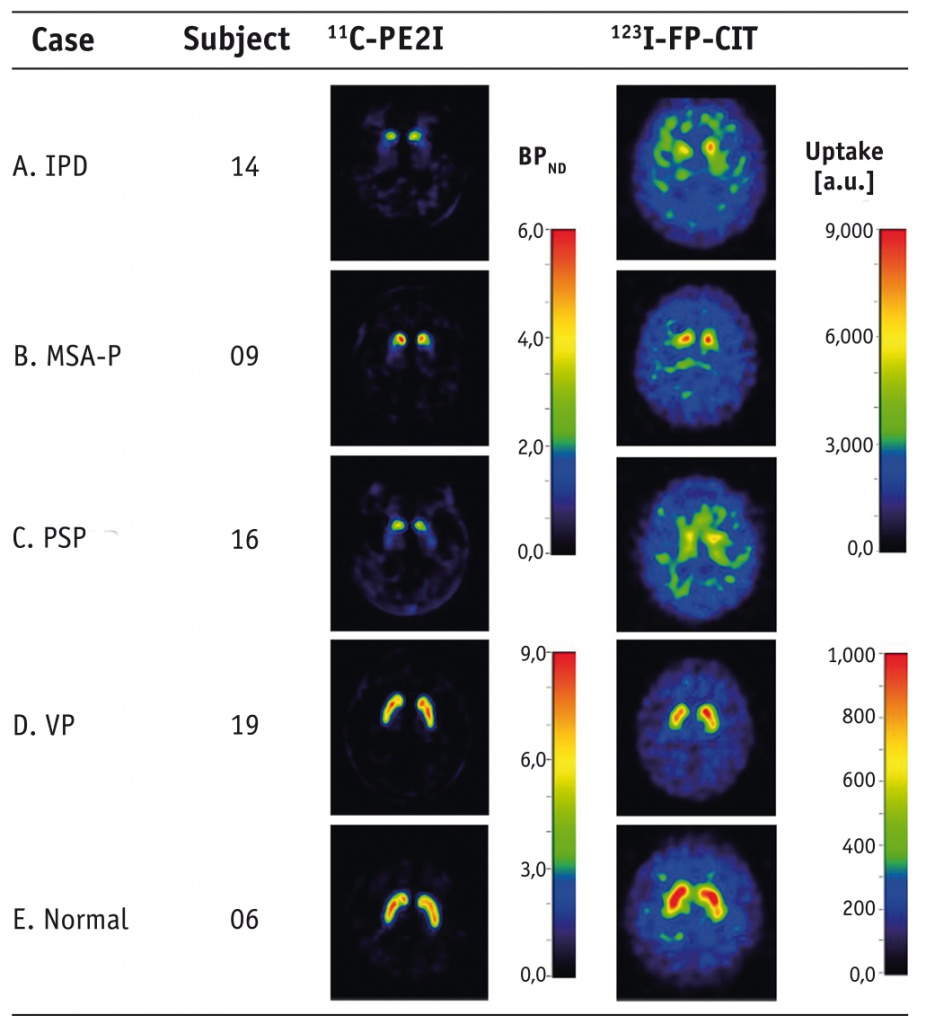
Рис. 3. Сравнение изображений, полученных с помощью 11C-PE2I R1 и позитронно-эмиссионной томографии с [18F]-фтордезоксиглюкозой (18F-FDG), демонстрирующих общую функциональную активность головного мозга у пациентов с разными формами паркинсонизма[10]
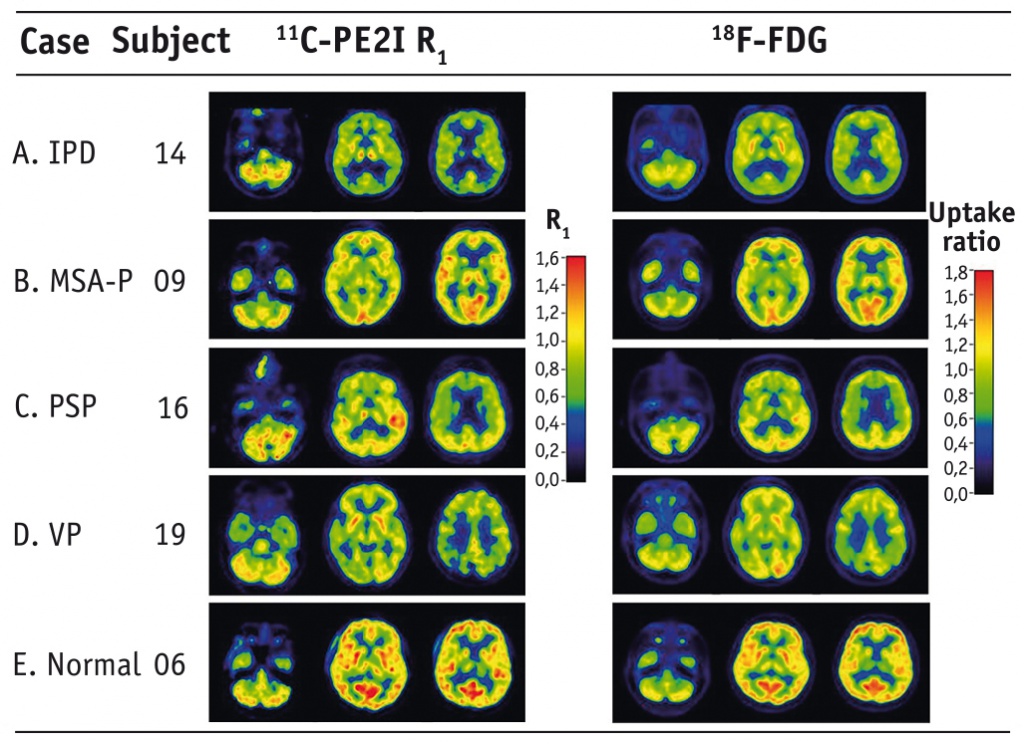
По мнению авторов, исследование C-PE2I ПЭТ является мощной альтернативой 123I-FP-CIT ОФЭКТ и ПЭТ с [18F]-фтордезоксиглюкозой для дифференциальной диагностики паркинсонических синдромов, однако требуются дальнейшие исследования[10].
Однофотонная эмиссионная компьютерная томография
ОФЭКТ — метод функциональной нейровизуализации, который позволяет неинвазивным способом изучать физиологические и патофизиологические явления в мозге. ОФЭКТ, так же как и ПЭТ, является одним из видов ядерной медицинской томографии. Обычно перед проведением ОФЭКТ (за 3–4 часа до процедуры диагностики) пациенту в/в вводят радиофармпрепарат. При проведении ОФЭКТ применяются меченные радиоизотопами радиофармпрепараты, ядра которых при радиоактивном распаде испускают лишь один фотон, в отличие от ПЭТ, где при диагностике используются радиоизотопы, которые испускают позитроны.
В результате регистрации этого явления в специальных камерах создается трехмерное изображение, которые подробно показывает функциональное состояние соответствующего органа пациента. ОФЭКТ может проводиться по методике IBZM или DaTSCAN. Считается, что по технологии DaTSCAN в 97% случаев можно дифференцировать БП от эссенциального тремора. Путем определения количества переносчика дофамина в синаптической щели процедура ОФЭКТ позволяет установить снижение активности выработки дофамина.
Оценить количество переносчика дофамина в синаптической щели можно с помощью радиофармпрепаратов на основе тропана ([123I]-b-CIT, [123I]-FP-СIT или [11С]-CFT). Эти радиолиганды связываются в окончаниях нигростриарных нейронов с мембранным дофаминовым транспортером, который обеспечивает обратный захват дофамина. Для БП характерно асимметричное снижение захвата препарата в скорлупе. Данный метод является более чувствительным маркером БП на ранних стадиях, чем применение [11С]-дигидротетрабеназина и [18F]-флюородопы.
Действительно, методы молекулярной визуализации могут играть решающую роль в диагностике, мониторинге и оценке лиц с риском развития БП. Например, дофаминергическая дисфункция может быть идентифицирована путем обнаружения экспрессии переносчика везикулярного моноамина — VMAT2 (vesicular monoamine transporter) и AADC (aromatic amino acid decarboxylase) — у лиц с высоким риском БП. Эти изменения являются чувствительными и специфичными для немоторной стадии БП[11].
I. Gayed и соавт. (2015) оценили диагностическую ценность ОФЭКТ в гетерогенной группе пациентов с расстройствами движений. В исследование включены 57 пациентов (средний возраст — 63,4 года). Клинический диагноз БП был вероятен у 26 человек и неясен у 31. Выявлены характерные для БП изменения сканов головного мозга у 24 (92%) из 26 пациентов с вероятной БП, у остальных 2 (8%) изменения не найдены. В группе пациентов с неясным диагнозом 15 (48%) имели явно аномальные сканы, 5 (16%) — легкие аномалии, 11 (36%) — нормальные сканы.
Чувствительность и положительная диагностическая ценность ОФЭКТ в группе пациентов с вероятной БП составила 92%. Показана также высокая корреляция полученных изменений со сторонностью симптомов в 32 (82%) из 39 исследований. Авторы подтвердили высокую диагностическую ценность ОФЭКТ DaTSCAN в диагностике БП[12].
F.P. Oliveira и M. Castelo-Branco (2015) для удобства и простоты ОФЭКТ при БП разработали полностью автоматизированный алгоритм [123I]-FP-CIT. Проанализированы 654 скана мозга FP-CIT ОФЭКТ, из них 445 — пациентов с БП на ранней стадии, а остальные обследованные составили контрольную группу. Изображения были предварительно обработаны с использованием автоматической регистрации на основе шаблона с последующим вычислением связывания потенциала на уровне вокселей. Затем изображения были использованы для классификации, основанной на подходе вокселей-как-функции (voxel-as-feature), с применением парадигмы метода опорных векторов (support vector machines).
Полученная точность представленного алгоритма составила 97,86%, чувствительность — 97,75%, специфичность — 98,09%. Достигнутая точность была выше, чем в предыдущих исследованиях, описанных в литературе. Кроме того, результаты получены на большой выборке.
Представленные разработки автоматического алгоритма предоставляют важную дополнительную информацию, помимо обычно используемых коэффициентов поглощения и соответствующих статистических сравнений (ClinicalTrials.gov Identifier: NCT01141023)[13].
ОФЭКТ, как и ПЭТ, также используется для поиска дегенеративных изменений в структурах головного мозга, ответственных за развитие немоторных симптомов БП. Так, D. Frosini и соавт. (2015) исследовали уровень транспортера дофамина ([123I]-FP-CIT-ОФЭКТ) в стриальных и экстрастриальных структурах мозга у 15 пациентов с БП и депрессией и 35 пациентов с БП без депрессии. В группе лиц с БП и депрессией показано значительное снижение связывания изотопа в коре левой поясной извилины. Полученные результаты подтвердили существующую гипотезу о роли дофаминергической денервации в развитии депрессии при БП[14].
M.Т. Pellecchia и соавт. (2015) получили предварительные результаты о том, что истощение дофамина в полосатом теле может способствовать развитию когнитивной недостаточности у пациентов с ранней стадией БП (прежде не получавших дофаминергическую терапию)[15].
Магнитно-резонансная спектроскопия
Метод МРС позволяет проводить анализ спектроскопических сигналов от различных химических соединений, содержащихся в головном мозге. Благодаря этому становятся возможными идентификация и определение в различных структурах головного мозга концентраций естественных метаболитов в виде их пиков. МРС может быть полезным и объективным инструментом обнаружения изменений мозгового метаболизма у пациентов с БП.
В самом деле, МРС дает очень надежные результаты повторного тестирования, позволяет оценить уровни основных метаболитов головного мозга, является неинвазивным и недорогим методом нейровизуализации. Кроме того, ее проведение не требует введения пациенту контрастных агентов, радиоактивных веществ.
Основные метаболиты, регистрируемые с помощью МРС, — N-ацетиласпартат (NAA), холин (Cho), креатин (Cr). Ряд клинических и доклинических исследований показал, что МРС может оценить нейрональную дисфункцию и гибель нейронов, а также сопутствующие патологические клеточные процессы, тем самым давая надежную информацию о нейродегенерации[16]. Нейрохимические изменения, определяемые с помощью МРС, являются независимыми и предшествуют атрофии[17] и, следовательно, обеспечивают и дополняют информативность структурной МРТ.
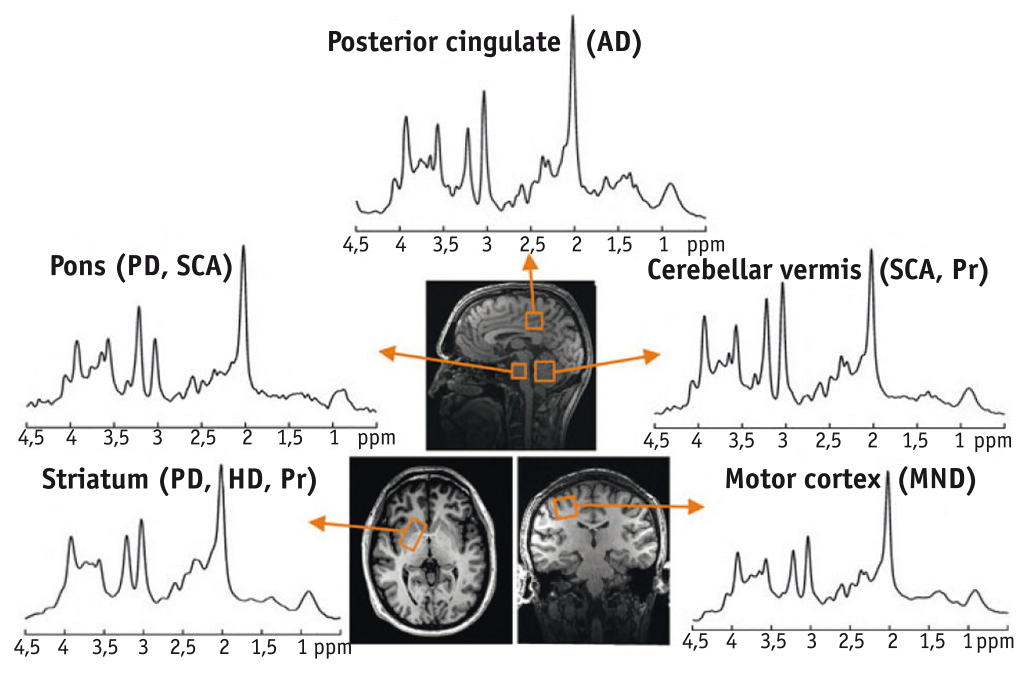
При БП в проекции компактной части черной субстанции выявляются снижение уровня NAA и повышение концентрации Cho, что приводит к статистически значимому уменьшению соотношения NAA/Cho (рис. 4)[18].
Рис. 4. Протонная магнитно-резонансная спектроскопия (semi-LAZER, TR/TE = 5000/28 ms) 4 Тл от различных структур мозга, заинтересованных в нейродегенеративном процессе; воксельная позиция представлена в Т2-взвешенном изображении[18].
Примечание: AD — болезнь Альцгеймера, cerebellar vermis — червь мозжечка, HD — болезнь Гентингтона, MND — болезнь моторного нейрона, motor cortex — двигательная кора, PD — болезнь Паркинсона, pons — ствол мозга, posterior cingulate — задние отделы поясной извилины, Pr — прионные болезни, SCA — спиноцеребеллярная атаксия, striatum — полосатое тело
Некоторые исследования МРС посвящены влиянию противопаркинсонической терапии на нейрохимический и метаболический профиль подкорковых ганглиев. У пациентов с БП отношение NAA/Cho меньше, чем у участников контрольной группы, при этом у не получавших дофаминергическую терапию NAA/Cho значительно ниже, чем у больных, получавших лечение. Аналогичные изменения показаны и для соотношения NAA/Cr. Эти данные свидетельствуют о том, что дофаминергическая терапия способна повлиять на уровень NАА в стриатуме пациентов с БП.
Видимо, клиническое улучшение, вызванное лечением, может быть результатом частичного восстановления нейрональных функций, которое, в свою очередь, способно приводить к повышению уровней корковых метаболитов. В целом, восстановление уровня NАА можно было бы использовать в качестве биомаркера нейронной функции для мониторинга ответа на фармакологическую и немедикаментозную терапию БП[19].
Фосфор (31P)-МРС представляет собой метод визуализации, который измеряет уровни соединений, связанных с энергообменом мозга, в том числе низкоэнергетических метаболитов, таких как свободный фосфат (Pi) и аденозинмоно- и дифосфат (АДФ), и высокоэнергетических фосфатов, таких как аденозинтрифосфат (АТФ) и креатинфосфат (PCr). Поскольку митохондриальная дисфункция рассматривается как начальное событие индукции БП, методы визуализации, в частности 31Р-МРС, способные обнаружить возможное изменение энергетического метаболизма мозга, могут быть полезным инструментом для ранней диагностики БП.
Для оценки энергетического метаболизма мозга проведены комбинированные (31P- и 1H-МРС на 3 Тс) измерения уровней АДФ, АТФ, Cr и PCr в группах пациентов с ранней и развернутой стадиями БП. В скорлупе и среднем мозге пациентов обеих групп, в отличие от лиц контрольной группы, обнаружено двустороннее снижение содержания высокоэнергетических фосфатов АТФ и PCr. Однако уровни низкоэнергетических метаболитов (АДФ и Pi) были в пределах нормы.
У больных с ранней стадией БП с четко латерализованными двигательными симптомами в скорлупе наблюдалось значительное уменьшение концентраций высокоэнергетических фосфатов в менее пораженном полушарии с менее выраженной потерей дофаминергических клеток[20], хотя недавно проведенное исследование 31P- и 1H-МРС на 3 Тс не обнаружило метаболические нарушения у пациентов с ранней стадией БП по сравнению с контрольной группой[16]. Для уточнения диагностической ценности данного метода МРС требуются дальнейшие исследования.
Недавние технические достижения, в том числе наличие более высоких магнитных полей и разработка надежных абсолютных методов количественной оценки метаболитов, позволили больше узнать о патофизиологии БП. В частности, снижение уровней NAA в подкорковых ганглиях отражает потерю нейронов и митохондриальные метаболические нарушения при БП. В то же время изменения концентраций Glu и γ-аминомасляной кислоты, обнаруженные в базальных ганглиях пациентов с БП, может наводит на мысль о дисфункции возбуждающих и тормозящих путей, которые участвуют в контроле движений.
Несколько исследований показали пользу МРС в дифференциальной диагностике БП с другими формами паркинсонизма, особенно на ранних стадиях заболевания, когда симптомы различных форм паркинсонизма схожи. Кроме того, существуют доказательства того, что МРС может быть нейровизуализационным маркером не только для ранней стадии БП и ее дифференциальной диагностики, но и для оценки эффективности лечения.
Тем не менее исследования, проведенные до настоящего времени, крайне неоднородны. Поэтому в дальнейшем нужны многоцентровые исследования на более крупных выборках пациентов с БП, МРС в сильных магнитных полях, стандартизированные методы сбора и обработки спектроскопических сигналов метаболита. Необходимо также использование абсолютного количественного определения концентрации метаболита в ткани, чтобы окончательно доказать роль МРС в молекулярной визуализации БП[19].
Транскраниальная сонография
Существует достаточно большое количество зарубежных публикаций, посвященных применению ТКС в диагностике БП. Физические принципы ТКС, основанные на отражении ультразвуковых волн от неоднородных структур, обладающих различным акустическим сопротивлением (В-режим), позволяют выявлять характерные изменения черной субстанции, шва мозга, базальных ганглиев, ядер мозжечка, которые невозможно определить иными нейровизуализационными методами с другими физическими принципами получения изображения.
По данным Х. Li и соавт. (2013), чувствительность и специфичность ТКС черной субстанции в диагностике БП составляют 64,7% и 60% соответственно (в качестве контроля использовалась ОФЭКТ), в то время как положительная и отрицательная прогностическая ценность — 91,67% и 20% соответственно[20]. Диагностическая ценность ТКС у симптомных пациентов показана и в исследовании P. Liu и соавт. (2014). По данным авторов, ТКС имеет высокую прогностическую ценность при БП. Положительный результат ТКС доказывает наличие БП без необходимости проведения ПЭТ, но диагностическая точность ТКС на раннем этапе БП остается спорной. Чувствительность и специфичность ТКС составили 68,75% и 40% соответственно. В 31,25% случаев получен ложноотрицательный результат. Авторы заключили, что ТКС не может быть рекомендована пациентам с ранней стадией БП. Отрицательный результат ТКС не исключает диагноз БП[21].
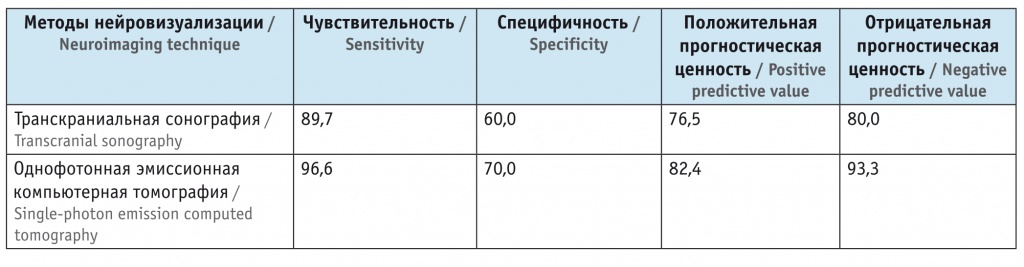
Схожие денные получены и в исследовании A.E. Bouwmans и соавт. (2013)[22]. P. Bаrtovа и соавт. (2014) также исследовали диагностическую ценность ТКС на ранней стадии БП, но результаты сопоставляли с данными ОФЭКТ (табл.). Таким образом, результаты ТКС и ОФЭКТ значимо коррелируют с диагнозом БП (κ = 0,52, 95%-ный ДИ: 0,27–0,76; κ = 0,69, 95%-ный ДИ: 0,49–0,90 соответственно)[23].
Таблица
Сравнение результатов транскраниальной сонографии и однофотонной эмиссионной компьютерной томографии, по данным Р. Bаrtovа и соавт.[23], %
В исследовании S. Hellwig и соавт. (2014) показана роль ТКС в дифференциальной диагностике паркинсонизма. В исследование включены 36 пациентов с клиникой атипичного паркинсонизма. Полученные результаты ТКС сопоставили с данными ПЭТ, а также с клиническим диагнозом (период наблюдения — 9 месяцев). Показано, что чувствительность и специфичность диагностики атипичного паркинсонизма составили 82% и 85% соответственно. Диагностическая точность ПЭТ (90%) и ТКС (83%) значимо не различались (р = 0,69). Таким образом, ПЭТ и TКС показывают сопоставимую точность для дифференциальной диагностики паркинсонизма[24].
Преимуществами метода ТКС являются неинвазивность, широкая доступность в клинической практике, короткое время и относительно невысокая стоимость исследования, возможность проведения неограниченного количества исследований без риска для здоровья больного. Кроме того, ТКС не зависит от двигательной активности пациентов, что особенно важно для больных с экстрапирамидными расстройствами и с гиперкинетической активностью. В связи с этим ТКС представляется перспективным инструментальным методом для скрининга и рутинной диагностики заболеваний.
ЗАКЛЮЧЕНИЕ
Мы нуждаемся в появлении доступного и достоверного метода диагностики болезни Паркинсона (БП), что особенно актуально для больных на ранней, доклинической стадии заболевания, а также для лиц с высоким риском развития БП. Наряду с инструментальными методами диагностики активно разрабатываются и лабораторные маркеры БП. Но их выбор значительно усложняется, принимая во внимание генетическую и, как следствие, биохимическую гетерогенность заболевания.
Доступные методы функциональной нейровизуализации, бесспорно, достоверны в диагностике и немоторной стадии БП, но их недостатками по-прежнему остаются низкая доступность, высокая стоимость, необходимость введения фармпрепаратов, лучевая нагрузка, что не позволяет использовать их широко.
Поступила: 01.09.2020
Принята к публикации: 26.10.2020








