Лица с ограниченными возможностями составляют около 10% населения земного шара, и с каждым годом число инвалидов увеличивается, несмотря на значительный прогресс медицинских технологий. На сегодняшний день одной из приоритетных задач является разработка эффективных программ реабилитации лиц с травматической болезнью спинного мозга (ТБСМ) с включением технологий с биологической обратной связью (БОС) [1–8].
Появление новых аппаратно-программных комплексов с БОС, которые помогают дозировать механическую нагрузку при выполнении движений, позволило значительно расширить возможности реабилитации. По данным ряда авторов, БОС приобретает большую ценность как метод оптимизации состояния функциональных систем организма [5, 9–13]. Спектр применения метода БОС очень широк, а одним из наиболее перспективных направлений его реализации является использование различных электронных устройств, воспринимающих изменение физиологических параметров и преобразующих снятую ими информацию в звуковые, зрительные, тактильные и другие сигналы обратной связи. Получая объективную информацию по соответствующей методике, пациент под наблюдением специалиста или самостоятельно развивает возможности управления резервами собственного организма [12, 14, 15].
Тренировка мышц на аппаратных комплексах с БОС — эффективный и перспективный метод реабилитации лиц с ТБСМ [9, 10, 16–20].
Целью исследования явилось изучение возможностей технологий с биологической обратной связью у лиц, занимающихся адаптивной физической культурой.
МАТЕРИАЛЫ И МЕТОДЫ
Под наблюдением на базе центра реабилитации Госпиталя для ветеранов войн Министерства здравоохранения Республики Татарстан (г. Казань) находились 48 пациентов с ТБСМ с повреждением поясничного отдела спинного мозга. Возраст больных составлял 25,8 ± 2,1 года, давность заболевания варьировала от 1,5 года до 6 лет. Пациенты были рандомизированы на две группы.
Первая (основная) группа — 18 пациентов, получавших стандартную терапию, а также активную механотерапию с БОС под контролем электромиографии (ЭМГ) мышц верхних и нижних конечностей и мышц спины с помощью аппаратно-программного комплекса EN-TreeM (Нидерланды), активно-пассивную электростимуляцию с БОС под контролем ЭМГ мышц спины и нижних конечностей. Проводили 10–12 занятий на увеличение мышечной силы и 10–12 занятий на повышение выносливости мышц нижних конечностей, длительность каждого занятия составляла 45–60 минут. Применяли импульсы с несущей частотой 2,5–4 кГц премодулированным прерывистым переменным током в изопланарном векторном поле с частотой импульсов 20–40 Гц, соотношением интервала 1 : 2 при волновой программе интенсивностью 6–7 мА/мин, максимальной силе тока 80 мА до появления безболезненного видимого сокращения. Длительность процедур — 10–12 минут на поле, количество процедур — 10–12 с повторными курсами через 2–3 месяца.
Вторая (контрольная) группа — 30 пациентов, получавших стандартную терапию: индивидуальную и групповую лечебную гимнастику, массаж, электромиостимуляцию без БОС с помощью аппарата «Стимул-1» (Россия) с частотой 30 Гц при силе тока до 15–40 мА, пассивную механотерапию без БОС на верхние и нижние конечности на аппарате Artromot (Германия). Количество процедур — 10–12 с повторными курсами через 2–3 месяца.
Для оценки эффективности медицинской реабилитации использовали клинические шкалы, классификацию Американской ассоциации спинальной травмы (англ. American Spinal Injury Association, ASIA), Шкалу функциональной независимости (англ. Functional Independence Measure, FIM), модифицированную Функциональную оценочную шкалу активности и качества жизни (итал. Valutazione Funzionale Mielolesi, VFM), опросник «Самочувствие, активность, настроение» (САН), психологический тест Спилбергера — Ханина. Осуществляли электронейрофизиологические исследования на аппарате «Нейро-ЭМГ-Микро» («Нейрософт», Россия) и исследование вегетативных функций на электрокардиографе «Поли-Спектр-8/EX» («Нейрософт», Россия). Изучали данные протокола тестирования EN-TreeM по силе, амплитуде, средней скорости, мощности при концентрических и эксцентрических сокращениях мышц.
Статистический анализ выполняли на персональном компьютере под управлением операционной системы MS Windows 7 (Microsoft) с использованием программы для работы с электронными таблицами MS Excel из пакета Office 365 (Microsoft). Для оценки статистической значимости различий между основной и контрольной группами до и после проведения медицинской реабилитации применяли непараметрический U-критерий Манна — Уитни для независимых переменных. Связи между показателями с учетом характера распределения изучали с помощью коэффициента ранговой корреляции Спирмена. Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
У пациентов с ТБСМ наблюдали поясничный уровень повреждения (100%; n = 48) с преимущественным поражением одной ноги (45,8%; n = 22) и преобладанием патологических симптомов в дистальных отделах нижних конечностей. У 37,5% больных (n = 18) имелись полные параличи, у 41,7% (n = 20) — атрофии мышц нижних конечностей.
Были диагностированы также сегментарные чувствительные нарушения асимметричного характера. У 12,5% пациентов (n = 6) наблюдали боли в области конечностей и позвоночника, 60,4% (n = 29) беспокоили нарушения функции тазовых органов. Отмечались следующие осложнения: рецидивирующие воспалительные поражения мочеполовой системы (14,6%; n = 7), пролежни (2,1%; n = 1), контрактуры суставов нижних конечностей (20,8%; n = 10).
По шкале ASIA преобладала группа C — 58,3% (n = 28) (табл. 1).
Таблица 1
Распределение участников исследования по степени тяжести поражения (n = 48)1
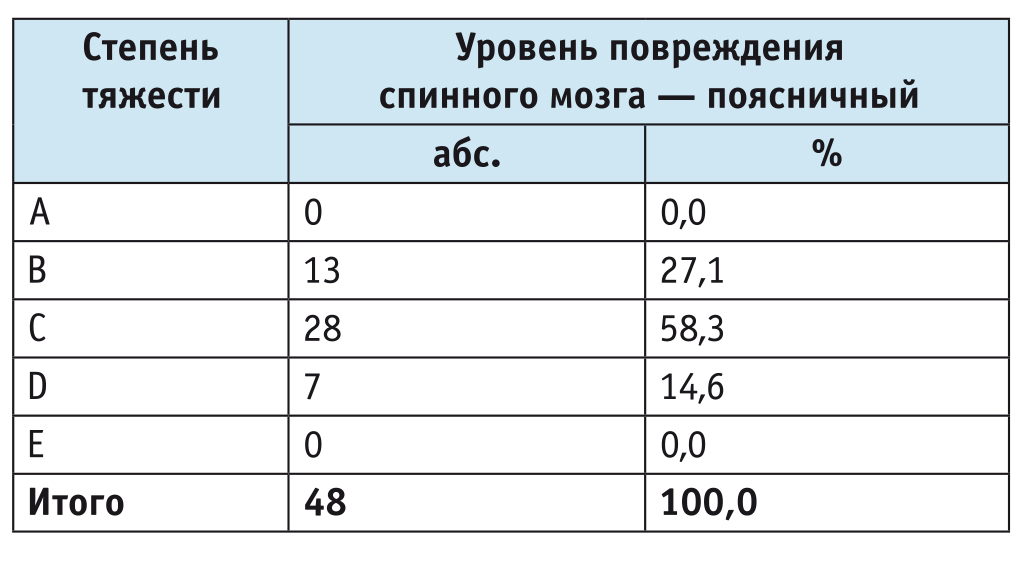
1 По классификации Американской ассоциации спинальной травмы (англ. American Spinal Injury Association).
Динамика клинико-электрофизиологических показателей в основной группе после курса реабилитации была положительной для поражений как сегментарного типа (СТ) (до реабилитации — 9,16 ± 0,17 ед., после — 10,33 ± 0,25 ед.; p < 0,01), так и проводникового типа (ПТ) (до реабилитации — 6,76 ± 0,11 ед., после — 7,88 ± 0,17 ед.; p < 0,01).
В контрольной группе в процессе реабилитации значения данных показателей статистически значимо не изменились: по поражениям СТ до реабилитации — 9,27 ± 0,21 ед., после — 9,55 ± 0,23 ед. (p > 0,05); по поражениям ПТ до реабилитации — 6,70 ± 0,12 ед., после — 6,88 ± 0,15 ед. (p > 0,05).
В основной группе статистически значимо уменьшилась полисимпатическая рефлекторная возбудимость (ПРВ) пациентов: длительность R2-компонента мигательного рефлекса до реабилитации — 37,9 ± 2,3 мс, после — 35,2 ± 2,1 мс (p < 0,01). В контрольной группе статистически значимые различия ПРВ до и после реабилитации выявлены не были: 37,8 ± 2,6 мс и 36,9 ± 2,7 мс соответственно (p > 0,05).
При оценке вариабельности ритма сердца, проведенной после поуровневой активной лечебной гимнастики, в положении лежа (фоновая запись) наблюдали статистически значимое повышение общей мощности спектра (до 3695 мс2), мощности спектра низких частот (до 846 мс2), очень низких частот (до 1354 мс2), высоких частот (до 824 мс2). Во всех случаях различия с контрольной группой статистически значимы (p < 0,001).
Ортостатическая проба после курса реабилитации в основной группе выявила улучшение вегетативной реактивности (коэффициент 30/15 равен 1,45; р < 0,001), что свидетельствовало о нормализации парасимпатической регуляции и сердечного ритма. Снижение соотношения частот низкого диапазона и частот высокого диапазона (до реабилитации — 3,4, после — 2,6; p < 0,001) при ортостатической пробе демонстрировало статистически значимое уменьшение церебральных эрготропных и гуморально-метаболических влияний по сравнению с контрольной группой (до реабилитации — 3,6, после — 3,7; p > 0,05).
После курса реабилитации у пациентов основной группы по шкале ASIA отмечали улучшение чувствительной функции на 12,1% (до реабилитации — 152,3 ± 10,2 балла, после — 170,7 ± 14,5 балла; p = 0,029), двигательной функции на 17,2% (до реабилитации — 68,2 ± 3,1 балла, после — 79,9 ± 4,4 балла; p = 0,032). В контрольной группе чувствительная функция улучшилась только на 2,5% (с 151,6 ± 12,8 до 155,4 ± 11,1 балла; p = 0,52) и двигательная функция — на 3,9% (с 69,4 ± 4,7 до 72,1 ± 5,6 балла; p = 0,18).
По шкале VFM в основной группе наблюдали увеличение суммарных баллов на 13,7% (до реабилитации — 227,4 ± 11,8 балла, после — 258,6 ± 12,1 балла; p < 0,001), по шкале FIM на 11,6% (до реабилитации — 105,1 ± 9,4 балла, после — 117,3 ± 8,9 балла; p < 0,001). В контрольной группе в процессе реабилитации значения этих показателей статистически значимо не изменились: по шкале VFM они увеличились на 3,7% (225,8 ± 10,3 и 234,2 ± 9,5 балла до и после реабилитации соответственно; p > 0,05), по шкале FIM на 4,2% (104,2 ± 6,1 и 108,6 ± 7,2 балла соответственно; p > 0,05).
В психоэмоциональной сфере, оцененной по шкале Спилбергера — Ханина, у пациентов основной группы выявлена положительная динамика: снижение уровня реактивной тревожности на 11,2% (с 32,1 ± 1,6 до 28,5 ± 1,2 балла; p < 0,001) и снижение уровня депрессии на 29,0% (с 10,7 ± 1,2 до 7,6 ± 1,1 балла; p < 0,001). В контрольной группе достигнутые результаты не имели статистической значимости: уровень тревоги снизился только на 3,1% (с 32,7 ± 1,3 до 31,7 ± 1,1 балла; p = 0,27), а депрессии — на 3,7% (с 10,8 ± 0,9 до 10,4 ± 1,2 балла; p = 0,09). При оценке данных тестирования по опроснику САН в основной группе отмечали увеличение показателей на 17,7% (до реабилитации — 44,6 ± 3,3 балла, после — 52,5 ± 3,4 балла; p = 0,007), тогда как в контрольной группе рост составил 4,5%, что не было статистически значимым результатом (до реабилитации — 44,2 ± 3,1 балла, после — 46,2 ± 2,4 балла; p = 0,08).
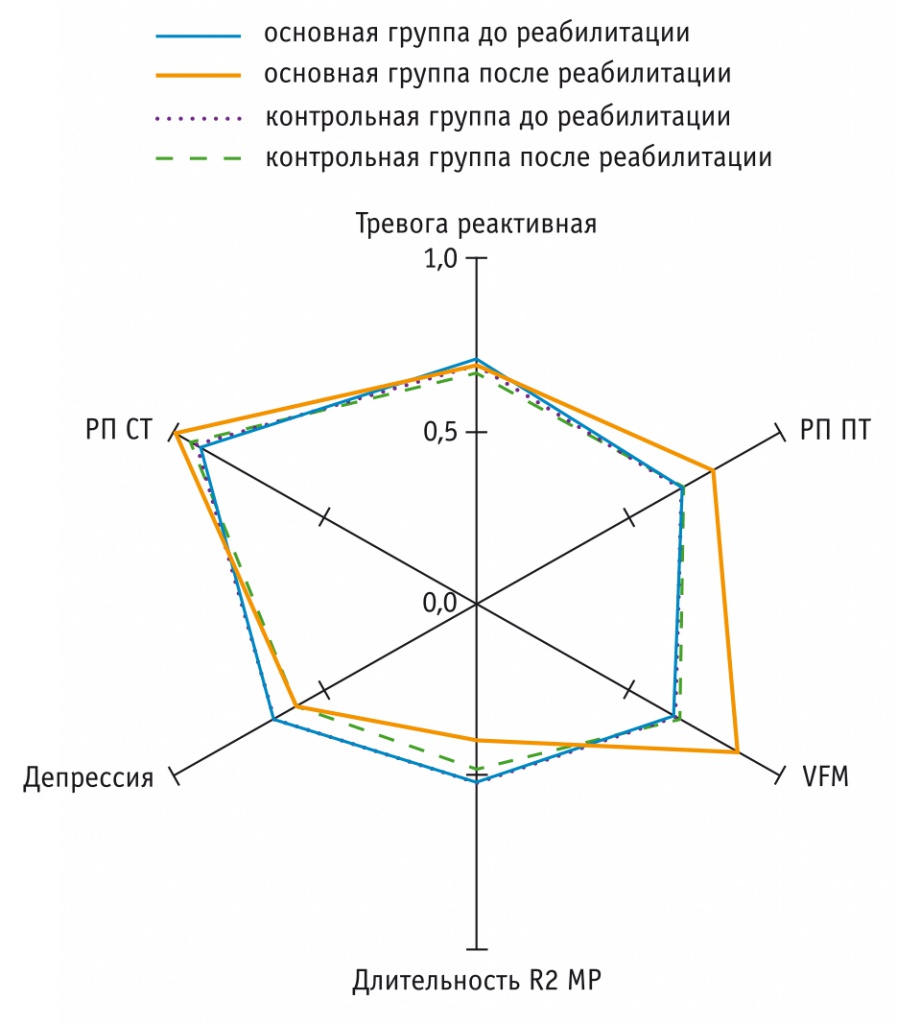
Динамика основных показателей клинико-электрофизиологического исследования в процессе реабилитации участников основной и контрольной групп представлена на рисунке.
Рис. Динамика нормализованных показателей клинико-электрофизиологического исследования.
Примечание. МР — мигательный рефлекс; РП ПТ и РП СТ — реабилитационный потенциал при поражениях проводникового и сегментарного типа соответственно; VFM — модифицированная Функциональная оценочная шкала активности и качества жизни (итал. Valutazione Funzionale Mielolesi)
В основной группе отмечали увеличение показателей силы на 18,2% (p < 0,001) при концентрических сокращениях мышц и на 15,5% (p < 0,001) при эксцентрических сокращениях. В контрольной группе их рост составил 2,3% (p = 0,39) и 1,4% (p = 0,09) соответственно (табл. 2).
Таблица 2
Динамика показателей свободного движения при концентрических и эксцентрических сокращениях мышц (M ± σ)1
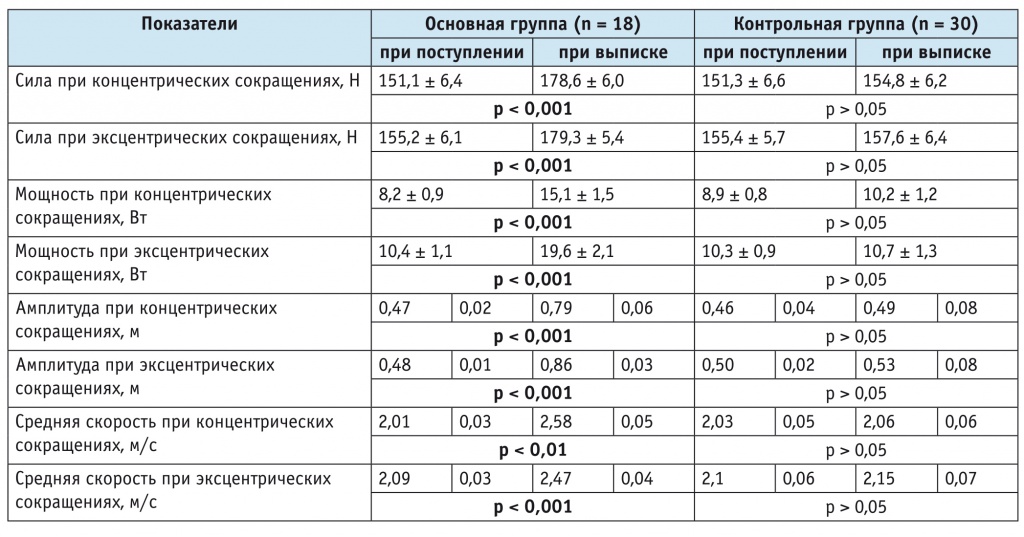
1 По результатам тестирования на аппаратно-программном комплексе EN-TreeM.
При анализе показателей мощности при концентрических и эксцентрических сокращениях мышц в основной группе выявили их повышение на 84,1% (p < 0,001) и 88,5% (p < 0,001), тогда как в контрольной группе — на 14,6% (p = 0,31) и 3,9% (p = 0,09) соответственно (см. табл. 2).
В основной группе наблюдали увеличение амплитуды на 68,1% (p < 0,001) при концентрических сокращениях мышц и на 79,2% (p < 0,001) при эксцентрических сокращениях; в контрольной группе амплитуда увеличилась на 6,5% (p = 0,11) и 6,0% (p = 0,82) соответственно (см. табл. 2).
Средняя скорость в основной группе повысилась на 28,3% (p = 0,002) при концентрических сокращениях мышц и на 18,2% (p < 0,001) при эксцентрических сокращениях; в контрольной группе повышение скорости составило 1,5% (p = 0,06) и 2,4% (p = 0,07) соответственно (см. табл. 2).
У пациентов с ТБСМ на поясничном уровне увеличение мощности, средней скорости и амплитуды при концентрических сокращениях мышц связано с повышением выносливости и эластичности мышц нижних конечностей, что обусловлено ежедневной многократной тренировкой мышц, которые участвуют в ходьбе.
Таким образом, в результате электрофизиологических исследований установлены патофизиологические особенности ТБСМ: неравномерность и асимметричность поражения сегментарного аппарата спинного мозга. При клиническом обследовании смешанный парез в руках или ногах может представляться более тяжелым, чем при электрофизиологическом обследовании: электрофизиологические тесты дают информацию о сохранности нейронных структур, тогда как у пациента может не быть активных движений в определенной мышечной группе. Следовательно, можно предположить эффективность направленного процесса активной реабилитации.
Назначение механотерапии и электростимуляции с БОС под контролем ЭМГ позволило пациентам принимать активное участие в реабилитации и проводить самоконтроль ее эффективности.
После курса реабилитации в основной группе отмечалось статистически значимое увеличение показателей по шкале ASIA (p < 0,05), шкалам VFM и FIM (в обоих случаях p < 0,001), а также была выявлена положительная динамика в психоэмоциональной сфере.
ЗАКЛЮЧЕНИЕ
При проведении медицинской реабилитации пациентов с травматической болезнью спинного мозга (ТБСМ) на поясничном уровне необходимо исследовать мигательный полисинаптический рефлекс для оценки уровня полисинаптической рефлекторной возбудимости с целью определения функционального состояния, степени нарушений супраспинальных систем.
Изменения вегетативного тонуса, реактивности и обеспечения деятельности у пациентов с ТБСМ следует определять методом оценки вариабельности ритма сердца на всех этапах реабилитации.
Частое выявление эмоционально-аффективных нарушений у пациентов с ТБСМ, занимающихся адаптивной физической культурой, требует назначения психологической медицинской реабилитации и рефлексотерапии.
Активная медицинская реабилитация пациентов с ТБСМ с поясничным уровнем повреждения должна включать применение электростимуляции с биологической обратной связью (БОС) под контролем электромиографии (ЭМГ), механотерапию с БОС под контролем ЭМГ и активно-пассивную ходьбу, так как эти методы статистически значимо повышают эффективность реабилитации и качество жизни у данного контингента больных.








