ВВЕДЕНИЕ
Нейровоспаление считается важным звеном патогенеза большого числа нозологических форм церебральной патологии. Интерес практикующих врачей к нейроиммунным взаимодействиям возрастает. Особое место в этой когорте занимает проблема аутоиммунной эпилепсии — группы эпилепсий, опосредованных всеми видами аутоиммунных реакций[1].
Цель обзора: анализ и систематизация результатов научных работ по проблеме диагностики аутоиммунной эпилепсии.
ОСНОВНАЯ ЧАСТЬ
Клинические фенотипы иммуноопосредованной эпилепсии определены в соответствии с различными типами антител[2]. В настоящее время выделяют энцефалитическую фазу заболевания, соответствующую аутоиммунному энцефалиту, например, с антителами к рецептору N-метил-D-аспартата (англ. N-methyl-D-aspartate receptor — NMDAR) или к богатому лейцином инактивируемому глиомой белку (англ. leucine-rich glioma-inactivated protein 1 — LGI1)[3–5]. Однако аутоиммунную этиологию выявляют и у пациентов, наблюдаемых по поводу хронической рефрактерной эпилепсии неизвестной причины[6–8], особенно при впервые развившемся эпилептическом статусе[9] и эпилепсии с поздним началом без структурных изменений по данным нейровизуализации[10, 11]. Антинейрональные антитела были зарегистрированы и у пациентов с мезиальной височной эпилепсией со склерозом гиппокампа[12].
C. Steriade и соавт. предложили новое определение аутоиммунной эпилепсии[13]. Они дифференцировали рекуррентные эпилептические приступы в случае острых симптоматических приступов, вторичных по отношению к аутоиммунному энцефалиту, от аутоиммунно-ассоциированной эпилепсии. В первом случае наблюдается обычная энцефалитическая фаза, и приступы обычно можно вылечить с помощью соответствующей иммунной терапии. Во втором случае эпилептические приступы связаны с патологическим процессом, вызванным аутоиммунной патологией без четко выраженной фазы энцефалита (например, энцефалит Расмуссена), и иммунно-таргетная терапия недостаточна для контроля над приступами. Однако в реальной клинической практике существуют трудности разграничения этих двух типов эпилептических расстройств: острые симптоматические приступы могут присутствовать в течение нескольких месяцев или лет от момента дебюта энцефалитической фазы[14, 15].
Аутоиммунная причина у пациентов с рецидивирующими эпилептическими приступами неизвестной этиологии с хроническими или острыми проявлениями должна быть исследована как можно раньше, чтобы оптимизировать иммунно-направленное лечение и улучшить контроль над приступами и функциональный результат[16, 17].
С другой стороны, сложности диагностики обусловлены неспецифическими изменениями по данным нейровизуализации. Рентгенологические признаки, которые могут свидетельствовать об аутоиммунном энцефалите, включают гиперинтенсивный сигнал в T2/FLAIR в медиобазальных отделах с одной или двух сторон или многоочаговые поражения головного мозга[17, 18] (рис. 1). Динамическое увеличение миндалины может быть ранним радиологическим биомаркером аутоиммунной эпилепсии[19].
Рис. 1. МРТ головного мозга пациентки Г., 20 лет с аутоиммунной эпилепсией. Гиперинтенсивный сигнал в Т2-изображении в обоих гиппокампах и миндалевидном теле справа, увеличение миндалевидного тела справа[17]
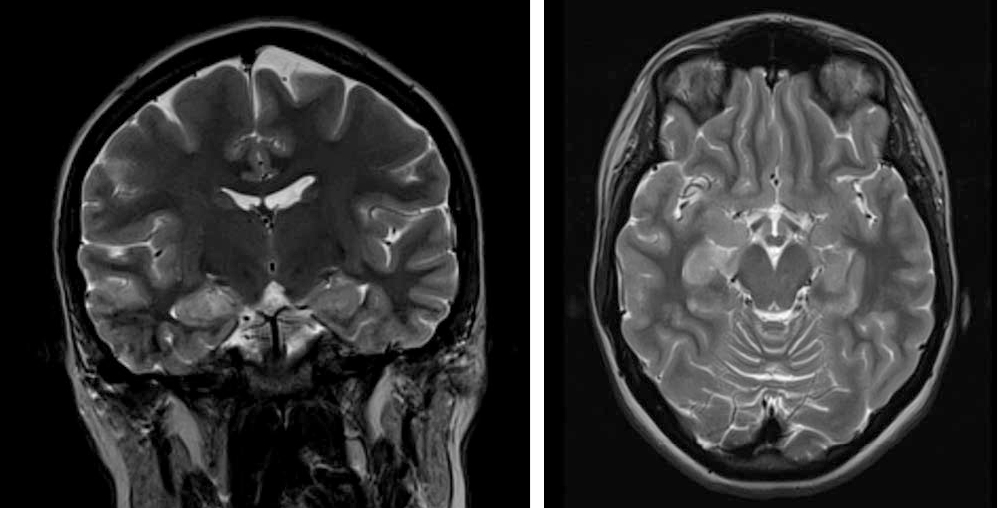
Изменения при нейровизуализации могут отсутствовать, особенно на ранних стадиях заболевания[20, 21], а атрофия гиппокампа формируется в отсутствие своевременной иммунологической терапии[22]. В нескольких исследованиях сообщалось о более высокой чувствительности позитронно-эмиссионной томографии с 18F-фтордезоксиглюкозой по сравнению с МРТ, особенно на ранних стадиях заболевания[23].
Еще одна трудность связана с определением аутоиммунного происхождения, которое предполагает обнаружение антител. Аутоантитела являются единственными специфическими аутоиммунными биомаркерами[2]. Диагностика затруднена, когда обнаружение антител остается отрицательным, несмотря на характерные клинические проявления, результаты МРТ или позитронно-эмиссионного сканирования. С другой стороны, согласно результатам исследований, наличие серонегативных антител не исключает возможности аутоиммунного заболевания[24, 25]. Надежное обнаружение аутоиммунных антител подразумевает анализ сыворотки крови и спинномозговой жидкости из-за риска ложноотрицательных или ложноположительных диагнозов при исследовании только сыворотки[26, 27].
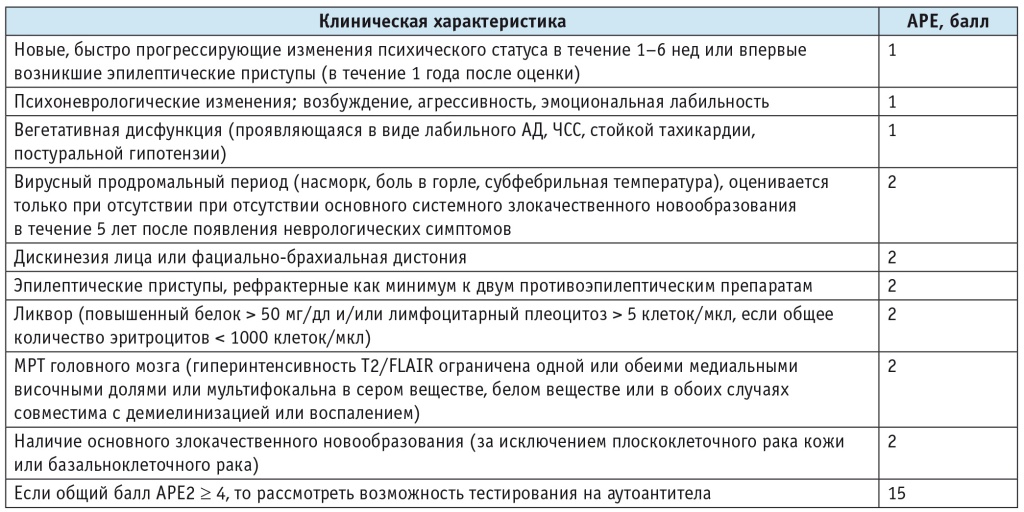
Предложен диагностический критерий аутоиммунной эпилепсии с использованием оценки риска выявления аутоантител (англ. Antibody Prevalence in Epilepsy and Encephalopathy, APE2), сывороточного статуса специфических антител и пробной иммунотерапии[28]. Заболевания классифицированы как «определенная аутоиммунная эпилепсия», «вероятная аутоиммунная эпилепсия» или «возможная аутоиммунная эпилепсия». Все пациенты с эпилепсией неизвестной этиологии и оценкой APE2 ≥ 4 должны пройти оценку аутоантител (таблица). При выявлении положительных аутоантител устанавливается диагноз «определенная аутоиммунная эпилепсия». Для пациентов с эпилепсией неизвестной этиологии, несмотря на тщательное обследование и отрицательную оценку аутоантител, которые имеют показатель APE2 ≥ 4, следует рассмотреть возможность диагностического пробного применения иммунотерапии. Положительный ответ на иммунотерапию (определяемый как снижение более чем вдвое частоты приступов после лечения) или оценка по шкале APE2 ≥ 7 независимо от ответа на иммунотерапию подтверждает диагноз «вероятная аутоиммунная эпилепсия».
Таблица
Оценка риска выявления аутоантител при эпилепсии и энцефалопатии
Зачастую диагностической дилеммой при аутоиммунных эпилепсиях является различие эпилептических приступов от поведенческих симптомов и изменения психики в связи с поражением лимбических структур мозга. Важную роль в обнаружении приступов и дифференциальной диагностике играет видеоэлектроэнцефалографический (ЭЭГ) мониторинг, который позволяет выявить истинное количество эпилептических приступов, межприступную эпилептиформную активность, изменения поведения, не связанные с пароксизмальной активностью корковых нейронов[29, 30].
До сих пор не выявлено специфических признаков на ЭЭГ для различных типов аутоиммунной эпилепсии. Тем не менее ЭЭГ может представлять паттерны, уникальные для определенных форм аутоиммунного энцефалита[31].
Анти-NMDAR-энцефалит
Наиболее часто в литературе описываются изменения ЭЭГ, выявляемые при анти-NMDAR-энцефалите, имеющем специфические признаки. Этот феномен определяется как «экстремальные δ-щетки» — ритмичная δ-активность (RDA) частотой 1–3 Гц с всплесками ритмической β-активности, наложенными на каждую δ-волну, напоминающую δ-щетки у недоношенных младенцев (рис. 2)[32, 33, 43].
Рис. 2. Паттерн ЭЭГ пациента с анти-NMDAR-лимбическим энцефалитом: высокоамплитудные δ-волны по лобно-височным отведениям обоих полушарий головного мозга с наложением высокочастотной активности[43]
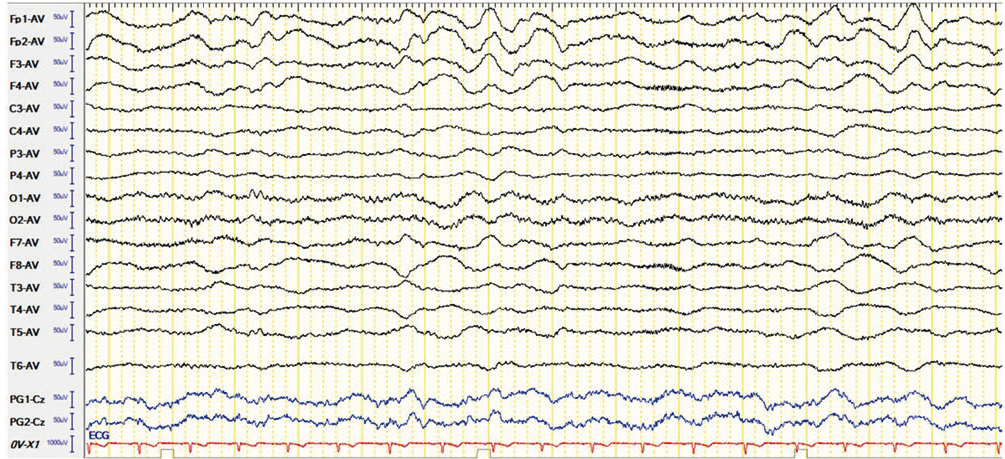
Данный феномен встречается почти в 30% случаев анти-NMDAR-энцефалита[32, 33]. В литературе имеются противоречивые данные о клинической значимости данного феномена. Некоторые исследования показывают наличие паттернов экстремальных δ-щеток у пациентов в коме, с более длительным или тяжелым течением заболевания, поэтому данный феномен может предвещать худший прогноз. Однако это требует более тщательного изучения[34].
По данным R. Wesselingh (2019), госпитализация в отделение интенсивной терапии у пациентов с аутоиммунным энцефалитом может быть ассоциирована с RDA, острыми волнами на ЭЭГ и аномальным базовым ритмом. Формирование фармакорезистентной эпилепсии ассоциировано с увеличением продолжительности регистрируемых на ЭЭГ изменений и острыми волнами[35].
Кроме того, δ-щетки обнаружены среди паттернов иктального начала на интракраниальной ЭЭГ у пациентов с фокальной кортикальной дисплазией и склерозом гиппокампа. Следовательно, δ-щетки не являются патогномоничными для анти-NMDAR-энцефалита, но выявление данного паттерна может определять раннее распознавание и своевременную иммунотерапию при анти-NMDAR-энцефалите, особенно у пациентов после исключения другой возможной этиологии[36].
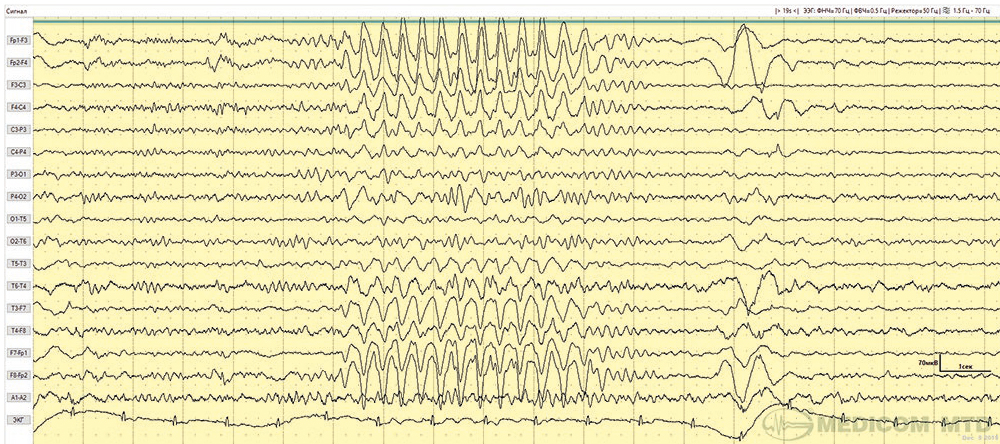
В ряде исследований описываются генерализованная[37–39], затылочная прерывистая[40] и фронтальная прерывистая RDA (FIRDA) (рис. 3)[41]. RDA преимущественно отмечается при тяжелом течении и у пациентов в коме[41, 42].
Рис. 3. Представлен паттерн ЭЭГ в биполярном продольном отведении пациентки с аутоиммунным лимбическим энцефалитом. FIRDA в состоянии пассивного бодрствования (наблюдение авторов)
Ряд исследователей сообщают об избыточной или диффузной β-активности, которая может регистрироваться в 25–50% случаев[31, 33, 40], и указывают, что это может быть обусловлено приемом седативных лекарственных средств.
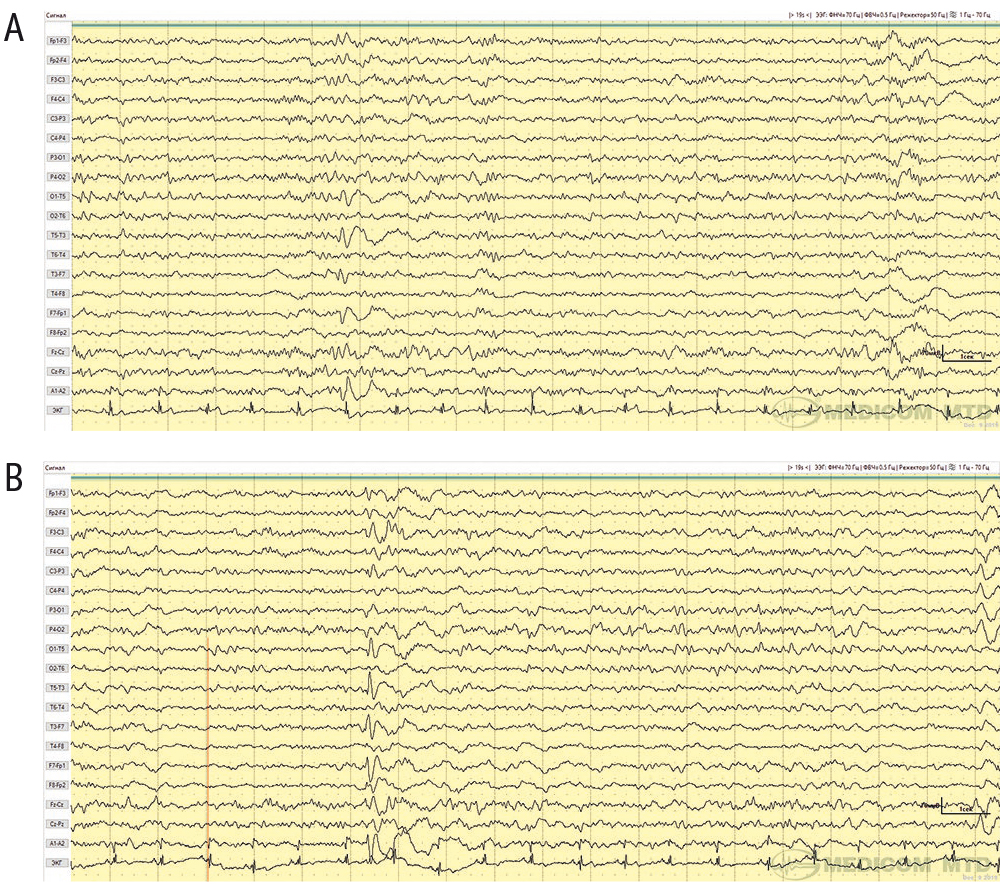
По данным С. Steriade и соавт. (2018), у 47% пациентов отсутствуют межприступные эпилептиформные разряды. При регистрации межприступная активность локализована по височным отведениям в 42% случаев (рис. 4)[32].
Рис. 4. Представлен паттерн ЭЭГ в биполярном продольном отведении пациентки с хроническим аутоиммунным анти-GAD-ассоциированным лимбическим энцефалитом. В состоянии расслабленного бодрствования (A) и фазе медленного сна (B) по височным отведениям левого полушария головного мозга регистрировались периодические высокоамплитудные δ-волны (наблюдение авторов)
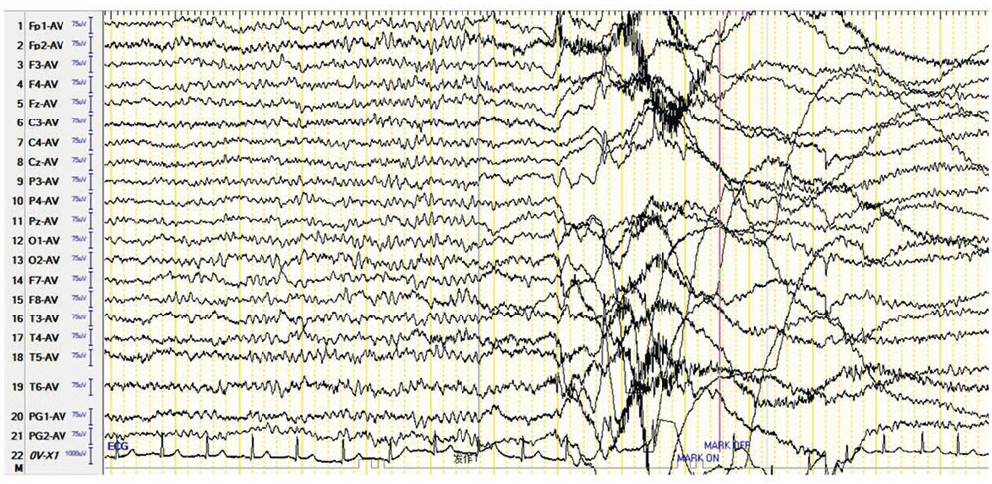
Анализ иктальной активности показывает, что эпилептические приступы при аутоиммунной эпилепсии часто возникают из височной области (63%) с вовлечением близлежащих регионов (височно-теменных и/или лобно-височных) (рис. 5)[32, 43].
Рис. 5. Представлен паттерн ЭЭГ пациентки с анти-LGI1-лимбическим энцефалитом с регистрацией иктальной ЭЭГ.
Приступу предшествовали электродекремент и появление регионального замедления по левым теменно-височным отведениям. Клинически регистрировался короткий фациобрахиальный дистонический приступ[43]
Наблюдалось нелокализуемое начало приступов (38%) и начало из двух независимых регионов или полушарий (44%)[32].
Симптоматика эпилептических приступов и ЭЭГ-картина могут изменяться со временем. Так, в 31% случаев выявлено изменение в распределении начала иктальной активности[32].
Другие неспецифические изменения ЭЭГ включают фокальное или генерализованное замедление, эпилептиформные разряды и периодические латерализованные эпилептиформные разряды[43, 44], FIRDA, периодические латерализованные и эпилептиформные разряды, генерализованную RDA, избыточную β-активность и трехфазные волны[34].
В исследовании A.R. Ruiz и соавт. наличие латерализованной и генерализованной RDA, генерализованной периодической эпилептиформной активности рассматривается как риск плохого исхода аутоиммунной эпилепсии[46]. Латерализованные периодические разряды не приводили к повышению риска неблагоприятного исхода, но повышали риск судорог. Таким образом, наличие генерализованной RDA может привести к повышенному риску плохого исхода, потому что отражает более тяжелую глобальную церебральную дисфункцию.
Y. Wang и соавт. сравнили клинические и ЭЭГ-особенности трех распространенных типов эпилептических приступов у пациентов с аутоиммунным энцефалитом[43]. У большинства пациентов наблюдались приступы, особенно часто при антителах к LGI1, NMDAR и рецептору гамма-аминомасляной кислоты (GABAR). Однако частота возникновения, тип приступа, результаты ЭЭГ, лечение и прогноз этих приступов, риск развития хронической эпилепсии различаются. Частота эпилептических приступов была выше при аутоиммунной эпилепсии с антителами к LGI1 и GABAR, чем к NMDA-рецепторам. Распространенными типами приступов при LGI1-аутоиммунной эпилепсии были фацио-брахиальные дистонические, медиальные височно-лобные и билатеральные тонико-клонические приступы с фокальным началом. Для энцефалита с анти-GABAR более характерны генерализованные тонико-клонические приступы и медиальные височно-лобные приступы, которые были первыми и основными симптомами и часто приводили к развитию эпилептического статуса. В то же время аутоиммунная эпилепсия с антителами к NMDAR имела различные типы приступов, чаще генерализованные, чем фокальные. Изменения ЭЭГ при трех типах аутоиммунной эпилепсии были неспецифическими, демонстрируя диффузные или фокальные медленные волны в фоновой активности, интериктальные эпилептические разряды в височной доле или других областях и иктальную эпилептиформную активность, обычно исходящую из медиальной височной области.
У пациентов с аутоиммунным энцефалитом высока частота субклинических приступов (58%)[32]: они обнаруживаются у пациентов при энцефалите, ассоциированном с LGI1-антителами, вовлекающем височную[47], лобно-височную или лобно-центральную области[48]. Следовательно, использование непрерывной ЭЭГ для выявления субклинических приступов у пациентов с аутоиммунной эпилепсией необходимо для точного выявления частоты эпилептических приступов, даже если клинические приступы очевидны. Актуальность влияния лечения субклинических эпилептических приступов на когнитивные исходы и дальнейшее течение эпилепсии требует проведения дополнительных исследований[32].
LGI1-ассоциированная эпилепсия
Для LGI1-аутоиммунной эпилепсии характерно развитие преимущественно фациобрахиальных дистонических, медиобазальных височных, фокальных или билатеральных тонико-клонических приступов[38–41]. Однако на сегодняшний день происхождение фациобрахиальных дистонических приступов остается спорным. Кортикальное, подкорковое и корково-подкорковое происхождение подтверждено различными исследованиями[49–53]. Обсуждалось происхождение фациобрахиальных дистонических приступов из подкорковых базальных ядер[54]. Основываясь на типе приступа в сочетании с визуализацией и ЭЭГ, можно сделать вывод о том, что поражение при антителах к LGI1 обычно затрагивает лимбическую систему (медиальная височная доля, гиппокамп и миндалевидное тело) и базальные ганглии с фациобрахиальными дистоническими приступами[43]. Эта версия отличается от предыдущих, которые показывали преимущественное вовлечение моторной коры и гиппокампа — основных целей при LGI1-аутоиммунной эпилепсии[53, 55, 56].
Фациобрахиальные дистонические приступы обычно легко идентифицировать и диагностировать[52, 53, 57]. C. Steriade и соавт. выявили, что этот тип приступов проявляется на иктальной ЭЭГ нелокализуемым началом с паттерном едва различимого и диффузного электродекремента. Различия в электроклинических характеристиках между группами LGI1-положительных и LGI1-отрицательных пациентов отсутствуют[32, 58]. Низкая частота иктальных изменений на ЭЭГ у пациентов с фациобрахиальными дистоническими приступами (13–40%) может быть обусловлена глубоко расположенной или узко локализованной эпилептогенной зоной[52, 53, 59].
В исследовании Y. Wang и соавт. (2020) у 100% пациентов с антителами к LGI1 наблюдались следующие изменения на ЭЭГ: у 11,1% — диффузные медленные волны, у 88,9% — фокальная эпилептиформная активность, у 66,7% — межприступные эпилептиформные разряды в височных или других областях головного мозга[43]. По данным других авторов, иктальная ЭЭГ не показала специфических изменений у пациентов с LGI1-аутоиммунной эпилепсией[43, 52, 59, 60].
NMDAR-ассоциированная эпилепсия
Эпилептические приступы — частое проявление энцефалита, вызываемого антителами к NMDAR. В исследовании A. Vogrig и соавт. у 71% пациентов с анти-NMDAR-энцефалитом регистрировали эпилептические приступы следующих типов: фокальные (17–74%), без нарушения сознания (55%), с нарушением сознания (20–42%) и генерализованными тонико-клоническими приступами (53–100%); у 35–40% пациентов развился эпилептический статус[55]. Симптоматика фокальных приступов различалась, указывая на различное происхождение, что согласуется с диффузным изменениями при появлении антител к NMDAR, поражающими обширные кортико-подкорковые области по сравнению с классическим лимбическим энцефалитом[43, 55, 61].
Эпилептические приступы развиваются преимущественно во второй (психотической и эпилептической) фазе анти-NMDAR-энцефалита[62]. Изменения на ЭЭГ регистрируются почти всегда (80–100%) и показывают замедление или исчезновение фоновой активности, фокальные или генерализованные медленные волны или межприступные эпилептические разряды[55, 61, 63–65].
S.E. Schmitt и соавт. сообщили, что у 30% взрослых пациентов с анти-NMDAR-энцефалитом на ранней стадии непрерывного мониторинга функции мозга развился паттерн «экстремальные δ-щетки»[33]. У этих пациентов регистрировали более длительное время госпитализации, более длительное время мониторинга КЭЭГ и более плохой прогноз. Это говорит о том, что паттерн экстремальных δ-щеток может быть более серьезным для прогноза. После активной иммунотерапии ЭЭГ постепенно улучшилась как минимум у 2 пациентов во время госпитализации. Кроме того, у обоих пациентов регресс экстремальных δ-щеток был связан с клиническим улучшением[33].
Обследование детей с анти-NMDAR-энцефалитом, проведенное J. Wang с соавт., показало, что появление β-щетки на пике и впадине δ-волн указывает на плохой клинический прогноз[58].
Патофизиологические механизмы появления паттерна экстремальных δ-щеток неизвестны и, как полагают, возникают в результате нарушения глутаматергической нейротрансмиссии, что приводит к деафферентации и замедлению таламокортикальных колебаний[61, 66]. C. Gitiaux и соавт.[57] и авторы других исследований[61, 63, 67] показали, что степень нарушений ЭЭГ коррелировала с клинической тяжестью анти-NMDAR-энцефалита, поскольку степень медленных волн на ЭЭГ была связана с размером пораженных областей коры.
Фокальные нарушения (замедление) на ЭЭГ были редкими (13–67%) и регистрировались в основном в височных или лобно-височных областях[61, 63, 67]. Хотя клинические приступы встречаются часто (65,9%), электрографические свидетельства эпилептической активности встречаются редко (15%), что потенциально отражает глубоко расположенную или сильно локализованную эпилептогенную зону[61]. С другой стороны, в исследовании Y. Zhang и соавт.[63] частота нарушений ЭЭГ составляла 100%, большинство из которых демонстрировали диффузные или фокальные медленные волны в фоновой активности, и только у 42,8% пациентов наблюдались межприступные эпилептические разряды, что согласуется с данными других работ[61, 63, 64, 67].
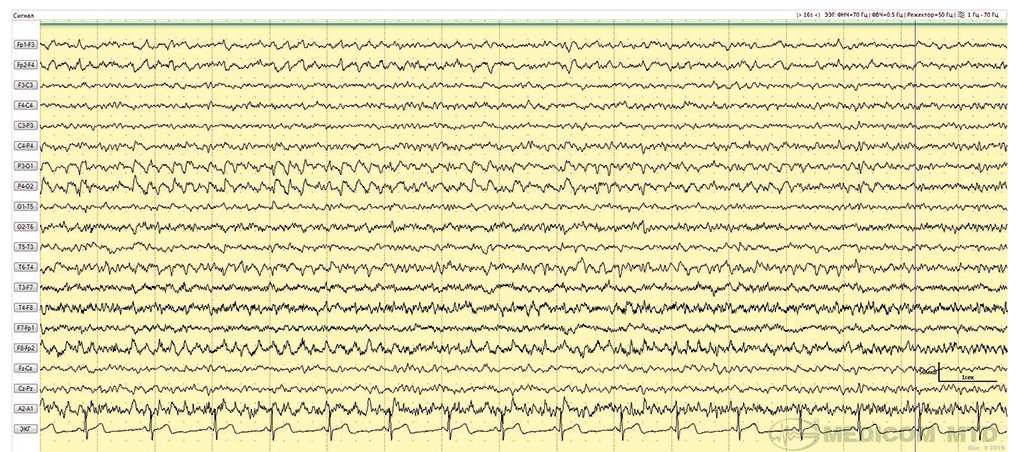
Достаточно частой находкой при анти-NMDAR-энцефалите является медленная активность[40, 68, 69]. Генерализованное замедление описывают 35–71% исследователей, и это связано с определенными стадиями заболевания, а именно с острым периодом[63] и психотической стадией во время неотложной госпитализации[70]. Региональное замедление наблюдалось относительно одинаково на начальных и поздних стадиях заболевания и выявлялось в 13–67% случаев (рис. 6)[70–73].
Рис. 6. Представлен паттерн ЭЭГ в биполярном продольном отведении пациентки с аутоиммунным NMDAR-лимбическим энцефалитом. В состоянии пассивного бодрствования регистрировалось периодическое δ-замедление по лобным отведениям правого полушария головного мозга с распространением на височные отделы и контралатерально (наблюдение авторов)
Определение клинического статуса и реакции на лечение может быть сложным у пациентов с анти-NMDAR-энцефалитом, получающих анестетики и барбитураты для лечения вегетативных нарушений, двигательных расстройств и бессудорожного эпилептического статуса[33, 40, 73].
C. Steriade и соавт. предложили использовать эволюцию электрографических паттернов у больных анти-NMDAR-энцефалитом с постепенным сокращением периодов экстремальных δ-щеток после иммунотерапии. Таким образом, возможно рассмотрение потенциально независимой роли ЭЭГ в качестве биомаркера активности заболевания. Синхронные δ-вспышки большой амплитуды с или без наложения β-волн специфичны для тяжелого течения анти-NMDAR-энцефалита у пациентов, невосприимчивых к иммунотерапии первой линии. Частота этого паттерна коррелирует с тяжестью заболевания и может служить потенциальным биомаркером. В клиническом аспекте наличие экстремальных δ-вспышек может потребовать раннего рассмотрения вопроса об иммунотерапии второй линии[74].
По данным литературы, до 7–14% пациентов с анти-NMDAR-энцефалитом имеют нормальные паттерны ЭЭГ. В то же время исследователи отмечают, что большая часть неизмененной ЭЭГ-картины наблюдалась либо у пациентов на ранней стадии заболевания или позже в процессе выздоровления, либо у пациентов, стадию заболевания у которых невозможно было четко идентифицировать[40, 63, 71].
При подозрении на аутоиммунную эпилепсию также необходима тщательная оценка заднего доминантного ритма. Слабо устойчивый задний доминантный ритм был значимо связан с аутоиммунной эпилепсией и более характерен для анти-NMDAR-энцефалита[75]. При аутоиммунной эпилепсии могут появляться прерывистые медленные волны, постоянная RDA, чрезмерная β-активность[33], диффузное замедление[63] и отсутствовать паттерны сна. Непрерывное θ/δ-замедление и FIRDA чаще встречаются у серопозитивных пациентов[76].
В исследованиях показано, что таламус и теменно-затылочная кора были вовлечены в формирование заднего α-ритма[77]. Таламокортикальная аритмия как результат блокирования NMDAR, особенно в таламусе, может нарушить нормальные функции таламуса и вызвать низкочастотные δ-колебания[63]. Это может объяснить плохую устойчивость заднего доминантного ритма.
Энцефалит, связанный с антителами к мембранным антигенам, также свидетельствует о поражении промежуточного мозга[78] и может привести к плохой устойчивости заднего доминантного ритма.
ЗАКЛЮЧЕНИЕ
Аутоиммунную причину необходимо исключать у пациентов с повторными эпилептическими приступами неизвестной этиологии. Аутоиммунный энцефалит является основным фенотипом аутоиммунных приступов. Аутоиммунная этиология определена более чем у трети пациентов с хронической эпилепсией неизвестной этиологии. Видео-ЭЭГ-мониторинг вносит весомый вклад в диагностику аутоиммунной эпилепсии, а некоторые изменения могут рассматриваться как биомаркер тяжести заболевания. Это имеет важное значение, особенно у пациентов с нарушением сознания, для которых является сложным определение клинического статуса и ответа на проводимую терапию.
Поступила: 14.07.2022
Принята к публикации: 21.09.2022








