ВВЕДЕНИЕ
Валидация и разработка чувствительных биомаркеров социально значимых заболеваний нервной системы, в частности височной эпилепсии (ВЭ), для объективизации характера патологического процесса на различных его стадиях, прогноза течения болезни являются актуальными задачами современной неврологии [1, 2]. Исследования новых биомаркеров становятся еще более необходимыми из-за относительно невысокой специфичности рутинной ЭЭГ в определении прогноза заболевания, а она остается основным диагностическим инструментом при ВЭ в условиях повседневной клинической практики [2, 3]. Поскольку возможны МР-негативные случаи ВЭ, диагноз может быть установлен только клинически при динамическом наблюдении с учетом результатов всех инструментальных и лабораторных исследований.
Генетические маркеры в настоящее время рассматриваются как потенциальные биомаркеры определения тяжести течения ВЭ [4]. Помимо патофизиологических механизмов развития заболевания, важными проблемами остаются диагностика ВЭ на ранней стадии и выявление маркеров прогноза течения заболевания, в том числе с учетом индивидуальных генетических особенностей каждого пациента.
Анализ литературы показал, что в настоящее время изучение процессов нейровоспаления и нейродегенерации при ВЭ важно как с физиологической точки зрения, так и с точки зрения поиска малоинвазивных биомаркеров, способных предсказать и оценить темп прогрессирования болезни, помочь в определении тактики лечения [3, 5].
Отсутствие четких положительных генетических ассоциаций с ВЭ, подтвержденных несколькими независимыми исследовательскими группами, может быть обусловлено небольшим размером и/или клинической неоднородностью выборки пациентов с мезиальной ВЭ в большинстве исследований [4]. На основании литературных данных можно сделать вывод, что в настоящее время недостаточно сведений о вкладе носительства однонуклеотидных вариантов генов предрасположенности, обладающих высокой чувствительностью, специфичностью и прогностическим значением, рассчитанных с целью прогноза течения ВЭ.
Однако выявление таких потенциальных биомаркеров остается крайне актуальной задачей [2, 6]. Для объективизации прогноза течения заболевания необходимо улучшение клинико-диагностических маркеров с использованием научно обоснованных статистических моделей [7].
Цель исследования: изучить возможность прогнозирования течения мезиальной ВЭ с использованием методов логистической регрессии и деревьев классификации.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены 166 пациентов с мезиальной ВЭ, мужчин было 69 (42%), женщин — 97 (58%). Медиана возраста составила 35 [29; 46] лет. Полная клинико-анамнестическая характеристика пациентов приведена в таблице 1. Статистически значимой разницы между мужчинами и женщинами не было.
Таблица 1
Клиническая характеристика пациентов с мезиальной височной эпилепсией (ВЭ)
Критериями включения в исследование стали наличие мезиальной ВЭ, возраст от 16 до 80 лет, проживание в Сибирском федеральном округе, добровольно подписаное информированное согласие. Критериями исключения служили фокальная генетическая и другие формы эпилепсии, отсутствие добровольно подписанного информированного согласия. Исследование одобрено на заседании локального этического комитета ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России (выписка из протокола № 85/2018 от 27 сентября 2018 года).
Клинико-диагностические обследования проведены за период с 2018 по 2021 г. на базе Неврологического центра Университетской клиники ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России, на кафедре медицинской генетики и клинической нейрофизиологии ИПО ФГБОУ ВО КрасГМУ им. проф. В Ф. Войно-Ясенецкого Минздрава России (ректор — д. м. н., доцент А.В. Протопопов). Молекулярно-генетические, биохимические исследования произведены в лаборатории медицинской генетики с использованием приборной базы Центра коллективного пользования ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России.
У всех пациентов с ВЭ детально изучена клиническая картина заболевания: анамнестические данные (наследственная отягощенность, возраст дебюта, этиология, особенности терапии, возраст ремиссии заболевания, наличие коморбидной патологии); результаты клинико-неврологического обследования. Тип эпилептических приступов и диагноз ВЭ устанавливали в соответствии с обновленной Международной классификацией эпилепсии (Международная противоэпилептическая лига, 2017) с учетом клинической картины, данных ЭЭГ и МРТ. Для оценки тяжести эпилептических приступов применялась Национальная госпитальная шкала тяжести эпилептических приступов (National Hospital Seizure Severity Scale, NHS-3).
Молекулярно-генетические исследования осуществляли с помощью ПЦР в режиме реального времени на аппарате Rotor-Gene 6000 (Corbett Life Science, Австралия) с использованием технологии аллельной дискриминации TaqMan и флуоресцентных зондов. Биохимические исследования с определением концентраций BDNF, NTRK-2, ИЛ-1β, ФНО-α в плазме крови производили методом ИФА с помощью наборов ELISA Kit (SEA011Hu, SEA133Hu, SEC183Hu, SEA563Hu Сloud-Clone Corp., США) в двукратном повторении в соответствии с рекомендациями для наборов и биохимического анализатора Stat Fax модели 3300. Далее проводили стандартную кривую для определения связи между оптической плотностью и концентрациями исследуемых биомаркеров с последующим анализом коэффициента вариации и аналитической чувствительности ELISA.
По результатам исследования с помощью пакета прикладных программ SPSS Statistics (версия 19.0) осуществлялся статистический анализ. Нормальность распределения количественных признаков проверялась с помощью критериев Шапиро — Уилка и Колмогорова — Смирнова. В связи с тем, что все количественные данные не подчинялись закону нормального распределения, для их описания использовались медиана и 1–3-й квартили (Me [Q1; Q3]). Качественные данные описывали как абсолютные значения и проценты (n, %).
Построение логистической регрессионной модели осуществлялось методом пошагового включения прогностических факторов с определением минимального набора предикторов по оценке квадрата Нейджелкерка. Соответствие модели использованным данным характеризовали с помощью критерия согласия Хосмера — Лемешева (согласованной считалась модель при р > 0,05). Для прогнозирования и классификации данных использовался метод деревьев классификации с применением алгоритма CHAID. Значимость моделей проверяли при помощи таблиц классификации с расчетом показателей точности, чувствительности и специфичности. К показателям чувствительности и специфичности дополнительно рассчитывался 95% ДИ.
РЕЗУЛЬТАТЫ
Для определения независимой роли ОНВ генов IL-1β, TNF, BDNF, NTRK-2, а также клинических, биохимических биомаркеров в прогнозировании течения ВЭ нами использован метод множественного логистического регрессионного анализа. Тип течения ВЭ представлен в виде бинарной переменной, где 0 — компенсированное течение, 1 — некомпенсированное течение. В качестве возможных условий для прогнозирования течения ВЭ оценивались следующие факторы: пол, тяжесть приступов в баллах по шкале NHS-3, наличие склероза гиппокампа, длительность заболевания, концентрации ИЛ-1β (пг/мл), BDNF (нг/мл), ФНО-α (пг/мл), NTRK-2 (пг/мл), носительство аллели С rs16944 гена IL-1β, аллели Т rs16944 гена IL-1В, генотипа ТТ rs16944 гена IL-1β, аллели С rs1143634 гена IL-1β, аллели Т rs1143634 гена IL-1β, генотипа ТТ rs1143634 гена IL-1β, аллели G rs6265 гена BDNF, аллели A rs6265 гена BDNF, генотипа АА rs6265 гена BDNF, аллели С rs2289656 гена NTRK2, аллели Т rs2289656 гена NTRK2, генотипа СТ rs2289656 гена NTRK2, аллели С rs3780645 гена NTRK2, аллели Т rs3780645 гена NTRK2, генотипа СТ rs3780645 гена NTRK2, аллели А rs1143627 гена IL-1β, аллели G rs1143627 гена IL-1β, генотипа GG rs1143627 гена IL-1β, аллели G rs1800629 гена TNFA, аллели A rs1800629 гена TNFA, генотипа GA rs1800629 гена TNFA.
Математически модель логистической регрессии выражает зависимость логарифма шанса от линейной комбинации факторных переменных:
где р — вероятность прогнозируемого события; е — математическая константа 2,72; b0 — константа модели; b1 — коэффициент при предикторной переменной х1, показывающий изменение логарифмических шансов, вызванное единичным изменением независимых переменных.
Полученная модель являлась статистически значимой. Проверка согласия Хосмера — Лемешева пройдена, р > 0,05. Построение логистической регрессионной модели осуществлялось методом пошагового включения прогностических факторов с определением минимального набора предикторов.
В ходе анализа выявлено статистически значимое влияние носительства аллели A rs6265 гена BDNF и склероза гиппокампа. Соответственно, найдены факторы, от которых зависит тип течения ВЭ, в отличие от остальных, использовавшихся для прогнозирования (табл. 2). Точность составила 80,3%, чувствительность — 66,7% (95% ДИ: 46,0%; 83,5%), специфичность — 91,4% (95% ДИ: 76,9%; 98,2%).
Таблица 2
Характеристика точности модели определения типа течения височной эпилепсии (ВЭ)
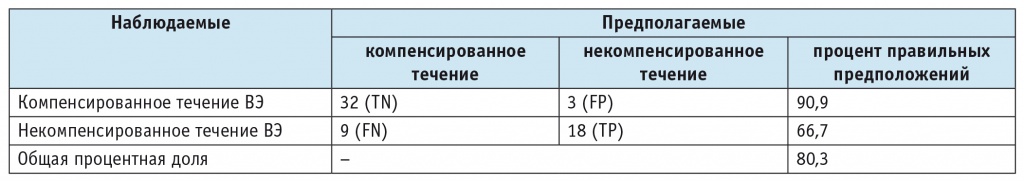
Была получена рабочая модель при выборе зависимой переменной (0 — компенсированное, 1 — некомпенсированное течение ВЭ) (табл. 3), выраженная следующим уравнением:
где р — вероятность типа течения ВЭ, х1 — носительство аллели А rs6265 G/A гена BDNF (b1 = 1,56), х2 — наличие склероза гиппокампа (b2 = 1,56), константа b0 = –0,936.
Таблица 3
Логистическая регрессионная модель с пошаговым включением предикторов для определения типа течения височной эпилепсии
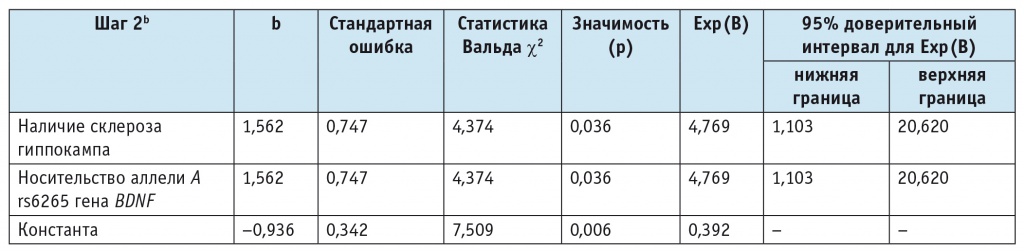
В результате вероятность типа течения ВЭ оценивается от 0 до 1. При значениях от 0 до 0,50 прогнозируется 0 класс (компенсированное течение ВЭ), при значениях от 0,51 до 1 — 1 класс (некомпенсированное течение ВЭ).
С учетом практической направленности результатов данного этапа исследования нами была заранее рассчитана вероятность течения ВЭ с включением всех возможных вариантов сочетания предикторых переменных, данные представлены в таблице 4.
Таблица 4
Вероятность типа течения височной эпилепсии (ВЭ) в зависимости от наличия склероза гиппокампа и носительства аллели A гена BDNF

Исходя из расчетов вероятности течения, можно сделать вывод, что совместное влияние склероза гиппокампа и носительства аллели А rs6265 гена BDNF приводит к некомпенсированному течению ВЭ.
Следовательно, результатом данного этапа исследования является доказанное предикторное значение носительства аллели А rs6265 гена BDNF для развития некомпенсированного течения ВЭ наряду с общепринятым фактором риска — склерозом гиппокампа. Следует отметить, что бинарная логистическая регрессия отражает мультифакторность возникновения вариантов течения ВЭ, при этом не исключая изолированного влияния генетических факторов.
Кроме того, для определения роли изучаемых факторов в прогнозировании течения ВЭ использовался метод деревьев классификации, позволяющий прогнозировать принадлежность объектов к определенному классу в зависимости от значения признаков, характеризующих объект. Так, с использованием алгоритма CHAID сгенерировано дерево классификации, позволяющее отнести пациентов с ВЭ к группе компенсированного или некомпенсированного течения заболевания. При этом точность модели составила 80,3%, чувствительность — 75,0% (95% ДИ: 66,9%; 82,0%), специфичность — 87,8% (95% ДИ: 79,6%; 93,5%) (табл. 5).
Таблица 5
Характеристика точности модели определения типа течения височной эпилепсии (ВЭ) по методу деревьев классификации
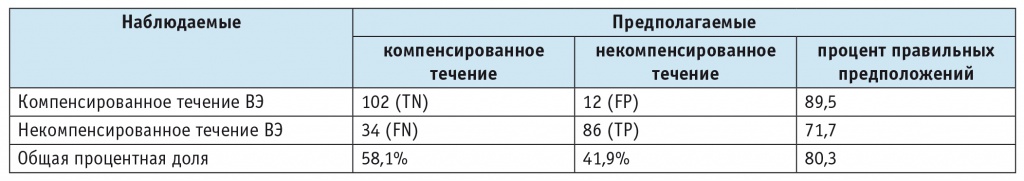
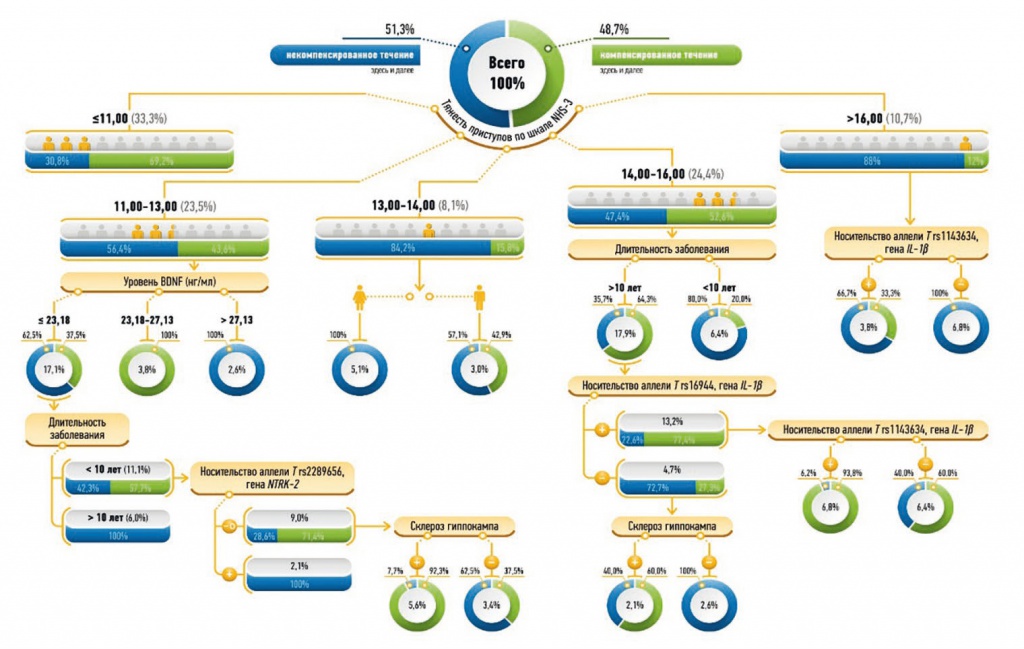
Таким образом, выявлены значимые факторы, от которых зависит тип течения ВЭ: тяжесть эпилептических приступов по шкале NHS-3, концентрация BDNF (нг/мл), длительность заболевания (0 — меньше или равно 10 лет, 1 — больше 10 лет), носительство аллели Т rs2289656 гена NTRK-2, склероз гиппокампа (0 — нет, 1 — есть), пол (0 — мужской, 1 — женский), носительство аллели Т rs16944 гена IL-1β, аллели Т rs1143634 гена IL-1β (рис.).
Рис. Дерево классификации прогноза течения височной эпилепсии
ОБСУЖДЕНИЕ
В настоящем исследовании использован метод бинарной логистической регрессии с целью определения прогноза течения ВЭ. Полученные результаты свидетельствуют о том, что склероз гиппокампа является фактором риска некомпенсированного течения заболевания, что совпадает с данными других исследований [8, 9]. Нами получены сведения о предикторной роли аллели А однонуклеотидного варианта гена BDNF в развитии некомпенсированного течения ВЭ благодаря применению метода логистической регрессии, а также выявлены значимые факторы, влияющие на тип течения и достижение ремиссии ВЭ, с помощью метода деревьев классификации, что ранее не было отражено в других исследованиях [10].
ЗАКЛЮЧЕНИЕ
Определение доказанной роли носительства однонуклеотидных вариантов rs16944, rs1143634 гена IL-1β, rs2289656 гена NTRK-2, клинико-анамнестических показателей (тяжести эпилептических приступов по шкале National Hospital Seizure Severity Scale 3, длительности височной эпилепсии (ВЭ), склероза гиппокампа, пола), биохимических показателей (концентрации BDNF в плазме крови) в прогнозировании течения ВЭ с помощью метода деревьев классификации, а также совместного носительства аллели А rs6265 гена BDNF и склероза гиппокампа для прогноза некомпенсированного течения ВЭ определяет полное понимание многофакторности при прогнозировании течения ВЭ.
Нами выявлены прогностически значимые клинические характеристики пациентов с ВЭ, особенности изменения концентраций циркулирующих провоспалительных и нейротрофических факторов, носительства однонуклеотидных вариантов кодирующих их генов для прогнозирования характера течения ВЭ, что позволяет на практике применять персонализированный подход к пациенту, особенно востребованный в случае хронического заболевания.
Поступила: 13.01.2022
Принята к публикации: 22.02.2022








