ВВЕДЕНИЕ
Височная эпилепсия (ВЭ) является самой распространенной формой фокальной эпилепсии у взрослых, причем, по данным В.А. Карлова (2019), в клинической практике наиболее часто встречаются пациенты с ВЭ с неуточненным этиологическим фактором, дебютировавшей в 61,7% случаев в возрасте до 16 лет [1, 2]. По мере совершенствования методик нейровизуализации все большее число случаев ВЭ относят к разряду структурных, однако для суждения об эпилептогенности обнаруженных изменений необходимо получение новых данных о патогенезе структурной фокальной эпилепсии. А.С. Котов и соавт. (2010) резюмируют, что в условиях рутинной клинической практики у пациентов с резистентной фокальной эпилепсией в значительном числе случаев нейровизуализация не обнаруживает имеющиеся эпилептогенные повреждения [3]. На это указывают, в частности, J. Von Oertzen и соавт. (2002), по данным которых около 60% больных резистентной фокальной эпилепсией получают ложноотрицательные заключения [4].
Согласно рекомендациям Международной и Российской противоэпилептической лиги, пациенту с подозрением на ВЭ требуется проведение МРТ головного мозга с использованием томографа с напряженностью магнитного поля 1,5–3,0 Тесла и выше, оснащенного дополнительным нейрорадиологическим пакетом программного обеспечения [5]. Однако сохраняется высокая распространенность МР-негативных случаев [1, 2, 4].
M.J. Koepp и соавт. (2017) показали, что, у 1/2–1/3 пациентов с ВЭ с неуточненным этиологическим фактором обнаруживаются изменения в области полюса височной доли, в частности повышение сигнала на Т2-взвешенных изображениях. Магнитно-резонансная волюметрия — методика точной оценки объема различных анатомических структур головного мозга — зачастую выявляет билатеральные изменения мезиальных височных структур у пациентов с односторонним склерозом гиппокампа, а также в экстрагиппокампальном регионе (ядрах и белом веществе) [6, 7].
В настоящее время особое значение придается дополнительному использованию магнитно-резонансной спектроскопии, позволяющей оценить функциональное состояние тканей головного мозга. Это важно для пациентов с МР-негативной ВЭ [8]. Считается, что типичные изменения на МР-спектроскопии при склерозе гиппокампа, отражающие потерю нейронов и глиоз, — это снижение пика N-ацетиласпартата и повышение пиков креатина и холина. В контрлатеральном гиппокампе могут выявляться нормальные или измененные в меньшей степени уровни метаболитов [8]. Односторонние изменения содержания основных метаболитов свидетельствуют о хорошем прогнозе при оперативном лечении, в 82% случаев в послеоперационном периоде удается достичь исчезновения или значительного сокращения частоты эпилептических приступов.
У пациентов с ВЭ с односторонними аномальными значениями метаболитов шанс достичь ремиссии значительно выше, чем у больных с двусторонними изменениями. С другой стороны, двусторонние преходящие изменения спектра наблюдались в исследованиях у 70% пациентов с ВЭ. Кроме того, зафиксирована послеоперационная метаболическая нормализация на неоперированной стороне [9].
Таким образом, изменение уровня N-ацетиласпартата может быть обратимым и, вероятно, являет функциональным маркером поражения контрлатерального гиппокампа [10]. По данным ряда исследователей, дополнительный критерий — отношение уровня N-ацетиласпартата к суммарному содержанию креатина и холина — NAA/(Cr + Cho) — в той области головного мозга, где произошли гибель или повреждение нейронов и изменение уровня миоинозитола, повышение которого свидетельствует о наличии эпилептогенного очага, а понижение — о распространении патологической активности на соседние ткани [11, 12].
В доклинических моделях и отдельных клинических исследованиях, по данным МР-спектроскопии, выявлены также изменения концентраций метаболитов, характерные для нейровоспаления и нейродегенерации (астроцитарной активации) [11, 12].
Однако индивидуальные и физиологические различия уровней метаболитов, обратимость их изменений недостаточно изучены в настоящее время. Другие методы нейровизуализации, такие как позитронно-эмиссионная томография [13], однофотонная эмиссионная КТ, трактография, не применяются в рутинной клинической практике для диагностики ВЭ, а используются только при предоперационном обследовании пациентов.
Цель исследования: изучение особенностей показателей нейровизуализации (МРТ головного мозга и МР-спектроскопии медиобазальных отделов височных долей) у пациентов с мезиальной ВЭ.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены 166 пациентов с мезиальной ВЭ. Их возраст на момент исследования варьировал от 16 до 76 лет. Медиана возраста составила 35 [29; 46] лет, мужчин было 69 (42%), женщин — 97 (58%). Возраст дебюта ВЭ — 19 [13; 30,5] лет. Длительность заболевания у пациентов с ВЭ в 89 (53,6%) случаях превышала 10 лет, медиана — 11 [9; 20] лет.
Критериями включения в исследование стали диагноз мезиальной ВЭ, возраст от 16 до 80 лет, проживание в Сибирском федеральном округе, добровольно подписанное информированное согласие на участие. Критериями исключения служили фокальная генетическая и другие формы эпилепсии, отсутствие добровольно подписанного информированного согласия. Исследование одобрено на заседании локального этического комитета ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России (выписка из протокола № 85/2018 от 27 сентября 2018 года).
Клинико-диагностические обследования проведены с 2018 по 2021 г. на базе Неврологического центра Университетской клиники ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России, на кафедре медицинской генетики и клинической нейрофизиологии ИПО ФГБОУ ВО КрасГМУ им. проф. В Ф. Войно-Ясенецкого Минздрава России (ректор — д. м. н., доцент А.В. Протопопов). Для определения объема исследования предварительно был проведен ретроспективный анализ историй болезни пациентов, состоящих на диспансерном учете в Неврологическом центре Университетской клиники с установленным диагнозом мезиальной ВЭ. Отбор пациентов в настоящее клиническое исследование осуществлялся методом выборки из базы данных за период 2011–2021 гг.
У всех больных ВЭ детально изучена клиническая картина заболевания: анамнестические данные (наследственная отягощенность, возраст дебюта, этиология, особенности терапии, возраст ремиссии заболевания, наличие коморбидной патологии), результаты клинико-неврологического обследования. Оценку когнитивных нарушений проводили с помощью Mонреальской шкалы когнитивной оценки.
Тип эпилептических приступов и диагноз ВЭ устанавливали в соответствии с обновленной Международной классификацией эпилепсии (Международная противоэпилептическая лига, 2017) с учетом клинической картины, данных ЭЭГ и МРТ. Для оценки тяжести эпилептических приступов использовалась Национальная госпитальная шкала тяжести эпилептических приступов (National Hospital Seizure Severity Scale, NHS-3).
МРТ головного мозга анализировали по протоколу, рекомендованному Российской противоэпилептической лигой, при мощности магнитного поля 1,5 Тесла и шаге сканирования 1,0–1,5 мм, в Т1, Т2-, FLAIR-, DWI- и SWI-режимах. Проведен анализ содержания основных метаболитов, превышающих определенный минимальный уровень (≥ 0,5 ммоль/л), по данным МР-спектроскопии медиобазальных отделов височных долей: N-ацетиласпартата (нейронального маркера), лактата (индикатора анаэробного гликолиза), глутаматноглутаминового комплекса (маркера астроцитов и нейротоксина, возбуждающего нейромедиатора), мионозитола (продукта деградации миелина), отношений уровня N-ацетиласпартата к концентрациям холина (маркера целостности клеточных мембран) и креатина (маркера энергетического обмена).
На этапе проведения МР-спектроскопии фиксировались графические изображения спектров в каждом вокселе установленной рамки и карты распределения метаболитов, а также карты соотношений метаболитов. После построения карт и наложения их на анатомические структуры оценивали показатели соотношений основных метаболитов.
При проведении нативного анализа полученных спектров нейрорадиологом рассматривались интегральные значения и соотношения пиков метаболитов (лактат резонирует на 1,3 ppm (parts per million — частей на миллион), N-ацетиласпартат — 2,0 ppm, глутамин/глутамат — 2,2–2,4 ppm, креатин — 3,0 ppm, холин — 3,2 ppm, миоинозитол — 3,5 ppm). В постобработке при анализе заключений МР-спектроскопии медиобазальных отделов височных долей нами оценивались только качественные показатели, характеризующие снижение или повышение уровня метаболита, а также сторону поражения.
По результатам исследования с помощью пакета прикладных программ SPSS Statistics (версия 19.0) осуществлялся статистический анализ. Нормальность распределения количественных признаков проверялась с помощью критериев Шапиро — Уилка и Колмогорова — Смирнова. Так как все количественные данные не подчинялись закону нормального распределения, для их описания использовались медиана и 1–3-й квартили (Me [Q1; Q3]). Качественные данные описывали как абсолютные значения и проценты (n, %).
Для сравнения двух групп по количественному признаку применяли критерий Манна — Уитни, для определения статистической значимости различий между качественными признаками — критерий Пирсона χ2 при значениях ожидаемых частот больше 5. Если более 20% ожидаемых частот были меньше 5, то использовался точный критерий Фишера. Межгрупповые различия признавались статистически значимыми при значении р < 0,05.
РЕЗУЛЬТАТЫ
У 86 (51,8%) наших пациентов регистрировались структурные изменения головного мозга, по данным нейровизуализации. МР-негативный вариант ВЭ зарегистрирован у 40 (24%) человек, что соответствует международным данным [10, 13]. Инфекционная этиология ВЭ выявлена у 33 (19,9%) пациентов, иммунноопосредованная ВЭ — в 8 (4,8%) случаях. С учетом особенностей нейровизуализации для анализа метаболических изменений, по данным МР-спектроскопии, пациенты с ВЭ были разделены на три группы: 1-я — пациенты с ВЭ и гиппокампальным склерозом (62 (37,3%) человека); 2-я — больные без структурных изменений, по данным МРТ головного мозга (МР-негативные) (40 (24%) человек); 3-я — пациенты с другими структурными изменениями головного мозга (64 (38,7%) человека, исключены из последующего анализа ввиду неоднородности нейрорадиологических данных).
Возраст дебюта эпилептических приступов в группе больных с ВЭ и гиппокампальным склерозом составлял 17 [13; 23,8] лет, в группе МР-негативных пациентов — 19 [13,3; 31] лет (р = 0,222). Длительность заболевания у лиц с ВЭ и гиппокампальным склерозом была 12,5 [7,8; 21] года, что на 4 года больше, чем в группе МР-негативных пациентов — 8,5 [3; 14,5] года (р = 0,003).
Анализ клинических особенностей показал, что у пациентов с ВЭ и гиппокампальным склерозом чаще регистрировалась очаговая неврологическая симптоматика (р = 0,019), чем у МР-негативных больных (табл. 1).
Таблица 1
Особенности неврологического статуса, течения и терапии височной эпилепсии (ВЭ) у пациентов с гиппокампальным склерозом и МР-негативной формой заболевания, n (%)
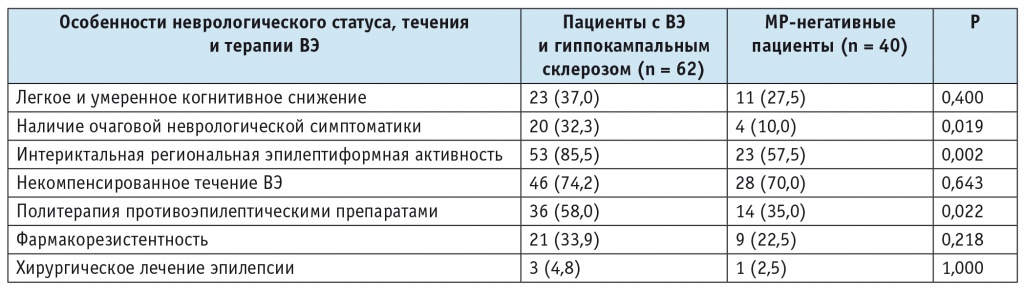
Очаговая неврологическая симптоматика присутствовала у 24 участников с МР-негативными формами ВЭ и склерозом гиппокампа. Преимущественно (в 21 (88%) случае) наблюдалась негрубая очаговая неврологическая симптоматика: нистагм — у 1 (4,2%) человека, анизорефлексия — у 4 (16,7%), асимметрия носогубных складок — у 3 (12,5%), нарушение чувствительности по полиневритическому типу на нижних конечностях — у 6 (25%), вегетативные нарушения (гипергидроз ладоней и стоп) — у 7 (29,1%) человек. У 3 (12,5%) больных выявлена грубая очаговая неврологическая симптоматика в виде пирамидных (центрального гемипареза) и чувствительных нарушений по типу гемигипестезии (2 (8,3%) пациента), центрального гемипареза с мозжечковыми нарушениями (гемиатаксией, адиадохокинезом) и нарушением функции тазовых органов (императивные позывы на мочеиспускание, поллакиурия) (1 (4,2%) человек).
Наличие негрубой очаговой неврологической симптоматики у больных ВЭ может быть обусловлено вероятной фокальной кортикальной дисплазией I типа, наиболее часто встречающейся при негативных результатах МРТ-исследования. У пациентов со склерозом гиппокампа наличие негрубых очаговых неврологических симптомов можно объяснить вероятным сочетанным поражением гиппокампа и других отделов ЦНС при фокальной кортикальной дисплазии IIIa типа, не обнаруженным при МРТ головного мозга.
Грубая неврологическая симптоматика у пациентов с ВЭ вызвана сочетанием склероза гиппокампа и структурным поражением височной области инфекционной или травматической этиологии.
Однако статистически значимые различия степени тяжести эпилептических приступов по шкале NHS-3 между пациентами с ВЭ и гиппокампальным склерозом (13 [11; 16] баллов) и МР-негативными пациентами (13,5 [11,3; 16] балла) отсутствовали (p > 0,05).
У лиц с ВЭ и гиппокампальным склерозом чаще выявлялась интериктальная региональная эпилептиформная активность при проведении рутинной ЭЭГ и/или ЭЭГ-мониторинга продолжительностью не более 3 часов (р = 0,002). Кроме того, для достижения контроля эпилептических приступов больным с ВЭ и гиппокампальным склерозом чаще требовалась политерапия противоэпилептическими препаратами (р = 0,022) (см. табл. 1).
В исследуемой выборке влияние склероза гиппокампа на течение и исходы ВЭ не найдено, p > 0,05.
С учетом дискутабельности использования МР-спектроскопии в диагностике ВЭ, особенно МР-негативных случаев, ретроспективно были проанализированы все имеющиеся данные МР-спектроскопии гиппокампов и височных долей у 32 пациентов с ВЭ. При оценке изменений уровней метаболитов выявлено, что чаще всего в общей выборке пациентов с ВЭ наблюдалось односторонне снижение содержания N-ацетиласпартата (65,6%). Отношение уровня N-ацетиласпартата к концентрациям холина и креатина в большинстве случаев (84,4% и 87,5% соответственно) оставалось без изменений. Наблюдалось двустороннее повышение содержания лактата у 25% больных. При этом у 56,2% пациентов уровень лактата не изменялся. У 5 (15,6%) человек оказалось повышенным содержание глутаматноглутаминового комплекса. В 31 (97%) случае концентрация мионозитола была в пределах референсных значений (табл. 2).
Таблица 2
Изменения уровней метаболитов, по данным магнитно-резонансной спектроскопии медиобазальных отделов височных долей, у пациентов с височной эпилепсией (ВЭ) с различными типами структурных нарушений, n (%)
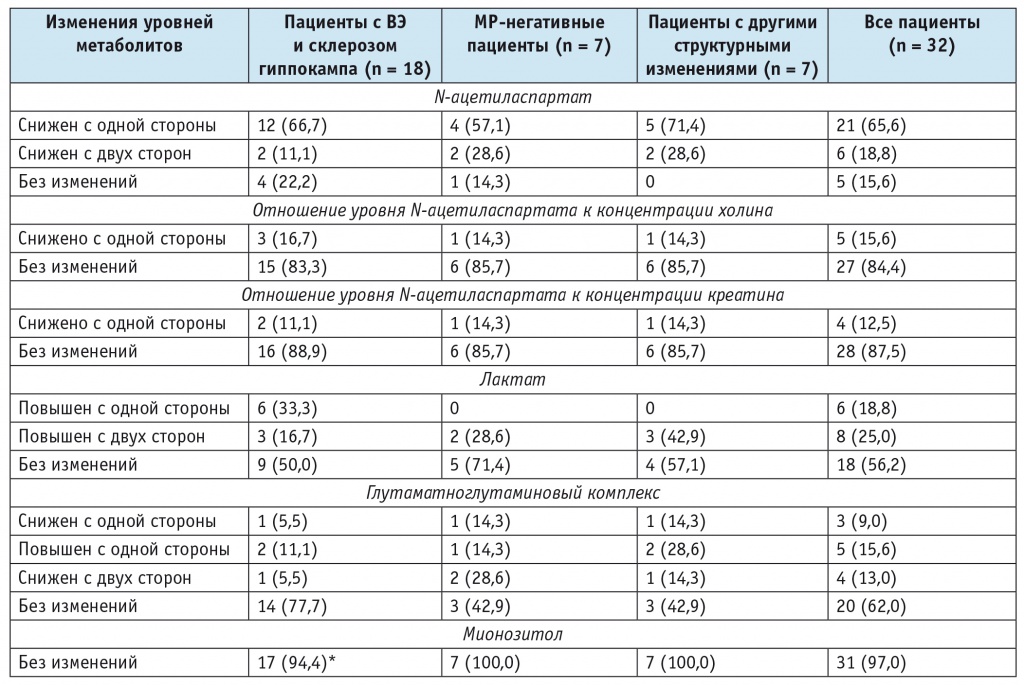
* У одного больного информация об уровне мионозитола отсутсвовала.
Следовательно, можно сделать вывод, что статистически значимая связь между уровнями метаболитов, по данным МР-спектроскопии медиобазальных отделов височных долей, и типом структурных нарушений у пациентов с ВЭ отсутствует (p > 0,05).
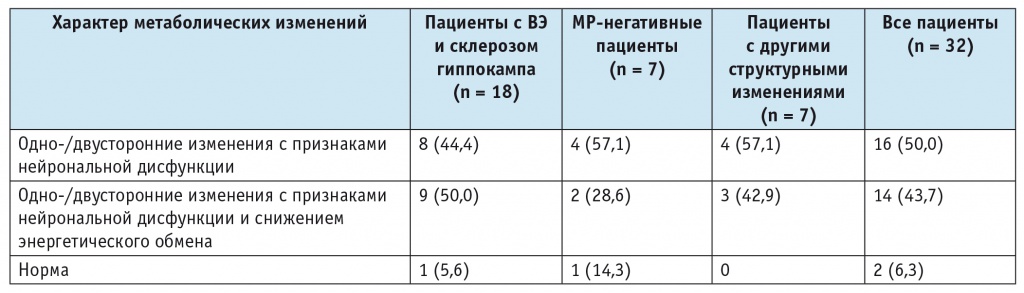
У 30 (93,7%) из 32 пациентов с ВЭ вне зависимости от этиологии заболевания зарегистрированы одно-/двусторонние изменения уровней N-ацетиласпартата и других основных метаболитов (табл. 3). Однако статистически значимые связи между уровнями метаболитов и характером метаболических изменений и типом структурных нарушений, характером течения, длительностью заболевания, ответом на противоэпилептическую терапию, наличием очаговой неврологической симптоматики, когнитивных и эмоционально-волевых нарушений не выявлены (р > 0,05), что может быть обусловлено малой выборкой.
Таблица 3
Характер метаболических изменений, по данным магнитно-резонансной спектроскопии медиобазальных отделов височных долей, у пациентов с височной эпилепсией (ВЭ) с различными типами структурных нарушений, n (%)
ОБСУЖДЕНИЕ
По данным исследований, изучающих формирование эпилептической системы мозга, изменение уровней N-ацетиласпартата и других основных метаболитов может быть обусловлено как заболеваниями ЦНС, которые привели к развитию ВЭ, так и субклинической эпилептиформной активностью, зарегистрированной при стереотаксической имплантации глубинных электродов, что совпадает с данными нашего исследования о метаболических нарушениях как у больных со склерозом гиппокампа, так и у МР-негативных пациентов [9, 14, 15].
При анализе нейрорадиологических особенностей важным, на наш взгляд, стало сравнение пациентов со склерозом гиппокампа и МР-негативных пациентов, поскольку в настоящее время различия между ними недостаточно изучены [3, 4]. У пациентов с мезиальной ВЭ и склерозом гиппокампа статистически значимо чаще регистрировались очаговая неврологическая симптоматика (р = 0,019), они чаще получали политерапию противоэпилептическими препаратами (р = 0,022), чем МР-негативные пациенты. Так, наличие очаговой неврологической симптоматики и политерапия противоэпилептическими препаратами являются убедительными признаками, которые, вероятно, следует рассматривать в качестве неблагоприятного прогностического фактора при ВЭ [16].
ЗАКЛЮЧЕНИЕ
Магнитно-резонансная спектроскопия медиобазальных отделов височных долей является чувствительным методом диагностики метаболических нарушений у пациентов с височной эпилепсией (ВЭ), однако нами не найдены статистически значимые связи между уровнями метаболитов, характером метаболических нарушений и типом структурных нарушений, а также клиническими особенностями пациентов с ВЭ, что требует дальнейшего изучения.
Поступила: 13.01.2022
Принята к публикации: 24.03.2022








