Синдром задней обратимой лейкоэнцефалопатии (СЗОЛ) представляет собой комплекс остро возникающих неврологических симптомов (судороги, нарушение сознания, головные боли, зрительные нарушения), обусловленных развитием вазогенного отека и обратимого повреждения субкортикального белого вещества, преимущественно задних отделов головного мозга [1, 2].
СЗОЛ может сопровождать множество патологических состояний, таких как резкое повышение АД, преэклампсия или эклампсия, сепсис, уремия при почечной недостаточности, гиперкальциемия, гипомагниемия, аутоиммунная патология, а также проведение гемотрансфузии, лечение иммуносупрессорами, цитотоксическими лекарственными препаратами или иммуноглобулинами и др. [1, 3-6].
Термин «синдром задней обратимой энцефалопатии» (posterior reversible encephalopathy syndrome) предложили в 1996 году J. Hinchey и соавт. [6]. Похожие клинико-нейровизуализационные проявления другими авторами обозначались как «гипертензивная энцефалопатия», «синдром обратимого заднего церебрального отека» [3].
Хотя J. Hinchey и соавт. (1996) подчеркивали особенность клинических нарушений и их полную обратимость при СЗОЛ, со временем был опубликован целый ряд данных, свидетельствовавших о невысокой специфичности клинических признаков этого синдрома [2, 7, 8]. В настоящее время предлагается рассматривать СЗОЛ как клинико-нейрорадиологический феномен [8, 9], поскольку клинические симптомы достаточно неспецифичны, и диагноз во многом основывается на выявлении типичных изменений при МРТ, а также на одновременности процессов клинического улучшения и разрешения патологических изменений на МРТ [10]. Однако, несмотря на то что первое подозрение на СЗОЛ возникает нередко именно у врача-нейрорадиолога, установление этого диагноза, безусловно, требует участия невролога [2].
Обнаружено, что, вопреки мнению J. Hinchey и соавт. (1996), обратимость поражения при СЗОЛ не во всех случаях является полной и не всегда возникает спонтанно [10]. Показано, что СЗОЛ может осложняться развитием инфаркта головного мозга, лейкомаляции, окклюзионной гидроцефалии (в случае выраженного отека ствола мозга и мозжечка) и геморрагий, что приводит к инвалидизации или смерти больного [1, 3, 11, 12]. Промедление с установлением диагноза и началом лечения СЗОЛ способно привести к стойким структурным повреждениям головного мозга и к необратимому неврологическому дефициту [13]. Однако диагностика СЗОЛ нередко представляет трудности для невролога, что определяет актуальность обсуждения этой проблемы.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Приводим описание пациента с тяжелым СЗОЛ на фоне неконтролируемой АГ и ревматоидного артрита.
Пациент С., 40 лет, поступил в сосудистый центр ГБУЗ НО «Нижегородская областная клиническая больница им. Н.А. Семашко» 22 января 2017 года в связи с тем, что в этот день во время приема у врача-офтальмолога у него повысилось АД до 220/105 мм рт. ст., возникли спутанность сознания и общая слабость.
Из анамнеза известно, что пациент с юности страдает серонегативным ревматоидным артритом и в течение последних десяти лет получал и продолжает получать преднизолон (5 мг в сутки перорально). На протяжении полутора лет также принимал метотрексат (10 мг перорально 1 раз в неделю), однако в декабре 2016 года отказался от этого препарата из-за связанной с его приемом тошноты. Несколько лет назад был диагностирован остеопороз, больной перенес многочисленные переломы ребер, компрессионные переломы позвонков грудного отдела позвоночника. В течение десяти лет перед госпитализацией отмечал периодические подъемы АД до 200/100 мм рт. ст., плохо купируемые антигипертензивными препаратами.
Три недели назад утром после пробуждения почувствовал сильную головную боль в височных и затылочной областях давящего характера, сопровождавшуюся тошнотой и неоднократной рвотой на высоте болевого приступа. АД не измерял. На протяжении последующих дней зрение постепенно ухудшилось до уровня светоощущения, а две недели назад в левых полях зрения появились зрительные галлюцинации (например, видел слева от себя свою кошку, которая в реальности в этот момент находилась в другом месте), в связи с чем обратился к офтальмологу. В день госпитализации на фоне повышения АД до 220/105 мм рт. ст. состояние больного резко ухудшилось: возникли спутанность сознания и общая слабость.
При поступлении в сосудистый центр 22 января 2017 года: пациент пониженного питания, кожные покровы бледные, частота дыхательных движений — 16 в минуту, наблюдались резкая деформация суставов рук и ног, выраженная кифотическая деформация грудного отдела позвоночника.
Неврологический статус: состояние тяжелое, сознание спутано. Глаза открывает, однако взгляд фиксирует кратковременно. Отмечается аффект недоумения. Не ориентирован во времени и пространстве. Зрачки симметричные, фотореакция ослаблена. Мышечная сила снижена диффузно до 3 баллов. Ригидность мышц затылка — 3 поперечных пальца. Симптом Кернига проверить невозможно из-за контрактуры коленных суставов.
Общий анализ крови при поступлении: лейкоциты — 9,53 × 109/л (норма — 4-10 × 109/л), нейтрофилы — 80,1% (норма — 50-70%), лимфоциты — 12,0% (норма — 20-40%), моноциты — 6,0% (норма — 3-12%), эозинофилы — 1,2% (норма — 0,5-5,0%), базофилы — 0,7% (норма — 0-1%), эритроциты — 4,0 × 1012/л (норма — 3,50-5,50 × 1012/л), гемоглобин — 104 г/л (норма — 110-160 г/л), гематокритное число — 33,3% (норма — 37-54%), тромбоциты — 83 × 109/л (норма — 100-300 × 109/л). Результаты указывали на нейтрофилез, анемию легкой степени, тромбоцитопению. Содержание сывороточного железа снижено до 6,0 мкмоль/л (норма — 11,6-31,3 мкмоль/л). Коагулограмма при поступлении в норме.
В биохимическом анализе крови: мочевина — 6,5 ммоль/л (норма — 1,7-8,3 ммоль/л), креатинин — 253,4 мкмоль/л (норма — 55-115 мкмоль/л), АЛТ — 10 Ед/л (норма — 0-41 Ед/л), АСТ — 22 Ед/л (норма — 0-37 Ед/л). Глюкоза крови — 4,9 ммоль/л. СРБ — 12,70 мг/л (норма — менее 5 мг/л). Ревматоидный фактор — 90 МЕ/мл (норма — до 25 МЕ/мл). Исследование на LE-клетки отрицательно. Выявлена умеренная гипомагниемия — 0,75 ммоль/л (норма — 0,80-1,00 ммоль/л).
В анализе мочи — легкая протеинурия (0,59 г/л). Явных электролитных нарушений, нарушений кислотно-основного состояния крови не было.
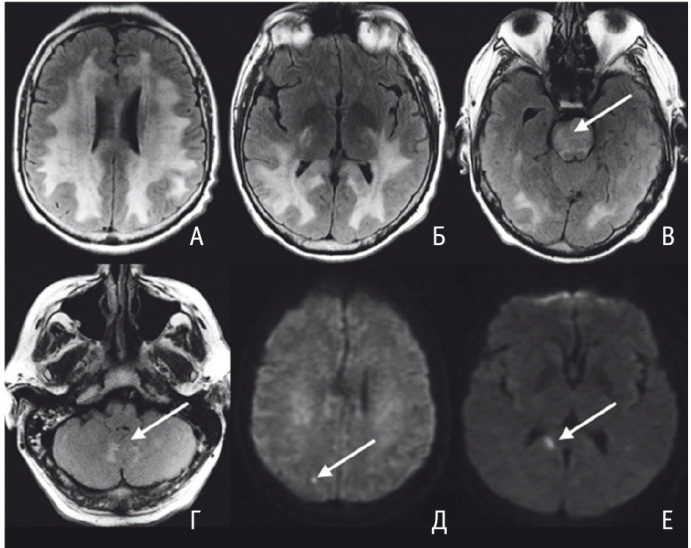
При осмотре глазного дна обнаружены выраженный застой дисков зрительных нервов, снижение зрения до уровня светоощущения. По данным МСКТ головного мозга, в день поступления имелся отек головного мозга, выраженный преимущественно в его задних отделах. МРТ головного мозга выявила признаки диффузного поражения белого вещества обеих гемисфер головного мозга с вовлечением в процесс мозжечка, мозолистого тела, варолиева моста (рис. А-Г). Найдены участки микроишемии в области заднего рога справа и в затылочной доле справа (рис. Д, Е).
Рис. Магнитно-резонансные томограммы пациента С.: обширные симметричные участки вазогенного отека на аксиальных изображениях, полученных в режиме FLAIR (А-Г); отмечается вовлечение ствола мозга (В, показано стрелкой) и мозжечка (Г, показано стрелкой). Д, Е — участки цитотоксического отека на изображениях в режиме DWI с фактором взвешенности диффузии b = 1000 (отмечены стрелками). Иллюстрация авторов
Результаты УЗИ почек свидетельствовали о диффузных изменениях паренхимы (повышена эхогенность паренхимы почек, нарушена кортико-медуллярная дифференцировка).
Пациент консультирован терапевтом. Установлены диагнозы: хроническая болезнь почек С3 стадии, хроническая почечная недостаточность 1-й стадии; вероятнее всего, острая почечная недостаточность без олигоанурии; анемия на фоне хронических заболеваний.
С учетом клинической симптоматики и результатов нейровизуализации невролог заподозрил СЗОЛ. Начаты антигипертензивная и дегидратационная терапия и профилактика вазоспазма (нимодипин перорально) в условиях реанимационного отделения сосудистого центра Нижегородской областной клинической больницы им. Н.А. Семашко. К вечеру первого дня, проведенного в клинике, состояние больного оставалось тяжелым, сохранялись спутанность сознания, повышенная тревожность и двигательное беспокойство. На тот момент, по воспоминаниям пациента, он представлял окружающее не как больницу, а как некую «келью», видел «священников» вокруг, испытывал устрашающие видения фантастических животных.
На протяжении последующих 3-4 дней отмечалось значительное клиническое улучшение. Сознание восстановилось; события, происходившие с ним с момента госпитализации, помнил отрывочно. Зрение улучшилось, однако острота его оставалась низкой. В правом поле зрения наблюдалась положительная скотома. В этот же период пациент стал отмечать яркие вспышки света в глазах, возникавшие даже в полной темноте.
Через 9 дней после госпитализации пациент находился в ясном сознании, мышечная сила наросла до 5 баллов в руках и ногах. Сохранялись снижение остроты зрения и положительная скотома в правом поле зрения. При повторном фундоскопическом исследовании была определена ангиопатия сетчатки обоих глаз без признаков застоя на глазном дне. В нейропсихологическом статусе выявлялись умеренные модально-неспецифические нарушения памяти, произвольного внимания и регуляторных функций. Они сохранялись на момент выписки на 15-е сутки госпитализации.
По данным МРТ с МР-ангиографией от 1 февраля 2017 года, регистрировалась нормальная картина артерий головного мозга, отмечены косвенные признаки снижения отека головного мозга.
ОБСУЖДЕНИЕ
Клиническая симптоматика у наблюдавшегося нами больного С. возникла остро (головная боль, тошнота и снижение зрения), затем постепенно нарастала на протяжении 3 недель, после чего нарушение состояния вновь остро усугубилось (возникли спутанность сознания и слабость в конечностях). Развитие СЗОЛ на протяжении нескольких недель описано, хотя встречается не столь часто [2]. Более характерным является острое или подострое начало СЗОЛ с нарастанием симптомов на протяжении нескольких часов или дней, чаще — 24-48 часов [1, 2].
Клинических проявлений СЗОЛ много, они могут включать головную боль, тошноту и рвоту, эпилептические припадки (преимущественно парциальные, со вторичной генерализацией и риском развития эпилептического статуса), когнитивные и поведенческие расстройства, расстройства сознания, зрительные и близкие к ним нарушения (гемианопсию, скотому, корковую слепоту, зрительные галлюцинации, синдром Антона). В ряде случаев могут иметь место парезы, нарушения чувствительности и координации, афазия [2, 3, 7, 11]. В исследовании W.H. Lee и соавт. (2008) судороги отмечались у 87% пациентов с СЗОЛ, когнитивные расстройства — у 92%, головные боли — у 53%, нарушения зрения — у 39% [14]. Симптомы, имевшие место у больного С., входят в число характерных признаков СЗОЛ.
Головная боль при СЗОЛ — тупая и диффузная [2], хотя в ряде случаев наблюдается громоподобная головная боль. В связи с этим необходимо отметить возможность сочетания СЗОЛ с синдромом обратимой вазоконстрикции, основное клиническое проявление которого — повторяющиеся в течение нескольких дней или 1-2 недель эпизоды громоподобной головной боли [15]. Обращается внимание на то, что при СЗОЛ нередко развивается обратимый мультифокальный вазоспазм церебральных артерий, а при синдроме обратимой вазоконстрикции в 8-38% случаев возникает обратимый отек головного мозга [2, 5, 15]. Интенсивная головная боль у нашего пациента, вероятнее всего, была связана с подостро развивающимся отеком мозга и нарастанием внутричерепной гипертензии.
Нарушения зрительного восприятия при СЗОЛ могут включать сенсорные зрительные расстройства (снижение остроты зрения вплоть до корковой слепоты, нарушения полей зрения), гностические зрительные расстройства (прежде всего пространственный неглект) и зрительные галлюцинации, как простые (фотопсии), так и сложные [1, 8, 12]. Изменения на глазном дне могут быть представлены кровоизлияниями в сетчатку (имеющими вид «языков пламени», экссудата или застойных дисков зрительных нервов), хотя нормальная фундоскопическая картина не исключает диагноз СЗОЛ [1, 11, 16]. Зрительные расстройства у описанного нами пациента заключались в снижении остроты зрения и появлении скотом, а также в возникновении сложных зрительных галлюцинаций. В ряде случаев причиной ухудшения зрения при СЗОЛ выступает обусловленная выраженным отеком компрессионно-ишемическая нейропатия зрительных нервов, характеризующаяся последующим практически полным восстановлением остроты зрения [17].
Нарушения сознания при СЗОЛ по тяжести варьируют от небольшой сонливости до сопора или комы в случаях наиболее тяжелого течения [1, 3, 6, 18]. Периоды сонливости могут чередоваться с двигательным беспокойством, как это было у нашего больного. СЗОЛ может манифестировать и более сложными нейропсихиатрическими проявлениями с резким изменением содержания сознания и возникновением продуктивной психотической симптоматики, например делирия [19].
В описанном нами случае у пациента развилась клиническая картина помрачения сознания с яркими устрашающими зрительными галлюцинациями. К вечеру первого дня госпитализации у него наблюдались психомоторное возбуждение, бессвязная речь, он не мог концентрировать внимание. Впоследствии у пациента отдельные отрывочные воспоминания об этом периоде сохранились, на их основании и было констатировано наличие пугающих галлюцинаторных образов.
Центральным звеном патогенеза СЗОЛ на сегодняшний день считается поражение сосудистой стенки, предрасполагающее к проникновению плазмы и макромолекул или эритроцитов в интерстициальную ткань головного мозга [7]. Обсуждается как прямое повреждение эндотелия токсинами или фармакологическими агентами, так и вторичное изменение стенки сосуда вследствие механического эффекта при резком повышении АД [7].
Развитие синдрома на фоне роста АД отмечается в 41-61% случаев СЗОЛ [2, 4], а по данным Y. Li и соавт. (2012) — даже в 97% случаев. Практически постоянно у больных в анамнезе выявляется АГ [1]. Согласно данным Y. Li и соавт. (2012), около 50% пациентов, перенесших заднюю обратимую лейкоэнцефалопатию, до этого имели выраженную АГ, при которой значения систолического АД превышали верхний лимит церебральной ауторегуляции 140-160 мм рт. ст. [7]. Нормализация АД у таких больных приводила к регрессу клинических и нейровизуализационных признаков СЗОЛ, что служит еще одним доказательством патогенетической роли АГ при данном синдроме [2]. В связи с этим в настоящее время СЗОЛ рассматривается как вариант острой гипертонической энцефалопатии, хотя повышение АД и не является обязательным критерием диагноза [9].
Как правило, развитию СЗОЛ предшествует не столько высокий уровень АД как таковой, сколько значительные колебания АД [2]. Полагают, что для повреждения гематоэнцефалического барьера и развития вазогенного отека имеет значение не только степень повышения АД, но и скорость этого повышения [2, 7]. У пациентов с привычно низким уровнем АД критическим может стать его увеличение всего лишь до уровня умеренной гипертензии [17].
Особенно высок риск возникновения СЗОЛ при подъеме АД свыше 220/110 мм рт. ст. у тех пациентов с АГ, которые не получали терапию или прекратили лечение либо не достигли контроля над гипертензией [1]. Именно такая ситуация имела место у описываемого нами больного, который на протяжении многих лет отмечал резкие подъемы систолического АД до уровня 200-220 мм рт. ст., не контролировавшиеся лекарственными препаратами.
Следует отметить, что патогенетический механизм формирования СЗОЛ на фоне повышенного АД на сегодняшний день до конца не ясен [4, 12]. Предложены две основные гипотезы развития синдрома на фоне АГ. Более ранняя гипотеза предполагает, что АГ вызывает компенсаторные ауторегуляторный вазоспазм, гипоперфузию мозговой ткани и отек мозга, преимущественно в области зон смежного кровообращения [4, 9, 11, 12]. В пользу этой гипотезы свидетельствует регистрируемый при СЗОЛ вазоспазм с нарушением перфузии головного мозга [1, 5, 9].
Вторая, более распространенная сейчас гипотеза состоит в том, что на фоне повышенного АД происходит «срыв» сосудистой ауторегуляции, и возникающая вазодилатация церебральных артериол приводит к гиперперфузии мозговой ткани и гидростатическому отеку [3, 4, 7, 10-12]. Фильтрация компонентов крови в интерстициальную среду головного мозга при этом не обязательно является пассивным процессом: важную роль могут играть кальций-зависимые натриевые каналы [1]. Эту теорию подтверждают случаи СЗОЛ, при которых, по данным КТ, при сверхостром развитии неврологической симптоматики с самого начала выявляется отек вещества мозга, в то время как при СЗОЛ на фоне гипоперфузии отек не успел бы сформироваться за столь короткое время [7].
Кроме того, если бы вазоконстрикция была основной причиной появления отека, то последний возникал бы в областях с наиболее плотной симпатической иннервацией сосудов, но не в теменно-затылочной области [7]. Дело в том, что артерии вертебрально-базилярной системы по сравнению с сосудами системы внутренних сонных артерий имеют более слабую симпатическую иннервацию и поэтому более чувствительны к резким подъемам АД [1, 3, 4, 8, 11, 20]. Эта неравномерность симпатической иннервации может объяснить паттерн распределения отека при СЗОЛ в свете гипотезы о гиперперфузии и срыве ауторегуляторных механизмов.
Важными факторами, предрасполагающими к СЗОЛ, служат повреждение эндотелия и нарушение целостности гематоэнцефалического барьера, способствующее развитию отека мозга не только при повышении гидростатического давления артериальной крови, но и в отсутствие такового [2, 5, 9]. Действительно, 15-20% пациентов с обратимой задней лейкоэнцефалопатией являются нормотониками или гипотониками [2, 9], а среди всех случаев СЗОЛ на фоне АГ в 50% уровень систолического АД не превышает пределы ауторегуляции (140-160 мм рт. ст.) [2]. Хотя эти данные следует интерпретировать с осторожностью, поскольку наиболее высокие значения систолического АД у таких пациентов могли не зарегистрировать, а верхний порог ауторегуляции варьирует [2, 7], но все же признается возможность развития СЗОЛ при отсутствии повышения АД. Как правило, у таких больных имеются тяжелые сопутствующие метаболические нарушения, в частности уремия [7, 11, 21], и к вазогенному отеку приводит иммунологически или токсически опосредованное эндотелиальное повреждение [4, 8, 11, 13, 21]. Более того, имеются предположения, что сама гипертензия является реакцией на недостаточную перфузию головного мозга, вызванную эндотелиальной дисфункцией вследствие системных токсических эффектов [2, 10].
Повреждение эндотелия, приводящее к развитию СЗОЛ, может быть обусловлено аутоиммунными заболеваниями, в том числе ревматоидным артритом [1, 2]. Определенная роль в патогенезе СЗОЛ отводится некоторым лекарственным препаратам, изменяющим состояние гематоэнцефалического барьера или путем прямого токсического действия на эндотелий сосудов, или опосредованно, за счет стимулирования синтеза цитокинов, которые, в свою очередь, индуцируют повреждение клеток-мишеней [1, 5, 6]. В частности, иммуносупрессивные или цитотоксические препараты (например, метотрексат) способны служить триггерами развития СЗОЛ даже через несколько месяцев после завершения их приема [2, 22].
Наблюдавшийся нами больной С. длительное время страдал от ревматоидного артрита, на протяжении полутора лет принимал метотрексат, лечение которым прервал за месяц до описываемых событий. Прием цитостатика может способствовать повреждению эндотелия артериол головного мозга и снижению порога ауторегуляции мозгового кровообращения, что повышает риск СЗОЛ. В то же время обычно на фоне лечения метотрексатом СЗОЛ возникает у пациентов в первые дни после введения высоких доз препарата (более 1 мг/м2 площади поверхности тела), в таких случаях развитие синдрома связано с генетически обусловленными дефектами метаболизации метотрексата и накоплением этого препарата в плазме крови в высоких концентрациях [23]. В рассматриваемом нами случае пациент прекратил прием метотрексата за месяц до появления СЗОЛ, поэтому сомнительно, чтобы цитостатик был его причиной. Более вероятно, что главным фактором стало именно повышение АД.
Немаловажную роль в патогенезе СЗОЛ играют также электролитные расстройства: гипонатриемия, гипомагниемия, гипер- и гипокальциемия [1, 4]. Указывается, что в ряде случаев для регресса симптоматики достаточно лишь возмещения концентрации в плазме крови магния до физиологической [1]. Отметим, что уровень магния в крови пациента был ниже нормы, что вызвало потребность в его искусственной коррекции. Концентрации калия, натрия и кальция, однако, не выходили за пределы нижней границы нормы.
Обращается внимание на то, что патологические изменения при СЗОЛ не ограничиваются веществом головного мозга, но могут также развиваться в глазных яблоках (кровоизлияние в сетчатку, застойные диски зрительных нервов) и почках (фибриноидные изменения клубочков) [1]. До 55% всех случаев СЗОЛ сопровождаются нарушением функции почек, и, как правило, затруднительно установить, является ли почечная дисфункция независимым фактором развития СЗОЛ, следствием приводящих к СЗОЛ АГ и аутоиммунных заболеваний либо одним из проявлений самого синдрома [1, 2, 9].
У пациента С. с момента поступления в стационар при нормальном анализе мочи отмечалось стойкое повышение содержания креатинина. Данный факт может отражать системный характер нарушения процессов ауторегуляции сосудистого тонуса при СЗОЛ. Кроме того, нельзя исключить наличие у наблюдавшегося нами больного хронической патологии почек, связанной с длительной терапией цитотоксическими и иммуносупрессивными препаратами.
Верификация СЗОЛ осуществляется по данным нейровизуализации головного мозга. Хотя участки отека белого вещества головного мозга могут быть обнаружены и на КТ (как у пациента С.), методом выбора при подозрении на СЗОЛ считается МРТ. МРТ по сравнению с КТ обладает при данном синдроме более высокой диагностической чувствительностью, а также помогает исключить другие патологические состояния, сходные с СЗОЛ по клинической картине, например ишемический инсульт [1, 2, 6, 20].
Указывается однако, что даже при наличии выраженных клинических проявлений СЗОЛ изменения на МРТ головного мозга в начале заболевания могут отсутствовать, появляясь лишь спустя какое-то время. Описан случай СЗОЛ с летальным исходом, при котором только патоморфологическое исследование выявило характерные для синдрома проявления, отсутствовавшие на прижизненной МРТ [5].
Для диагностики СЗОЛ рекомендуется применять такие импульсные последовательности, как FLAIR, T1 до и после контрастного усиления, DWI и SWI [20]. Применение Т1-взвешенных импульсных последовательностей с контрастным усилением позволяет проводить дифференциальную диагностику состояния с объемными образованиями. Диффузионно-взвешенные изображения обнаруживают участки цитотоксического отека головного мозга. Использование последовательности FLAIR выявляет вовлечение коры головного мозга при данном синдроме, а SWI — геморрагические изменения церебрального вещества, в ряде случаев сопровождающие СЗОЛ [1].
В описанном клиническом случае было проведено МРТ-исследование по стандартной программе без применения контрастного вещества, с учетом снижения у больного скорости клубочковой фильтрации менее 30 мл/мин. Применялись импульсные последовательности Т2, Т1, FLAIR, DWI, а на девятые сутки госпитализации было произведено МР-ангиографическое исследование (TOF MRA).
Как основное радиологическое проявление СЗОЛ вазогенный отек не менее чем в 40% случаев тяготеет к задним отделам полушарий головного мозга, чаще затрагивает белое вещество, но может распространяться и на прилегающее серое вещество (данный факт делает термин «лейкоэнцефалопатия» не вполне точным) [1-3, 11, 16, 20, 24]. В литературе описаны случаи, в которых на фоне СЗОЛ наблюдаются как лакунарные очаги нарушения диффузии, так и участки кровоизлияний, что не противоречит диагнозу [2, 25].
Признаки отека на МРТ — билатеральные симметричные, существенно реже — асимметричные изменения сигнала в субкортикальных и кортикальных областях теменной и затылочной долей [9]. Такие очаги исчезают на протяжении дней или нескольких недель [2]. Вазогенный отек может локализоваться не только в затылочно-теменной области (типичный характер его распределения), но и в лобных, височных долях головного мозга, мозжечке, стволе и базальных ядрах, что рассматривается как атипичный вариант [4, 5, 11, 20]. В литературе приведены данные патоморфологических исследований, выявивших вовлечение также спинного мозга при СЗОЛ [26].
У наблюдавшегося нами пациента С. имело место практически симметричное диффузное вовлечение в процесс белого вещества больших полушарий головного мозга без заинтересованности коры (см. рис. А-В), при этом отек распространялся на валик мозолистого тела, ствол мозга (см. рис. В) и мозжечок (см. рис. Г), что может быть классифицировано как атипичный вариант нейрорадиологической картины.
Установлено, что вазогенный отек распространяется на серое вещество головного мозга (таламус, базальные ганглии) и субтенториальные структуры, он возникает при тяжелой АГ [7, 8, 13]. Объясняют это тем, что данные структуры снабжаются малыми артериями, которые отходят непосредственно от крупных артериальных стволов и поэтому подвержены высокому перфузионному давлению. Для нарушения гематоэнцефалического барьера на указанных уровнях необходимы более высокие показатели АД [8]. Это согласуется с анамнезом высоких «злокачественных» подъемов АД у пациента С. Не исключено, что, начавшись за двадцать дней до госпитализации пациента, синдром приобрел более тяжелое течение именно вследствие расширения зоны отека с распространением на ствол головного мозга.
Область вазогенного отека на МРТ характеризуется очагами, гиперинтенсивными на Т2-взвешенных изображениях и гипо- или изоинтенсивными в режиме диффузионно-взвешенных изображений при высоком факторе диффузии, и повышением интенсивности сигнала при ADC-картировании, что свидетельствует об обратимости изменений [1, 11, 12]. Появление областей цитотоксического отека встречается достаточно редко и характеризуется повышением сигнала на высоких факторах диффузии (b = 1000) [1, 3, 9, 12]. Небольшие точечные локусы цитотоксического отека, выявляемые в режиме DWI, могут разрешаться без формирования кист, то есть являются обратимыми [8, 13, 20]. Крупные участки ишемии встречаются реже и, как правило, связаны с необратимым повреждением вещества мозга [2, 7, 25, 26]. Различение видов отека необходимо, так как от этого зависит тактика лечения [20].
У описанного нами пациента С. при МРТ в режиме DWI на фоне картины вазогенного отека отмечались немногочисленные зоны цитотоксического отека (см. рис. Д, Е), преимущественно в задних отделах головного мозга, размером от 4 до 10 мм.
Контрастное усиление в очагах вазогенного отека наблюдается в 20-30% случаев [2], чаще в виде непротяженных участков накопления контрастного вещества [3, 20].
Возможно формирование петехиальных микрокровоизлияний [3], а также кровоизлияний по типу гематомы, геморрагического пропитывания очагов или даже субарахноидального кровоизлияния, особенно у пациентов с коагулопатиями [1, 11].
МР-ангиография и селективная катетеризационная ангио-графия в 15-30% случаев СЗОЛ выявляют фокальные или диффузные участки вазоконстрикции, вазодилатации (в том числе в виде «нити бус») или обрыв дистальных сегментов интракраниальных (особенно задних мозговых) артерий [2]. У описанного нами пациента МР-ангиографическая картина выглядела нормально, однако необходимо учитывать, что исследование было проведено на девятые сутки госпитализации на фоне выраженного клинико-радиологического улучшения.
Дифференциальная диагностика СЗОЛ проводится с билатеральным ишемическим инсультом в бассейне задних мозговых артерий, с венозным тромбозом, васкулитами, митохондриальной энцефалопатией, энцефалитами вирусной этиологии, острым рассеянным энцефаломиелитом; при этом учитываются как клинические, так и нейровизуализационные различия приведенных заболеваний [1-3, 12].
Характерно, что при СЗОЛ прилегающее к шпорной борозде вещество и парамедианные области затылочной доли, как правило, не заинтересованы, что помогает отличить СЗОЛ от билатеральных инфарктов в бассейне задних мозговых артерий. Кроме того, при инфаркте в затылочной доле часто одновременно поражаются таламус и средний мозг, что не характерно для СЗОЛ [1, 11].
Специфическое лечение СЗОЛ на сегодняшний день отсутствует, однако состояние обратимо при устранении или коррекции действия предрасполагающего фактора, в первую очередь АГ [1, 2, 8, 10]. Рекомендуется продолжительное внутривенное введение гипотензивных средств без резкого снижения АД, которое может спровоцировать почечную, церебральную или сердечную ишемию [1, 2]. Своевременное начало лечения АГ приводит к выраженному улучшению состояния больного [7]. Переходить на пероральные средства следует до окончания внутривенного введения препаратов [1]. Стабилизации АД у больного С. удалось достичь в первые сутки заболевания. В дальнейшем на фоне стабильной гемодинамики наблюдался постепенный клинико-радиологический регресс симптоматики.
Полный или практически полный клинико-нейрорадиологический регресс проявлений СЗОЛ в случае устранения причинных факторов и при своевременной адекватной терапии отмечается у 70-90% больных [3, 8, 11, 14]. В большинстве случаев пациенты полностью восстанавливаются в течение 1-2 недель [2, 4], реже — на протяжении нескольких месяцев вплоть до года [3, 11].
Стойкий остаточный неврологический дефицит, в основе которого лежит развитие кистозно-атрофических изменений головного мозга, описан в 5-30% случаев СЗОЛ [4, 8, 22]. Описано персистирование гемипареза, судорожного синдрома, зрительных нарушений, головокружения [2]. Указывается также на то, что у 10-15% перенесших СЗОЛ впоследствии развиваются повторные судорожные приступы [2].
В 5-10% случаев СЗОЛ может рецидивировать, что наблюдается, как правило, у лиц с неконтролируемой АГ [2, 8, 12].
Смертность при СЗОЛ, по данным разных авторов, составляет 3-11% [2, 18]. К числу независимых предикторов неблагоприятного исхода при СЗОЛ относят гипергликемию в первые 24 часа заболевания, запоздание с коррекцией спровоцировавшего развитие данного синдрома фактора [2], повышение уровня СРБ в плазме крови, а также развитие субарахноидального кровоизлияния, расстройства сознания и нарушение коагуляции в начале заболевания [18].
У описанного нами пациента С. из числа этих предикторов имелись повышение уровня СРБ в плазме крови и нарушение сознания. Однако гликемия оставалась в норме, АД стабилизировано в первые сутки интенсивной терапии, нарушений коагуляции и геморрагических явлений не было.
ЗАКЛЮЧЕНИЕ
Рассмотренный клинический случай иллюстрирует многообразие клинико-нейровизуализационных проявлений синдрома задней обратимой лейкоэнцефалопатии и тяжесть его течения при наличии нескольких предрасполагающих факторов.








