Одной из наиболее востребованных групп лекарственных препаратов (ЛП) остаются НПВП. Универсальное сочетание анальгетического и противовоспалительного эффектов (уникальное для этого класса) вкупе с удобством применения сделали НПВП незаменимым инструментом как для неотложной анальгезии в амбулаторной и стационарной практике, так и для длительного контроля симптомов при хронических заболеваниях костно-мышечной системы[1–3]. Вновь выявленные в последние годы особенности механизма фармакологического действия НПВП, в частности нимесулида, весьма актуальны для практикующих врачей.
Современное понимание феномена боли основано на достижениях последних десятилетий, обосновавших сложный механизм ее формирования и хронизации[4]. Окончательное восприятие боли зависит не только от интенсивности болевого стимула в очаге, но и от баланса ноцицептивной и антиноцицептивной систем. Альтерация тканей независимо от причины запускает в месте повреждения каскадные реакции синтеза медиаторов, цитокинов (ИЛ), факторов роста, нейротрансмиттеров и пептидов (субстанции Р, кининов), производных полиненасыщенных жирных кислот (в первую очередь, простагландинов (ПГ), лейкотриенов, тромбоксанов), вызывающих сенситизацию периферических ноцицепторов[4, 5]. Многие из этих участников воспалительного ответа еще более усиливают повреждение и раздражение рецепторов.
При длительном сохранении повреждающего фактора отмечается феномен центральной сенситизации, предопределяющий формирование хронической боли. При ней передача болевого сигнала возможна при незначительном количестве нейротрансмиттеров, поскольку даже при минимальной стимуляции отмечается высокий уровень возбуждения в центральных сенсорных областях мозга, определяющих наличие боли[1, 6].
Современные представления о терапии боли предполагают воздействие как на воспаление в очаге и сопутствующую медиаторную атаку, так и на периферическую (на уровне ноцицепторов) и центральную сенситизацию (на уровне спинного мозга). Именно свойства НПВП ингибировать процессы образования и накопления в очаге воспаления ПГ — активных участников нейрональной сенситизации — позволяют столь широко использовать их в клинической практике[6].
Синтезированный еще до открытия механизмов ингибирования ЦОГ селективный ингибитор ЦОГ-2, единственный представитель сульфонанилидов нимесулид в полной мере реализует все эффекты НПВП. Однако он интересен не только ЦОГ-опосредованными механизмами, но и многими дополнительными свойствами[2, 6–8].
ФАРМАКОКИНЕТИКА И ФАРМАКОДИНАМИКА НИМЕСУЛИДА
ЦОГ-связанные механизмы действия нимесулида с преимущественым подавлением ЦОГ-2 играют главную роль в реализации лечебного эффекта. Цель данной статьи — акцентировать внимание на иных, не менее важных характеристиках нимесулида, на особенностях фармакокинетики и технологическом усовершенствовании препарата Найз (Dr. Reddy’s Laboratories).
Ключевым преимуществом нимесулида при купировании острой боли считается быстрое достижение пика концентрации в крови благодаря хорошему всасыванию[7]. После приема ЛП уже через 30 мин достигается 55–80% его максимальной концентрации, анальгезия наступает в среднем через 15–20 мин после приема ЛП[7, 8]. Быстрое наступление локального анальгетического эффекта нимесулида развивается благодаря хорошему проникновению в ткани и в синовиальную жидкость[9, 10].
Еще одним важным фактором развития анальгетического эффекта является скорость высвобождения лекарственного вещества из таблетки, которая зависит от активности ее распада (дезинтеграции) и последующего всасывания. При разработке рецептур таблетированной формы данного ЛП ставятся цели оптимизировать дезинтеграцию, улучшить характеристики дезинтегрантов. Основная задача при повышении скорости действия препаратов — ускорение дезинтеграции.
Дезинтегрант — вспомогательное вещество, реализующее быстрый распад таблетки и высвобождение действующего вещества. Дезинтеграция таблеток обеспечивается за счет капиллярного эффекта и набухания[11]. Один из самых активно используемых дезинтегрантов с капиллярным эффектом — это крахмал. Лидером по способности набухания — супердезинтегрантом — считается натрия крахмал гликолят (НКГ), имеющий выраженное свойство набухания[12, 13]. Механизм дезинтеграции, скорость и степень набухания существенно отличают его от других дезинтегрантов, например кроскармеллозы, имеющей преимущественно капиллярный эффект (рис. 1).
Рис. 1. Различия механизмов действия супердезинтегрантов — натрия крахмала гликолята и кроскармеллозы[12]
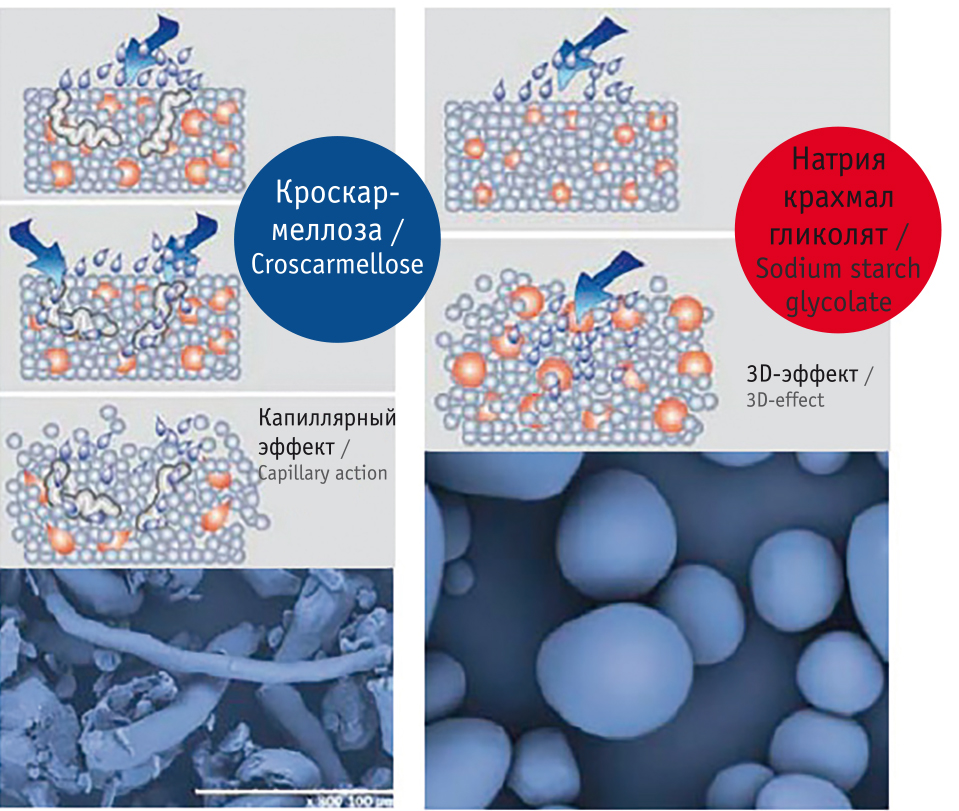
Важно и то, что эффекты НКГ по скорости поглощения и объему связываемой жидкости, в отличие от таковых у других супердезинтегрантов, не зависят от рН среды (рис. 2). В среде, аналогичной кислотности содержимого кишечника (рН = 6,8), НКГ за 3–5 мин набухает приблизительно в 3 раза быстрее, чем кроскармеллоза, скорее достигая максимального объема, в 3–4 раза большего (до 15 мл/г), чем у кроскармеллозы (до 3,5 мл/г) и других супердезинтегрантов[12, 13] (см. рис. 2).
Рис. 2. Увеличение объема (набухание) натрия крахмала гликолята (Эксплозола), кроскармеллозы и других супердезинтегрантов при добавлении жидкостей, имитирующих по рН содержимое желудка (рН = 1,0) и кишечника (рН = 6,8)[14]
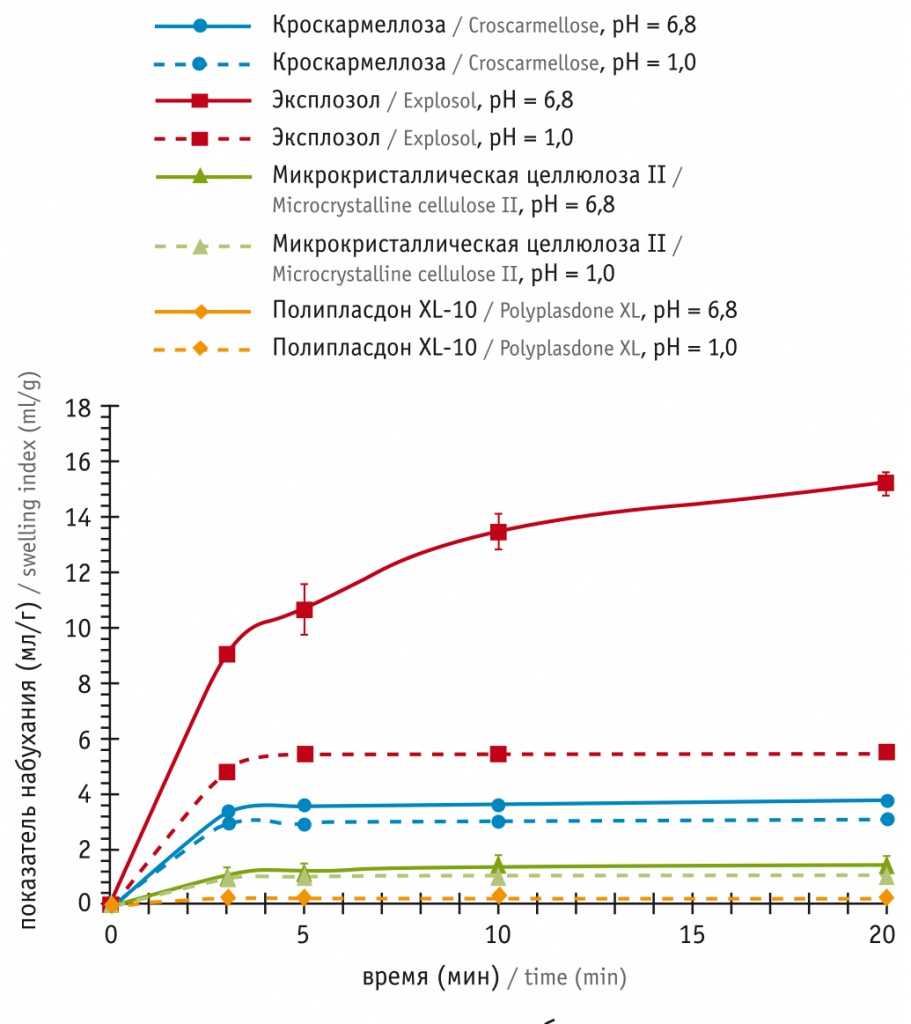
Сочетание разных дезинтегрантов, например крахмала и НКГ, реализованное в ЛП Найз, позволяет получать важные результаты: хороший капиллярный эффект и быстрое поступление жидкости внутрь таблетки осуществляются за счет действия крахмала, дополняются набуханием и стремительным увеличением объема за счет НКГ. Так, в одном из экспериментальных исследований показано, что его объем увеличивался в 100 раз![11]. Быстро сорбируя значительный объем жидкости, супердезинтегрант как бы изнутри «взрывает» таблетку, расширяя содержимое во всех направлениях, обеспечивая так называемый 3D-эффект[12, 13].
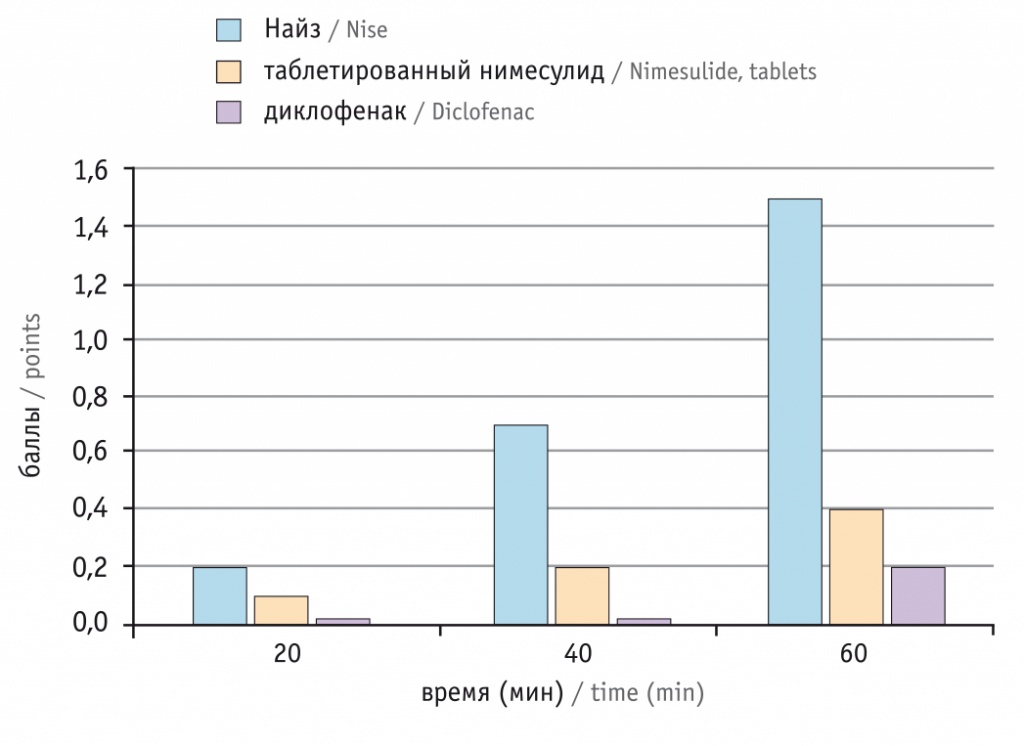
Технологические особенности подготовки лекарственной формы влияют на клинический эффект. Более быстрое анальгетическое действие Найза в сравнении с таковым другой таблетированной формы дженерика нимесулида и натрия диклофенака показано в клиническом исследовании[15], в котором обезболивающий эффект Найза (100 мг/прием) наступал уже через 20 мин, эффекты других таблетированных генериков нимесулида (100 мг/прием) и натрия диклофенака (150 мг/сут) проявлялись позже (рис. 3).
Рис. 3. Динамика боли в течение первого часа после приема нестероидных противовоспалительных препаратов[15]
Эффект нимесулида по подавлению гипералгезии превосходит таковой рофекоксиба при приблизительно равной эффективности с диклофенаком и целекоксибом, однако лишь у нимесулида действие развивается столь быстро[16].
Исследования, доказывающие уменьшение гипералгезии, позволили выявить, что, помимо быстрого подавления выработки нимесулидом ЦОГ-2, также ингибируется NO-синтаза, которая напрямую участвует в механизмах передачи болевых импульсов[17]. В эксперименте показано, что нимесулид превосходит по своей эффективности как парацетамол, так и трамадол, а также их комбинацию в подавлении синтеза ФНО-α и ПГ Е2 в спинномозговой жидкости на фоне воспалительной гипералгезии[18]. Быстрый анальгетический эффект при приеме нимесулида (в течение первых 15 мин) отмечен и у здоровых добровольцев в исследовании ноцицептивной трансмиссии[19].
ЦОГ-НЕЗАВИСИМЫЕ ЭФФЕКТЫ НИМЕСУЛИДА
Как указывалось выше, философия купирования боли в последние годы претерпевает эволюцию, связанную с нахождением новых механизмов развития и хронизации болевого синдрома, воздействием на нейропатический компонент боли, на механизмы передачи и восприятия болевого сигнала, на цитокиновую агрессию в очаге воспаления и т. п.[1, 3, 20, 21]. В связи с этим оказываются крайне востребованными дополнительные, в том числе описанные не так давно, эффекты нимесулида, уникальные именно для этой молекулы[22].
Например, нимесулид уменьшает синтез провоспалительных цитокинов, в их числе ФНО-α[18], ИЛ-6 и ИЛ-8[23], и лейкотриена В4[2, 24], снижает уровень алгогенной субстанции Р[23], а за счет снижения синтеза фосфодиэстеразы IV он уменьшает активность макрофагов и нейтрофильных гранулоцитов, играющих ключевую роль в патогенезе острой воспалительной реакции[25, 26].
Кроме того, нимесулид ингибирует продукцию реактивных кислородных радикалов и лейкотриена С4, продуцируемого эозинофилами[22, 24, 27]. Изученный спектр молекулярных механизмов нимесулида включает влияние и на циклический АМФ и экто-5'-нуклеотидаза/аденозиновый рецептор A2A, и на саму продукцию аденозина, что имеет значение в реализации его противовоспалительного действия[28, 29].
Противовоспалительные эффекты препарата также ассоциированы с повышением чувствительности к эндо- и экзогенным кортикостероидам стероидных рецепторов[30]. Нимесулид ингибирует секрецию гистамина тучными клетками, связанную как с иммунными, так и с неиммунными стимулами, что облегчает болевой синдром[6, 7, 31, 32]. Этот уникальный эффект нимесулида очень важен при оценке рисков поражения ЖКТ, ведь спектр действия гистамина чрезвычайно широк, в том числе в верхних отделах ЖКТ, и влияние на его продукцию может иметь дополнительное значение[33].
В эксперименте показано, что нимесулид уменьшал стимулированную гистамином секрецию соляной кислоты в желудке опытных животных[34]. Хотя эти данные не проясняют механизм ингибирования, подобная возможность может объяснить хорошую переносимость нимесулида у людей.
Исследование, посвященное поиску и оценке средств с гастропротективными свойствами (extract Rumex patientia L.), обнаружило, что введение нимесулида даже в очень больших дозах (300 мг/кг) не приводило к формированию НПВП-индуцированных эрозий и язв у экспериментальных животных, в отличие от других НПВП[33, 35].
Дальнейшие исследования этой группы (H. Süleyman и соавт., 2007) выявили, что на экспериментальных моделях нимесулид значимо усиливает противовоспалительное действие диклофенака, ибупрофена и мелоксикама, но при этом уменьшает ульцерогенное действие диклофенака и мелоксикама, предотвращая возникновение язвенных дефектов[34, 36].
ЗАКЛЮЧЕНИЕ
К преимуществам анальгетика Найза (нимесулида) относятся высокая биодоступность, сильное и быстрое обезболивание, хорошее проникновение в синовиальную жидкость, мощный противовоспалительный эффект, низкая частота побочных эффектов. Высокая скорость реализации анальгетического воздействия при использовании Найза связана с так называемым 3D-эффектом, который заключается в быстрой дезинтеграции таблетки.
Существенную роль в быстром и продолжительном анальгетическом влиянии нимесулида играет широкий спектр свойств, не связанных с ингибированием ЦОГ-2. Исследования вновь выявленных эффектов нимесулида продолжаются, что открывает все более широкие перспективы применения этого лекарственного препарата как в неврологической, так и в терапевтической практике[2, 6, 9, 37, 38].
Поступила: 26.05.2020
Принята к публикации: 16.06.2020








