Церебральные сосудистые мальформации представляют собой группу сосудистых поражений с различными гемодинамическими или структурными свойствами. Сосудистые аномалии ЦНС можно разделить на две категории: мальформации со скоростным кровотоком, такие как аневризмы, артериовенозные мальформации, и мальформации с низким кровотоком, представленные капиллярными телеангиоэктазиями, кавернозными ангиомами и венозными аномалиями развития (ВАР).
Аневризмы — аномальные мешковидные выпячивания артерий головного мозга. Артериовенозные мальформации — скопления аномальных артерий и вен с повышенным риском внутричерепного кровотечения, чаще встречаются у молодых людей [1]. Капиллярные телеангиоэктазии — расширенные тонкостенные капилляры вследствие отсутствия гладких мышц или эластических волокон. Кавернозные ангиомы — скопление сосудистых полостей, разделенных между собой общими для нескольких соседних полостей соединительнотканными перегородками, выстланными эндотелием, при этом вещество мозга и элементы мягкой мозговой оболочки между отдельными сосудистыми полостями отсутствуют [2].
ВАР, ранее известные как венозные ангиомы, встречаются в популяции в 2,5–3% случаев и составляют 60% от всех сосудистых аномалий развития нервной системы [3]. Этот самый частый вид сосудистой аномалии головного мозга является результатом действия компенсаторных механизмов эмбриологического недоразвития или окклюзии медуллярных вен [4]. Термин «венозная аномалия развития» (developmental venous anomaly) вместо «венозной ангиомы» был предложен P. Lasjaunias в 1986 году и получил широкое распространение потому, что лучше отражает характер аномалии [5].
СТРОЕНИЕ И ГИСТОЛОГИЯ
Определяющей характеристикой ВАР является слияние радиально ориентированных вен в единую расширенную дренажную центральную вену (рис. 1) [4].
Рис. 1. Схема венозной аномалии развития, состоящей из расширенных глубоких медуллярных вен. 1 — верхний сагиттальный синус, 2 — венозная аномалия развития, 3 — внутрикортикальная вена, 4 — поверхностная медуллярная вена, 5 — зона 1 (соединение бамбуковых ветвей) глубокой медуллярной вены, 6 — зона 2 (зона канделябров) глубокой медуллярной вены, 7 — зона 3 (пальчатая зона) глубокой медуллярной вены, 8 — зона 4 (субэпендимальная зона) глубокой медуллярной вены, 9 — трансцеребральная вена, 10 — продольная хвостатая вена [4]
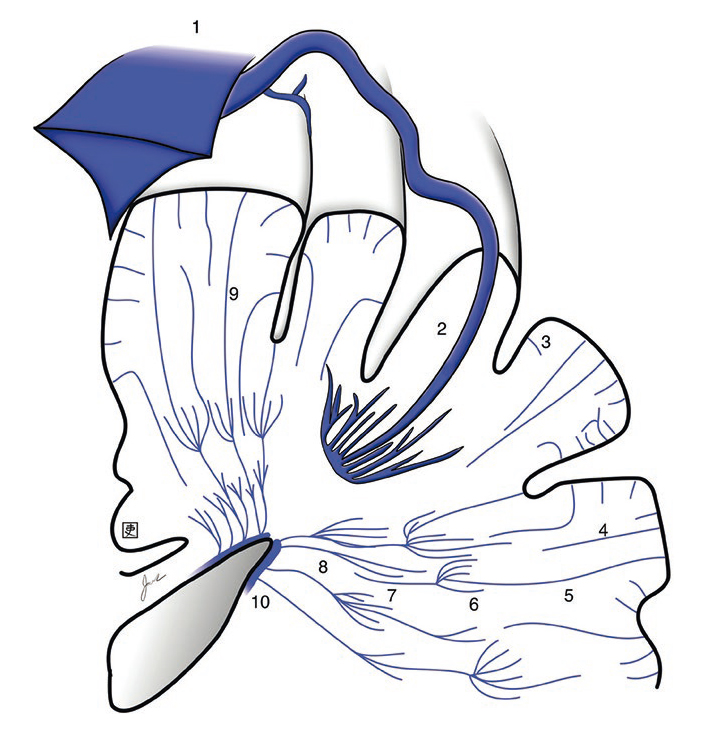
Гистологически ВАР характеризуется расширенной крупной веной с толстыми стенками без эластичной пластинки и гладкомышечного слоя и тонкостенных мелких вен, рассредоточенных в нормальной паренхиме головного мозга [6]. Перифокально в веществе головного мозга могут определяться признаки ишемии или отложения гемосидерина. При нейровизуализации видны линейный широкий сосуд и множественные мелкие радиально расположенные вены, имеющие вид «головы медузы» или «зонтика» [7].
Исходя из расположения и особенностей дренажной вены, X.G. Yu и соавт. (2016) классифицировали симптоматические ВАР на шесть различных типов.
Тип A: располагаются в полушарии головного мозга и дренируются в поверхностную корковую вену или синус твердой мозговой оболочки.
Тип B: располагаются в полушарии головного мозга и дренируются во внутренние вены головного мозга.
Тип C: располагаются в полушарии головного мозга и дренируются в субэпендимальную вену.
Тип D: располагаются в мозжечке.
Тип E: располагаются в стволе мозга.
Тип F: располагаются подкожно или в области околоносовой пазухи [8].
ВАР могут быть связаны с другими сосудистыми патологиями, такими как кавернозная мальформация, артериовенозная мальформация, фокальная кортикальная дисплазия, или являться изолированным поражением [9].
В подавляющем большинстве случаев ВАР обнаруживаются случайно во время диагностической нейровизуализации и считаются доброкачественным бессимптомным поражением, не требующим вмешательства. Однако геморрагическая трансформация и ишемические осложнения из-за окклюзии центральной вены — хорошо известные явления. Некоторые исследования также указывают на возможную роль ВАР в формировании кавернозных мальформаций [10].
ПАТОГЕНЕЗ ЭПИЛЕПТИЧЕСКИХ ПРИСТУПОВ ПРИ СОСУДИСТЫХ АНОМАЛИЯХ
Эпилепсия — это заболевание головного мозга, отвечающее следующим критериям: 1) не менее двух неспровоцированных (или рефлекторных) эпилептических приступов с интервалом более 24 часов; 2) один неспровоцированный (или рефлекторный) приступ и вероятность повторения приступов, близкая к общему риску рецидива (≥ 60%) после двух спонтанных приступов, в последующие 10 лет; 3) диагноз эпилептического синдрома [11]. Чрезмерная нейрональная активность является основной мишенью используемых в настоящее время антиэпилептических препаратов (АЭП). Однако у 30% пациентов эпилептические приступы фармакорезистентны к доступным в настоящее время АЭП, и это предполагает, что эпилепсия может быть связана не только с нейронными клетками, но и с другими клетками головного мозга [12].
Астроциты, перициты и эндотелиальные клетки составляют гематоэнцефалический барьер (ГЭБ), который регулирует обмен веществ между паренхимой головного мозга и циркулирующей кровью [13]. Высказано предположение, что дисфункция ГЭБ усугубляет прогрессирование эпилепсии и, наоборот, эпилептические приступы вызывают дисфункцию ГЭБ [14]. Кроме того, в нескольких исследованиях показано, что дисфункция ГЭБ становится одной из основных причин фармакорезистентности эпилепсии [12–16].
В настоящее время активно обсуждается взаимосвязь между эпилепсией и сосудистыми аномалиями головного мозга. Известно, что сосудистые мальформации, такие как кавернозные ангиомы, артериовенозные мальформации и аневризмы, вносят вклад в появление эпилептических приступов. Вероятными механизмами формирования эпилепсии в таком случае могут являться дисфункция ГЭБ и чрезмерный ангиогенез.
Поскольку сосудистые мальформации вызываются фактором роста эндотелия сосудов (ФРЭС) в ишемическом мозге, рассматривается возможная роль ФРЭС в сосудистых аномалиях в эпилептическом мозге [15]. Глиальные и эндотелиальные клетки экспрессируют рецепторы ФРЭС. Таким образом, на эти клетки, вероятно, влияет увеличение экспрессии ФРЭС во время судорог, что, в свою очередь, может привести к развитию сосудистых аномалий [16].
СВЯЗЬ ВЕНОЗНЫХ АНОМАЛИЙ РАЗВИТИЯ С ЭПИЛЕПСИЕЙ
C. Dussaule и соавт. (2017) сообщили о 4 пациентах с ВАР, ассоциированными с эпилептическими приступами. У одной пациентки случился эпилептический приступ из-за кровоизлияния в области ВАР. У второго больного обнаружена ВАР в левой височно-теменной области рядом с поражением, характерным для последствий венозного инфаркта. У двух других пациентов выявлена изолированная и неосложненная ВАР, ассоциированная с иктальным фокусом эпилептиформной активности, по данным ЭЭГ-видеомониторинга [9].
По данным других литературных источников, найден 21 опубликованный клинический случай эпилептических приступов, вызванных осложнениями ВАР, и 9 клинических случаев, в которых возможна прямая связь между эпилепсией и изолированной неосложненной ВАР [3, 4, 6–8]. Эпилептические приступы ассоциированные с ВАР, преимущественно связаны с наличием эпилептогенного поражения, такого как кавернозная мальформация, дисплазия или осложнения в области ВАР. Прежде чем сделать вывод о том, что эпилептический приступ ассоциирован ВАР, необходимо провести нейровизуализацию для выявления осложнений ВАР. Однако остаются неясными причины, по которым изолированные неосложненные ВАР могут вызывать эпилептические приступы [4, 9, 17].
Существует и другое мнение исследователей о естественной истории ВАР и связанных с ней клинических симптомах. Считается, что на основании данных МРТ различные клинические симптомы приписывались ВАР и большинство кровоизлияний на самом деле связаны с ассоциированными кавернозными мальформациями, а не с ВАР как таковой [18]. Эпилепсия возникает из-за наличия ассоциированной корковой дисплазии и других не связанных с ВАР поражений [19].
ВАР редко вызывает такие симптомы, как кровотечение, эпилептические приступы, гемифациальный спазм, невралгию тройничного нерва, инфаркт тканей головного мозга и тромбоз дренирующей вены. ВАР — доброкачественная сосудистая патология, и если есть внутримозговая (например, кавернозная мальформация или атрофия гиппокампа, вызывающая эпилептические приступы) или любая другая неврологическая патология, связанная с ВАР, в первую очередь нужно сосредоточиться на основном заболевании, а не на ВАР, сохраняя возможный дифференциальный диагноз [18].
ВОЗМОЖНЫЕ МЕХАНИЗМЫ ФОРМИРОВАНИЯ ЭПИЛЕПТИЧЕСКИХ ПРИСТУПОВ У ПАЦИЕНТОВ С ВЕНОЗНЫМИ АНОМАЛИЯМИ РАЗВИТИЯ
Проведенный нами качественный анализ метаболической нейровизуализации, по данным позитронно-эмиссионной томографии головного мозга, у 22 пациентов с ВАР показал, что в паренхиме головного мозга более чем у двух третей пациентов регистрировался корковый гипометаболизм, ассоциированный с ВАР[20]. Это доказывает высокую вероятность того, что метаболическая активность в паренхиме мозга в области ВАР не является абсолютно нормальной. Данное открытие ставит под сомнение традиционное понимание клинической незначимости ВАР и отсутствия влияния на прилегающую паренхиму головного мозга (рис. 2) [20].
Рис. 2. Позитронно-эмиссионная и магнитно-резонансная томограммы головного мозга, демонстрирующие венозные аномалии развития (ВАР) и связанную с ними метаболическую активность.
Примечание. Случаи 1A (белая стрелка) и 1B (желтая стрелка) не показывают аномальный метаболизм в отношении контралатерального полушария головного мозга. Случай 2 демонстрирует умеренный гипометаболизм в передних отделах правой лобной доли, соответствующей области, дренированной ВАР. Случай 3 — умеренный гипометаболизм в задних отделах левой лобной доли, ассоциированный с ВАР. Случай 4 показывает выраженный гипометаболизм, распределенный по правым лобным и теменным долям и затрагивающий как корковое, так и глубокое серое вещество в области ВАР. Зеленая стрелка в случае 4 указывает на атрофию [20]
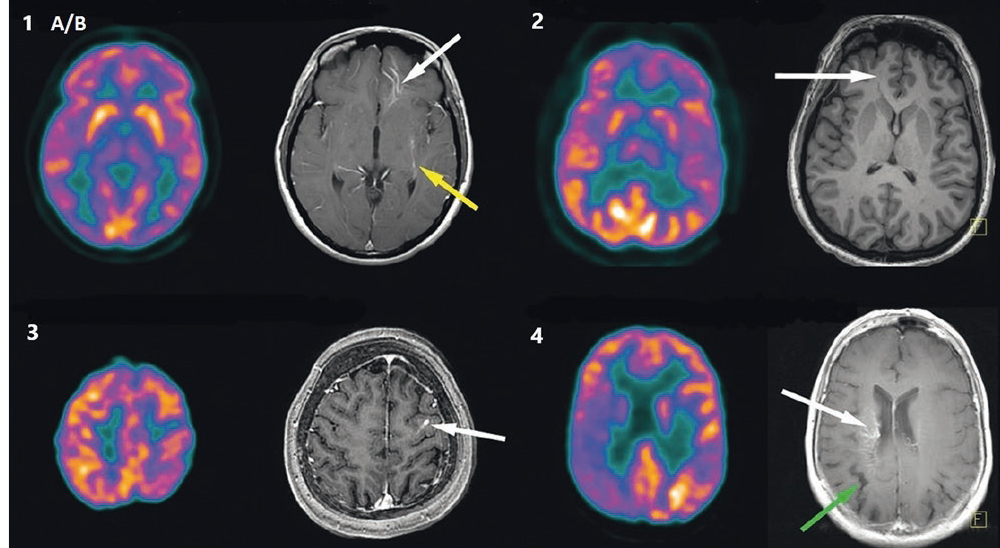
Этиология гипометаболизма в паренхиме головного мозга, дренируемой ВАР, неясна и может отражать внутреннюю, вероятно, связанную с внутриутробным развитием нейрональную аномалию или приобретенную аномалию, вторичную по отношению к нарушению кровотока. Наблюдалась связь между степенью гипометаболизма, ассоциированного с ВАР, и увеличением возраста пациента. Предполагается, что ВАР приводит к кумулятивному повреждению паренхимы головного мозга [21].
ВАР регистрируются у пациентов любого возраста. Однако оценка рисков развития неврологических проявлений в разных возрастных группах является сложной задачей, поскольку прогрессирование аномалий головного мозга и связанных с ними симптомов может быть очень медленным. Пациенты с измененной интенсивностью сигнала паренхимы головного мозга в области ВАР были значительно старше, чем больные, не имевшие измененного интенсивного сигнала [20].
У пациентов с ВАР зарегистрирована более высокая частота эпилепсии по сравнению с таковой среди населения в целом [8, 18, 19, 21, 22], что может быть обусловлено наличием коркового гипометаболизма, связанного с ВАР [21, 23].
Основываясь на характеристиках нейровизуализации и клинических симптомах у 68 пациентов с отчетливыми клиническими проявлениями сосудистых осложнений ВАР, можно выделить две основные группы предполагаемых патофизиологических механизмов: механические и связанные с потоком. Осложнения, при которых не был идентифицирован патомеханизм, сгруппировали отдельно как идиопатические или спонтанные. Механические осложнения могут привести к гидроцефалии либо к вазоневральным конфликтам. Механизмы, ассоциированные с потоком, подразделяются на связанные с увеличением венозного притока или с препятствием оттока в ВАР [24].
C. Dussaule и соавт. (2017) предложили следующую классификацию эпилепсии у пациентов с ВАР:
-
ассоциация ВАР с эпилепсией за счет локальных осложнений;
-
вероятная прямая связь между эпилепсией и неосложненной ВАР на основе регистрации иктальной ЭЭГ, соответствующей местоположению ВАР, по данным МРТ;
-
вероятная прямая связь между эпилепсией и неосложненной ВАР на основе регистрации интериктальной эпилептиформной активности, соответствующей расположению ВАР;
-
возможная прямая связь только на основании клинических данных и локализации ВАР;
-
нет связи между эпилепсией и ВАР, или клинико-патологическая корреляция неточна [9].
На основании доказанного случая прямой связи между эпилептическими приступами и ВАР K. Aghayev (2020) модифицировал данную классификацию и предложил еще одну категорию: «безусловная ассоциация неосложненной ВАР с эпилепсией» [25].
ЛЕЧЕНИЕ ЭПИЛЕПТИЧЕСКИХ ПРИСТУПОВ У ПАЦИЕНТОВ С ВЕНОЗНЫМИ АНОМАЛИЯМИ РАЗВИТИЯ
Паренхиматозная аномалия, фокальная корковая дисплазия, кавернозная мальформация и кровоизлияние часто сопровождают ВАР, данные поражения являются хорошо известными этиологическими причинами эпилепсии, и хирургическое лечение обычно направлено на устранение сопутствующей патологии, а не самой ВАР [26]. Тактика лечения ВАР, ассоциированных с эпилептическими приступами, очень спорна. Хирургическая или эндоваскулярная облитерация ВАР несет весомый риск серьезных осложнений.
Мнения исследователей разделились: некоторые авторы выступают за консервативное лечение эпилептических приступов с помощью средств антиэпилептической терапии [24]. Другие авторы не считают ВАР безобидным поражением и выступают за хирургическую резекцию при симптоматическом течении [6, 25].
M. Abe и соавт. (2003) сообщили о серии из 7 хирургических операций по удалению ВАР. Хирургическое удаление привело к устранению эпилептических приступов. В послеоперационном периоде не было осложнений, и наличие ВАР подтвердилось гистологическим исследованием. В этих случаях ангиография не показала аномалий из-за выраженных кальцинированных повреждений, что указывает на возникновение эпилепсии в связи с кортикальной недостаточностью [6].
K. Aghayev (2020) описал первый клинический случай неосложненной ВАР, которая послужила причиной развития фармакорезистентных эпилептических приступов у пациента. После резекции ВАР без удаления паренхимы головного мозга у больного регистрируется длительная ремиссия эпилепсии [25].
ЗАКЛЮЧЕНИЕ
В настоящее время дискутабельной остается взаимосвязь эпилептических приступов с неосложненными венозными аномалиями развития (ВАР). К ведущим механизмам возникновения эпилептических приступов при ВАР относят корковый гипометаболизм, развивающийся с возрастом у пациентов, а также дисфункцию гематоэнцефалического барьера, которая может приводить к формированию фармакорезистентной эпилепсии. Однако эти данные носят противоречивый характер и требуют дальнейшего изучения.
Поступила: 24.03.2021
Принята к публикации: 30.06.2021








