Частота встречаемости АИГ варьирует среди разных слоев населения [18]. В Европе и США его распространенность составляет от 3 до 17 случаев, а ежегодная заболеваемость — от 0,1 до 1,9 случая на 100 000 населения [2]. В Канаде среди детей ежегодная заболеваемость равна 0,23 на 100 000 [16].
В России в структуре хронических гепатитов у детей АИГ составляет 2% [2, 3]. Среди детей чаще болеют девочки [9, 15] и дебют заболевания приходится на 6–10 лет [8].
В качестве факторов, способствующих возникновению заболевания, могут выступать вирусные и бактериальные возбудители, которые при наличии иммунологической предрасположенности (HLA) приводят к нарушению иммунологической толерантности и развитию аутоиммунного процесса [4, 5].
При исследовании сыворотки крови у больных выявляют антинуклеарные антитела (англ. antinuclear antibody — ANA), антигладкомышечные антитела (англ. smooth muscle antibo-dy — SMA), антитела к микросомам клеток печени и эпителиальных клеток клубочкового аппарата почек типа 1 (англ. liver kidney microsomal type 1 antibody), антитела к растворимому печеночному антигену (англ. anti-soluble liver antigen) [13, 17].
При отсутствии лечения заболевание приводит к развитию цирроза печени уже в первые годы от начала заболевания [1, 12].
Единственным фактором, сдерживающим прогрессирование аутоиммунного воспаления, является комбинированная иммуносупрессивная терапия [10, 20].
Учитывая, что при АИГ нередки внепеченочные признаки иммунных нарушений (аутоиммунный тиреоидит, неспецифический язвенный колит, витилиго, сахарный диабет и др.) [2, 11], необходимо проводить их раннюю диагностику для оптимизации лечения. В частности, при аутоиммунном полигландулярном синдроме (АПС) частота поражения печени составляет 13–20% [6, 7].
Выделяют несколько типов АПС. Признаком АПС 1-го и 2-го типов (АПС-1, -2) является надпочечниковая недостаточность. АПС-1 — это моногенное заболевание с аутосомно-рецессивным типом наследования [19], которое начинает проявлять себя уже в детском возрасте. В России у лиц с АПС-1 наиболее часто встречается мутация R257X в 6-м экзоне гена, кодирующего белок — аутоиммунный регулятор (AIRE) [6].
АПС-1 диагностируют при наличии двух из трех основных симптомов: хронический кожно-слизистый кандидоз, гипопаратиреоз, хроническая первичная надпочечниковая недостаточность. Если имеются родственники первого ряда с установленным диагнозом или с симптомами АПС-1, достаточно одного из трех основных признаков [7].
Кроме того, частыми проявлениями АПС-1 являются АИГ, алопеция, синдром мальабсорбции, пернициозная анемия, сахарный диабет, гипогонадизм, аутоиммунный тиреоидит, витилиго, кератоконъюнктивит. Среди ранних проявлений АПС могут быть также уртикарные высыпания, гипоплазия зубной эмали, дисфункция кишечника [14].
Цель исследования: проведение оценки дебюта АИГ, являющегося одним из проявлений АПС, и дебюта АИГ, протекающего как самостоятельное заболевание.
МАТЕРИАЛЫ И МЕТОДЫ
В Университетской детской клинической больнице (УДКБ) ФГАОУ ВО «Первый Московский государственный медицинский университет им. И. М. Сеченова» Минздрава России (Сеченовский Университет) с 1993 по 2014 г. наблюдались 25 детей с диагнозом АИГ. Из них у 22 человек (16 девочек и 6 мальчиков) АИГ протекал как самостоятельное заболевание (первая группа), а у троих детей (одной девочки и двух мальчиков) — на фоне АПС (вторая группа). На момент первой госпитализации в УДКБ возраст детей в первой группе составлял от 5 до 15 лет, во второй — от 4 до 7 лет.
Всем детям обеих групп проводили клинико-лабораторное обследование, включавшее, в частности, общий анализ крови и мочи, биохимический анализ крови, УЗИ органов брюшной полости, эзофагогастродуоденоскопию (ЭГДС).
Содержание иммуноглобулинов классов А, М, G оценивали методом радиальной иммунодиффузии по Манчини; ANA и SMA — методом иммунофлюоресценции. Маркеры вирусных гепатитов А, В и С (HAV, HBV, HCV), а именно анти-HAV IgM, HBsAg, анти-HBc IgM и суммарные анти-HCV, определяли посредством иммуноферментного анализа; ДНК HBV и РНК HCV — методом полимеразной цепной реакции.
Детям второй группы выполнялись гормональное исследование крови (на кортизол, Т4св., ТТГ, интактный ПТГ, АКТГ, антитела к тиреоглобулину и к тиреоидной пероксидазе) и генетическое исследование крови. При проведении последнего в Медико-генетическом научном центре у всех троих были выявлены мутации R257X в гене AIRF. Пациенты были проконсультированы в Эндокринологическом научном центре Минздрава России, где им установили диагноз АПС-1.
Пункционная биопсия выполнена 20 детям (18 — из первой группы и двоим — из второй), в 12 случаях морфологическое исследование материала осуществлено в лаборатории патоморфологии Сеченовского Университета с использованием качественных характеристик. Биопсийный материал, взятый у 10 детей, исследован также с применением полуколичественного анализа — был определен индекс гистологической активности (индекс Кноделля). Одному ребенку проведена фиброэластография в Университетской клинической больнице № 2 Сеченовского Университета.
Статистическая обработка проводилась с учетом точного критерия Фишера (P). Различия считали статистически значимыми при p ˂ 0,05.
РЕЗУЛЬТАТЫ
Достоверных различий по возрасту дебюта патологического процесса у детей первой и второй групп не найдено (табл. 1).
Таблица 1
Клинико-лабораторные признаки аутоиммунного гепатита, протекавшего как самостоятельное заболевание (группа I), и аутоиммунного гепатита, являвшегося проявлением аутоиммунного полигландулярного синдрома (группа II)
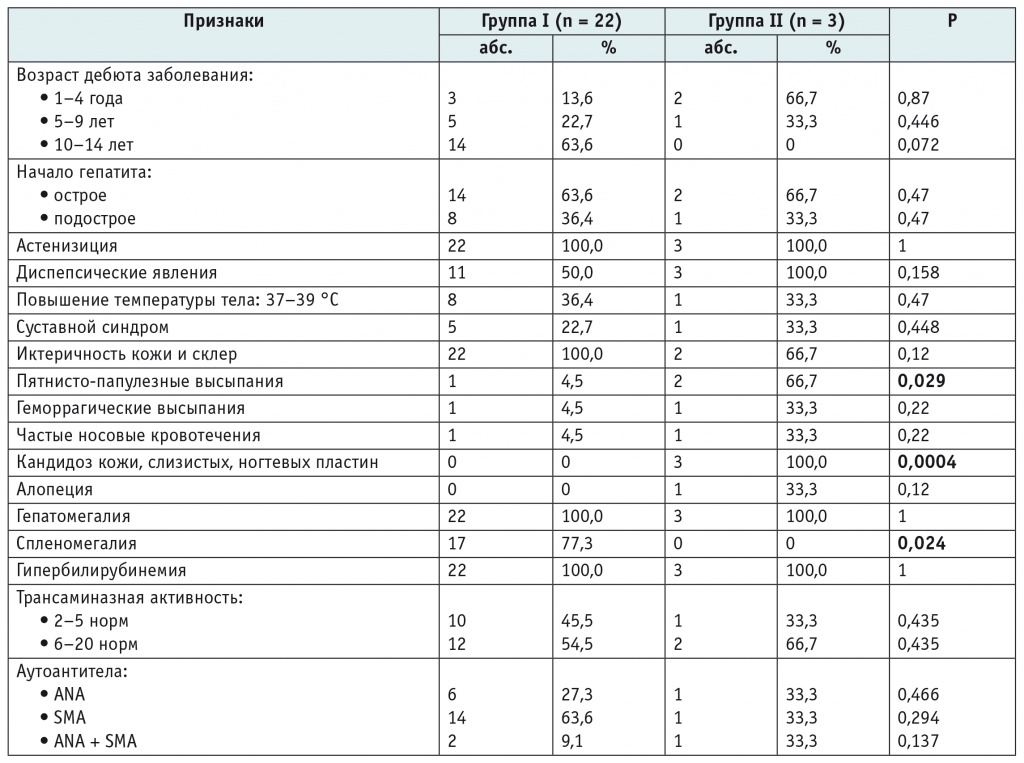
Примечание. ANA — антинуклеарные антитела; SMA — антигладкомышечные антитела.
У 9 пациентов обеих групп отмечали подострое начало АИГ, а у 16 детей дебют заболевания приближался к картине острого вирусного гепатита. На первый план выступали астенизация (у всех 25 детей), диспепсические явления (у половины больных), лихорадка от 37 до 39 °С (у трети пациентов). У подавляющего большинства больных обеих групп при первичном обращении по месту жительства были выявлены желтушность кожи и склер, у всех — увеличение печени. У большинства детей первой группы отмечалась спленомегалия по данным пальпации, у детей второй группы увеличение селезенки пальпаторно не определялось.
За несколько месяцев до дебюта заболевания в обеих группах начинали проявляться суставной синдром (6 больных), мелкоточечная пятнисто-папулезная и геморрагическая сыпь, носовые кровотечения. У одной пациентки из первой группы были микрогематурия, артериальная гипертензия, отеки (параорбитальные и на ногах).
Среди детей второй группы у одного мальчика в раннем анамнезе обращали на себя внимание частые вирусные инфекции, аллергические высыпания, запоры. В двухлетнем возрасте у него появились рвота, иктеричность кожи и склер, увеличение печени. Гипокортицизм был выявлен почти через год от начала АИГ.
У другого мальчика второй группы с первых месяцев жизни наблюдались кандидоз, ангулит, он часто болел пневмониями (1–2 раза в год), повторными токсикоинфекциями, позже присоединились частые носовые кровотечения. В возрасте 4 лет появились симптомы гепатита. В 5 лет у ребенка возник эпизод судорог с потерей сознания. Диагностирована надпочечниковая недостаточность.
Девочка из второй группы заболела в возрасте 5 лет, когда появились лихорадка, аллергические высыпания, артрит коленных и межфаланговых суставов кистей. При УЗИ коленных суставов выявляли утолщение кортикального слоя, узурации, гиперэхогенные включения. Больная наблюдалась по месту жительства с диагнозом «ювенильный ревматоидный артрит, аллергосептический вариант, активность III степени». Повышение уровня трансаминаз было обнаружено через 6 месяцев, а АПС диагностирован через 2 года от начала артрита.
При обследовании по месту жительства у больных обеих групп выявляли цитолитическую активность выше двух норм, причем у половины детей содержание трансаминаз составляло от 6 до 20 норм. Маркеры гепатитов В и С у всех больных были отрицательными.
Все госпитализированные по месту жительства дети получали инфузионную и симптоматическую терапию. К моменту госпитализации в УДКБ Сеченовского Университета 14 больных первой группы и двое — второй получали преднизолон, один мальчик из второй группы — гидрокортизон и флудрокортизон.
У 9 детей обеих групп лечение было нерегулярным, что приводило к нарастанию выраженности клинико-лабораторных изменений. Продолжительность заболевания к моменту поступления в УДКБ составляла от 1 месяца до 4 лет (в среднем 1 год 3 месяца).
При поступлении у больных обеих групп отмечались слабость, снижение аппетита, тошнота.
В первой группе у половины девочек пубертатного возраста наблюдались дисменорея и аменорея, а у одного мальчика — гинекомастия, у 13 детей были телеангиэктазии на лице и кистях. У больных обеих групп обнаруживали иктеричность кожи и склер, гепатомегалию. У всех детей второй группы при осмотре были выявлены признаки кожно-слизистого кандидоза.
При обследовании у всех 25 детей констатировано повышение СОЭ. Снижение гемоглобина имело место у половины больных. В обеих группах сохранялись гипербилирубинемия, цитолитическая активность, диспротеинемия.
У всех больных были выявлены аутоантитела в диагностических титрах. В первой группе SMA обнаружены у 14 детей, ANA — у 6 пациентов, сочетание SMA и ANA было у 2 больных. Во второй группе у одного мальчика определялись SMA, у другого было сочетание ANA и SMA, у девочки присутствовали ANA.
При УЗИ у детей обеих групп отмечались увеличение размеров печени от 1,5 до 5 см, диффузное уплотнение паренхимы разной степени выраженности. Увеличение размеров селезенки от 1 до 5 см обнаружено у 17 больных первой группы.
По данным пункционной биопсии печени, проведенной 18 детям первой группы, у всех обследованных выявлены признаки хронического гепатита разной степени активности. Морфологические признаки цирроза печени имелись у 16 больных: у 7 активность гепатита была высокой, у 4 — умеренной и у 5 — минимальной. У большинства детей морфологические признаки цирроза печени были обнаружены уже на первом или втором году заболевания.
Во второй группе биопсия печени была проведена у двух мальчиков. У одного из них результаты морфологического исследования свидетельствовали об АИГ умеренной степени активности, у другого были выявлены хронический гепатит высокой степени активности, монолобулярный цирроз печени со стромальной и паренхиматозной активностью. Взятие материала для морфологического исследования проводилось через 1,5 года от манифестации заболевания в первом наблюдении и через 6 месяцев — во втором.
Девочке из второй группы биопсия печени не проводилась. По данным фиброэластографии, выполненной через 4 года от дебюта заболевания, у нее выявлена стадия F1 фиброза печени по шкале METAVIR.
В результате проведенного обследования у всех детей обеих групп был диагностирован АИГ.
У больных второй группы АИГ протекал на фоне АПС (генетически подтвержденного). Помимо АИГ, наиболее частыми проявлениями АПС являлись хронический кожно-слизистый кандидоз, хроническая надпочечниковая недостаточность, энтеропатия (табл. 2).
Таблица 2
Проявления аутоиммунного полигландулярного синдрома 1-го типа
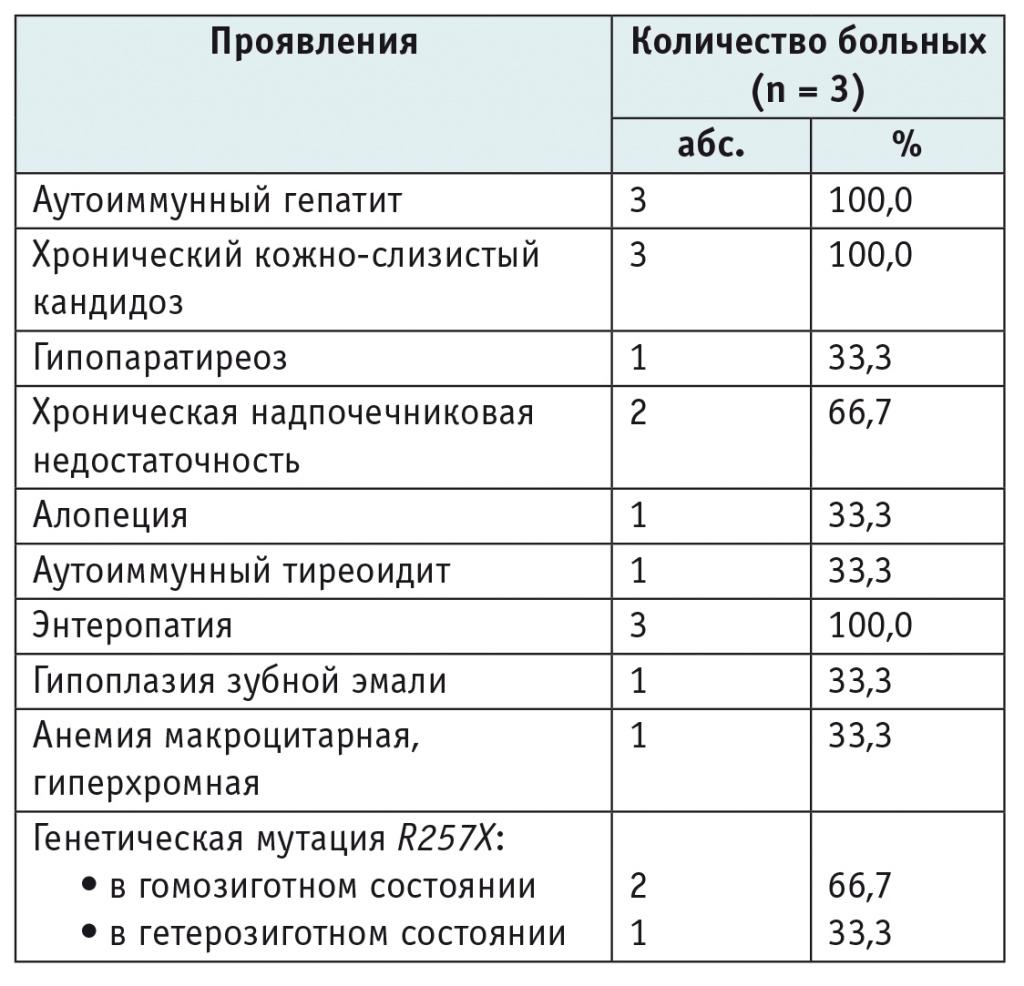
Кроме того, обращали на себя внимание аллергические реакции, частые и тяжело протекавшие вирусные инфекции в анамнезе, у одной девочки — артрит. Алопеция и анемия были более поздними проявлениями заболевания.
Патогенетическая и заместительная терапия всем детям обеих групп проводилась в соответствии с возрастными дозировками с переходом на поддерживающие дозы после улучшения клинико-лабораторных показателей, которое обычно наступало через 1,5 месяца после начала терапии.
В первой группы всем больным назначали преднизолон. Азатиоприн получали 19 детей (трое больных не принимали этот препарат из-за индивидуальной непереносимости).
Девочка из второй группы в связи с диагнозом «аутоиммунный гепатит, фиброз печени I степени, аутоиммунный полигландулярный синдром 1-го типа» получала преднизолон и азатиоприн. У одного из мальчиков второй группы по поводу диагноза «аутоиммунный гепатит, умеренная активность; аутоиммунный полиэндокринный синдром 1-го типа» применялись гидрокортизон и флудрокортизон. Другой мальчик получал флудрокортизон и преднизолон в связи с диагнозом «аутоиммунный гепатит с переходом в цирроз печени, минимальная активность; аутоиммунный полигландулярный синдром 1-го типа».
ОБСУЖДЕНИЕ
По клиническому течению АИГ у детей обеих групп характеризовался внезапным началом и появлением симптомов, сходных с симптомами острого гепатита. Такие признаки, как астенизация, диспепсические явления, повышение температуры тела, иктеричность кожи и склер, гепатомегалия, гипербилирубинемия, повышенная трансаминазная активность, присутствовали у большинства больных, и достоверных различий в частоте их встречаемости у детей двух групп не было (p > 0,05).
Не обнаружено достоверных различий и в частоте встречаемости суставного синдрома, геморрагических высыпаний и носовых кровотечений (p > 0,05), которые отмечались у небольшого количества больных.
У всех детей обеих групп выявлены печеночно-ассоциированные аутоантитела на фоне отсутствия маркеров вирусных гепатитов, что подтверждало диагноз АИГ.
По тяжести течения дебют АИГ, являвшегося одним из проявлений АПС, был сопоставим с дебютом АИГ, протекавшего как самостоятельное заболевание.
В группе детей с АИГ в качестве одного из проявлений АПС у девочки был диагностирован фиброз стадии F1 и у одного мальчика выявлен цирроз печени, а среди больных с АИГ, протекавшим как самостоятельное заболевание, цирроз печени был обнаружен у 16 из 18 пациентов, которым проводилась биопсия печени (статистическая обработка не выполнена в связи с неоднородностью методов обследования).
У троих детей, вошедших в дальнейшем во вторую группу, ранними признаками АИГ были проявления кожно-слизистого кандидоза, надпочечниковой недостаточности, гипоплазия зубной эмали, энтеропатия, в связи с чем детям было проведено эндокринологическое и генетическое обследование с подтверждением диагноза АПС-1.
ЗАКЛЮЧЕНИЕ
Аутоиммунный гепатит (АИГ) у большинства больных обеих исследованных групп имел прогрессирующее течение с формированием цирроза печени в относительно короткие сроки от начала заболевания. Во второй группе детей АИГ был одним из ведущих проявлений в дебюте полигландулярного синдрома (АПС) и по тяжести не уступал АИГ в качестве самостоятельного заболевания у детей первой группы. Редкая встречаемость, сложность в постановке диагноза и тяжесть течения АПС, а также высокая частота перехода АИГ в цирроз печени, в том числе у больных с АПС, обусловливают необходимость совершенствования ранней диагностики аутоиммунных заболеваний. Практическим врачам необходимо учитывать возможность дебюта АПС с проявлений АИГ.








