ВВЕДЕНИЕ
В отечественных и зарубежных научных публикациях подробно описаны классификация, разнообразие клинических симптомов, принципы лабораторной диагностики и результаты молекулярно-генетических исследований при гипофосфатазии[1–4]. Очевидно, что гипофосфатазия является прогрессирующим наследственным метаболическим заболеванием, вызванным дефицитом щелочной фосфатазы (ЩФ), который возникает из-за мутации в гене ALPL, картированном на 1 хромосоме (1p36.12), кодирующем изофермент тканенеспецифичной ЩФ (ТНЩФ).
Патогенез гипофосфатазии достаточно хорошо изучен. В норме фермент ТНЩФ непосредственно влияет на отщепление фосфатной группы от неорганического пирофосфата, высвобождающийся неорганический фосфат связывается с кальцием, формируя кристаллы гидроксиапатита, необходимые для минерализации костного матрикса. В результате дефицита активности ТНЩФ неорганический пирофосфат не расщепляется и кристаллы гидроксиапатита не образуются, что, безусловно, приводит к нарушению минерализации костной ткани. В свою очередь, накапливающийся в плазме и тканях неорганический пирофосфат соединяется с аморфным фосфатом кальция с образованием кристаллов пирофосфата кальция, это вызывает нефрокальциноз или становится причиной артрита[5].
Еще одной крайне важной функцией ТНЩФ является отщепление фосфора от пиридоксаль-5-фосфата, что делает возможным проникновение пиридоксаля через клеточные мембраны в ЦНС, где происходит повторное присоединение фосфата к пиридоксалю. Вновь образованный пиридоксаль-5-фосфат выступает в роли кофактора многих нейротрансмиттеров, а его дефицит в ЦНС приводит к развитию пиридоксин-зависимых судорог[6].
В зависимости от возраста дебюта гипофосфатазии выделяют перинатальную форму (появление симптомов уже внутриутробно или сразу после рождения); младенческую, или инфантильную (появление симптомов в первые 6 месяцев жизни); детскую и взрослую формы (появление клинических симптомов соответственно до 18 лет и позже). Форма заболевания во многом определяет и тяжесть его течения — от 100% летальной (в отсутствие терапии) перинатальной формы до относительно легкого течения при взрослой форме.
Тяжелые формы гипофосфатазии развиваются, как правило, при наличии гомозиготной или компаунд-гетерозиготной мутации в гене ALPL. ЩФ экспрессируется на поверхности клеток как гомодимер, поэтому некоторые гетерозиготные мутации могут снижать активность всего гомодимера, приводя к доминантно негативному эффекту. Вследствие этого наличие мутации даже в одной аллели может провоцировать развитие заболевания.
У носителей одинаковой мутации в семье возможна различная степень тяжести заболевания, что указывает на наличие модулирующих факторов.
В некоторых случаях гипофосфатазии не удается обнаружить мутации в гене ALPL, поэтому для верификации диагноза ведущими критериями являются клинические признаки заболевания и снижение активности ЩФ ниже нормы для данного возраста и пола[7].
Единственный метод патогенетического лечения гипофосфатазии — пожизненная ферментная заместительная терапия препаратом асфотаза альфа, которая представляет собой человеческий рекомбинантный тканенеспецифический химерный Fc-дека-аспартатный гликопротеин ЩФ. По данным литературы, применение асфотазы альфа при перинатальной форме гипофосфатазии способствует лучшей выживаемости пациентов по сравнению с таковой в группе контроля: 95% против 42% в возрасте 1 года, 84% против 27% в возрасте 5 лет соответственно (р < 0,0001 в модели Каплана — Мейера, оценивающей долю пациентов, проживших какое-либо время после приема некого лекарственного препарата)[7].
Приводим описание клинических случаев гипофосфатазии у детей.
КЛИНИЧЕСКИЙ СЛУЧАЙ 1
Мальчик Ч. переведен из ГБУЗ ТО «Перинатальный центр» (г. Тюмень) в отделение патологии новорожденных ГБУЗ ТО ОКБ № 2 (г. Тюмень) в возрасте 5 дней с диагнозом: Транзиторное тахипноэ у новорожденного. Врожденный порок развития — дефект костей черепа, аплазия теменных и височных костей. Гипофосфатазия? — для верификации диагноза и определения тактики терапии.
Из анамнеза жизни и заболевания известно, что ребенок родился от первых самостоятельных родов в сроке 38,3 недели, в головном предлежании, с оценкой по шкале Апгар 7–7 баллов. При рождении масса тела — 3570 г, длина — 54 см, окружность головы — 35 см, окружность грудной клетки — 34 см.
При УЗИ плода в сроке 29,6 недели диагностирована гипоплазия костей носа. При рождении обращали на себя внимание скелетные диспропорции, укорочение и деформация конечностей; грудная клетка уплощена, отсутствуют кости мозгового черепа (мембранозный череп). Через 2 часа после рождения отмечено тахипноэ, потребовавшее кратковременной респираторной поддержки.
На момент поступления в отделение патологии новорожденных состояние ребенка среднетяжелое, сознание ясное. Конечности укорочены, деформированы за счет внутриутробных переломов трубчатых костей, мембранозный череп, грудная клетка уплощена, обе половины грудной клетки симметрично участвуют в акте дыхания. Респираторных нарушений нет, частота дыхательных движений — 42 в мин. Сатурация кислородом — 98%. Диффузная мышечная гипотония, гипорефлексия, снижена двигательная активность. ЧСС — 148 в мин. Вскармливание грудное, объем питания по возрасту, усваивает.
Наиболее значимые для диагностики заболевания результаты обследования
Уровень фосфора — 2,21 ммоль/л (норма — 1,45–2,16 ммоль/л), кальция общего — 2,36 ммоль/л (норма — 2,2–2,5 ммоль/л), ЩФ — 28 Ед/л (норма — 53–128 Ед/л). Отмечаются стойкое повышение содержания фосфора и снижение уровня ЩФ в динамике, нарастание концентрации кальция в сыворотке до 3,1 ммоль/л, ионизированного кальция — до 1,7 ммоль/л. Содержание паратгормона, витамина D — в пределах референсных интервалов.
Рентгенография костей скелета: лобная кость представлена двумя пластинами, две пластины височных костей, множественные переломы ребер с обеих сторон, перелом грудинной трети правой ключицы без смещения, переломы дистальной и проксимальной третей плечевой, лучевой и локтевой кости справа и слева, переломы проксимального и дистального метаэпифиза обеих костей правой и левой голени. Деформированные седалищные кости, крылья и тело подвздошных костей. Трубчатые кости деформированы, со слабой периостальной костной реакцией, с грубой кистовидной перестройкой структуры. Ростковые зоны костей не определяются (рис. 1).
Рис. 1. Рентгенография костей скелета и черепа пациента Ч. Фото авторов
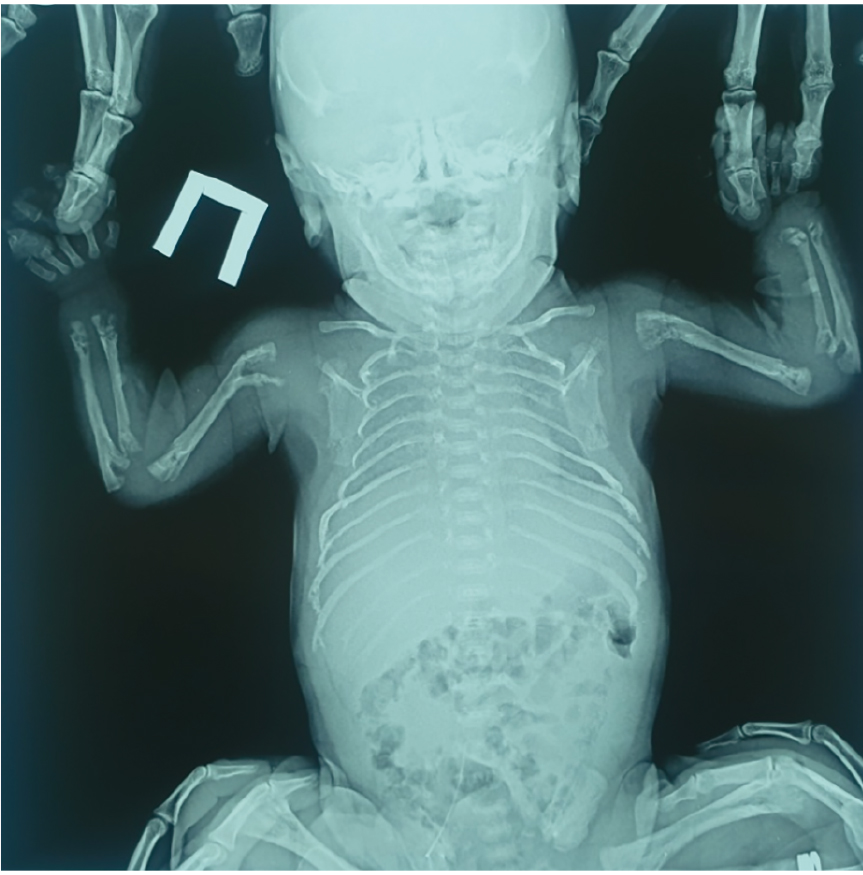
Пациенту выполнено молекулярно-генетическое исследование (метод секвенирования нового поколения и секвенирование по Сэнгеру), выявлен вариант нуклеотидной последовательности c.1171delC в 10 экзоне гена ALPL (chr1:g.21902393AC>A; rs779683021) в гетерозиготном состоянии, также вариант нуклеотидной последовательности в 5 экзоне c.314C>T (chr1:g.21889619C>A; rs768348242) в гетерозиготном состоянии.
На основании клинико-лабораторного и молекулярно-генетического обследования верифицирован диагноз: Гипофосфатазия, перинатальная форма. Аплазия теменных костей, гипоплазия лобных, височных и затылочных костей. Множественные патологические переломы трубчатых костей, ребер, ключиц.
При обследовании матери пациента определен низкий уровень ЩФ — 32 Ед/л, аналогично и у отца — 20 Ед/л (норма — 40–150 Ед/л). Родители не имеют клинических проявлений метаболического заболевания, брак не родственный.
При молекулярно-генетическом обследовании матери пробанда выявлен патогенный вариант c.1171delC (p.Arg391ValfsTer12) в гетерозиготном состоянии в гене ALPL; у отца пробанда найден, вероятно, патогенный вариант c.302A>G (p.Ala105Val) в гетерозиготном состоянии в гене ALPL.
Обследование ребенка и родителей выполнялось в генетической лаборатории сектора клинико-генетических исследований Организационно-методического отдела по медицинской реабилитации ГБУЗ «Городская больница № 40» (начальник сектора — к. б. н. Глотов О.С.), г. Санкт-Петербург.
Пациенту назначена фермент-заместительная терапия препаратом асфотаза альфа в дозе 2 мг/кг подкожно 3 раза в неделю, переносит терапию удовлетворительно, нежелательные явления не отмечаются. Продолжено динамическое наблюдение.
КЛИНИЧЕСКИЙ СЛУЧАЙ 2
Девочка У. с 5 месяцев наблюдалась у невролога с мышечной слабостью, проходила курсы массажа и физиотерапии с незначительным положительным эффектом. Из анамнеза жизни: голову удерживает с 3 месяцев, сидит с 10 месяцев, ползает с 12 месяцев, ходит с поддержкой с 1 года 3 месяцев, к 18 месяцам ходит самостоятельно неуверенно, балансируя.
В связи с отставанием в формировании статико-моторных функций на фоне умеренной мышечной гипотонии с целью исключения рахитоподобного заболевания в возрасте 1 года 2 месяцев впервые определено содержвание ЩФ: оно оказалось сниженным до 98 Ед/л (при норме 156–369 Ед/л). Повторно обследована в 1 год 5 месяцев: уровень ЩФ — 102 Ед/л (норма — 108–317 Ед/л), кальция общего — 2,7 ммоль/л (норма — 1,9–2,6 ммоль/л), кальция ионизированного — 1,33 ммоль/л (норма — 1,12–1,32 ммоль/л), фосфора — 1,9 ммоль/л (норма — 1,29–2,26 ммоль/л), 25(ОН)D — 50 нг/мл (норма — 30–70 нг/мл), пиридоксина — 18,8 мкг/л (норма — 2,2–27,9 мкг/л), остеокальцина — 46,4 нг/мл (норма — 8,4–33,9 нг/мл).
Рентгенография трубчатых костей, кистей рук с захватом лучезапястных суставов: отставание костного возраста на один эпикризный срок с нарушением порядка окостенения, определяются псевдоэпифизы пястных костей, умеренный остеопороз костей голеней. УЗИ органов мочевой системы: утолщение паренхимы почек, большое количество мелкодисперсной взвеси в просвете мочевого пузыря.
Ребенку выполнено молекулярно-генетическое исследование — выявлен вариант нуклеотидной последовательности g.21902399del в гене ALPL в гетерозиготном состоянии (исследование производилось в лаборатории молекулярной генетики и клеточной биологии ФГБУ «НМИЦ здоровья детей» Минздрава России, заведующий лабораторией — к. б. н. Савостьянов К.В.). При обследовании родителей аналогичная мутация найдена у матери ребенка. Таким образом, у пациентки У. диагностирована гипофосфатазия, детская форма.
При осмотре в возрасте 2 лет 5 месяцев сохранялись умеренное снижение мышечного тонуса, неуверенная ходьба, незначительная деформация черепа. Ребенок не бегает, быстро устает, может подниматься по лестнице с поддержкой. Улучшилась мелкая моторика — берет в руку карандаш, стала работать с мелкими предметами.
Речь практически отсутствует, общается с помощью мимики, жестов, ведет за руку. Игровая деятельность не развита, активной сюжетной игры нет, иногда эпизоды вокальных реакций с эмоциональной окраской. Общение не активное, обычно играет одна, реагирует на контакты с близкими людьми, со сверстниками в игру не вступает. Инструкции понимает избирательно, большинство выполняет, чаще действует по подражанию.
Получает симптоматическую терапию. Решение вопроса о назначении фермент-заместительной терапии — при ухудшении состояния в динамике. Прогноз для жизни благоприятный.
КЛИНИЧЕСКИЙ СЛУЧАЙ 3
На момент обращения к детскому эндокринологу пациент Р. (возраст — 6 лет 4 месяца) и пациент А. (возраст — 1 год) имели однотипные жалобы: раннее выпадение молочных зубов без резорбции корня, быстрая утомляемость.
Данные анамнеза жизни и заболевания пациента Р.: ребенок от первой беременности, срочных оперативных родов (ягодичное предлежание плода). Масса при рождении — 3490 г, длина — 51 см, окружность головы — 36 см, оценка по шкале Апгар — 8–8 баллов. С возраста 1 месяца ребенок наблюдался ортопедом по поводу дисплазии тазобедренных суставов. С 12 месяцев у мальчика стали выпадать молочные зубы, появились боли в конечностях и быстрая утомляемость, неустойчивая походка и частые падения. Осмотрен стоматологом в возрасте 13 месяцев, заключение: Генерализованный пародонтит тяжелой степени. В течение второго года жизни продолжалась потеря молочных зубов (рис. 2).
Рис. 2. Выпадение зубов без резорбции корня у пациента Р. в возрасте 2 лет. Фото авторов
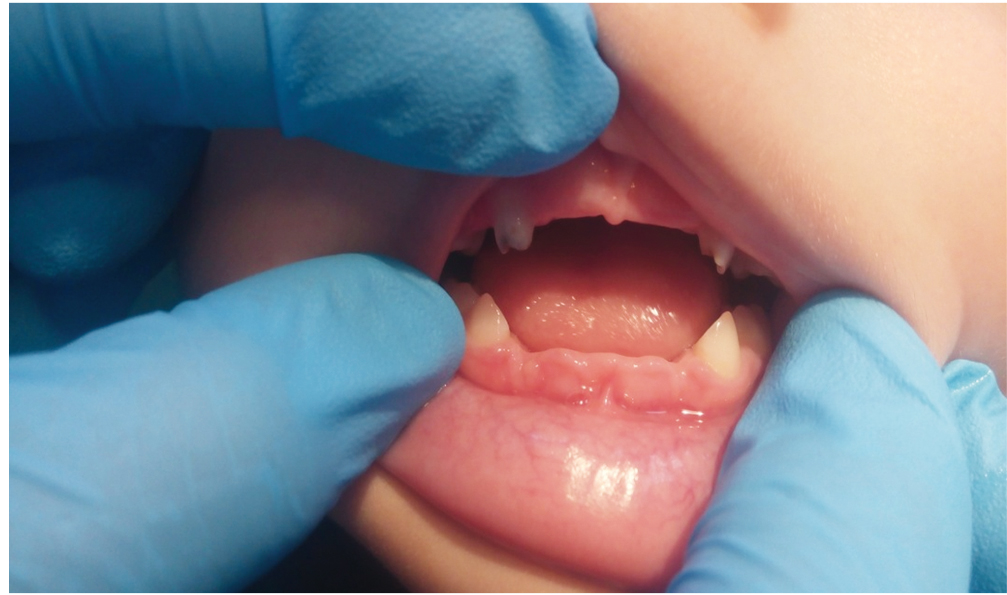
К четырем годам пациент неоднократно перенес двусторонний экссудативный средний отит, имел двустороннюю кондуктивную тугоухость 1-й степени, хронический аденоидит. У ребенка сохранялись боли в конечностях, неустойчивая походка и частые падения, сформировалось нарушение осанки.
В 2018 г. в семье родился второй мальчик. Пациент А. от второй беременности, вторых срочных самостоятельных родов, масса тела — 3240 г, длина — 52 см, окружность головы — 36 см, оценка по шкале Апгар — 7–8 баллов. С возраста 1 месяца ребенок наблюдается по поводу врожденного стридора. По данным медицинской документации, в возрасте 3 месяцев у младенца диагностирован рахит легкой степени, назначены курс общего массажа и прием витамина D в дозе 3000 МЕ/сут в течение 1 месяца.
В 11 месяцев ребенок упал с высоты собственного роста, при этом у него выпали 2 нижних резца. Родители обратились к детскому эндокринологу для исключения наследственного заболевания у детей.
Пациентам выполнено комплексное обследование в рамках дифференциальной диагностики нарушений фосфорно-кальциевого обмена, основные результаты представлены в таблице.
Таблица
Результаты обследования пациентов Р. и А., имеющие непосредственное отношение к диагностике заболевания
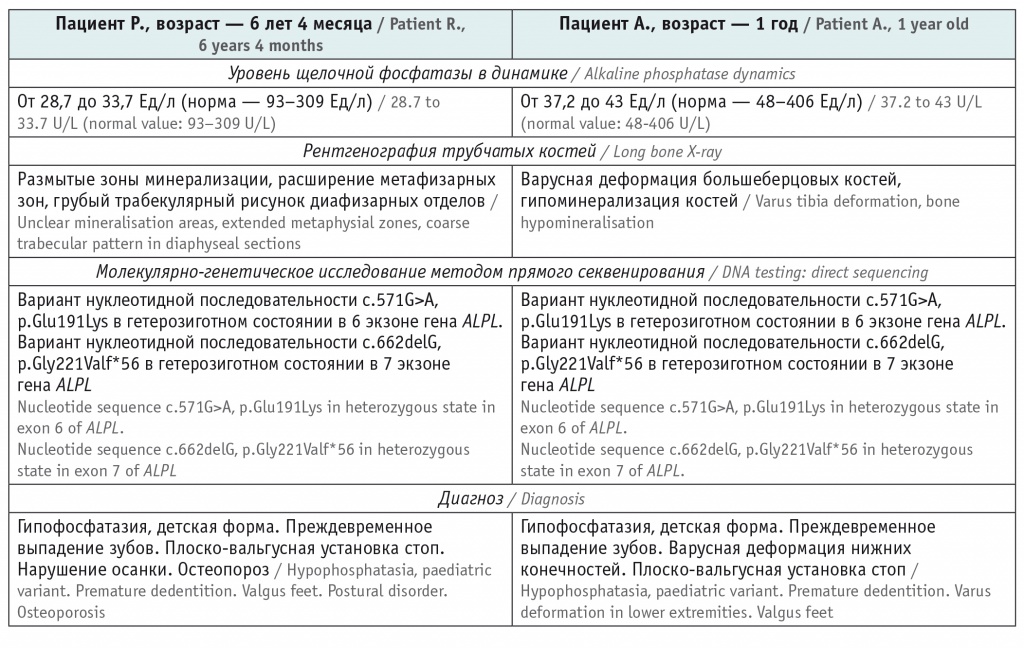
У матери пробандов уровень ЩФ — от 28,4 до 36 Ед/л (норма — 30–120 Ед/л), молекулярно-генетический анализ: методом прямого секвенирования определен вариант нуклеотидной последовательности c.662delG, p.Gly221Valf*56 в гене ALPL в гетерозиготном состоянии. У отца пробандов концентрация ЩФ — 38 Ед/л (норма — 53–128 Ед/л), молекулярно-генетический анализ: методом прямого секвенирования выявлен вариант нуклеотидной последовательности c.571G>A, p.Glu191Lys в гене ALPL в гетерозиготном состоянии. Родители пациентов Р. и А. не имеют клинических проявлений гипофосфатазии. Брак не родственный.
Больным Р. и А. рекомендовано проведение фермент-заместительной терапии препаратом асфотаза альфа в дозе 2 мг/кг массы тела путем подкожной инъекции 3 раза в неделю пожизненно. Продолжено динамическое наблюдение. Прогноз для жизни благоприятный.
ОБСУЖДЕНИЕ
Диагностика перинатальной формы гипофосфатазии не представляет особых затруднений. Наличие множественных внутриутробных переломов, деформации скелета, гипоминерализации костей, пиридоксин-зависимых судорог, дыхательной недостаточности и гипоплазии легких в сочетании с низким уровнем ЩФ при нормальных значениях паратгормона, витамина D, нормальном или повышенном уровне кальция в крови позволяют верифицировать диагноз, исключить другие формы хондродисплазий и несовершенный остеогенез.
Определение низкого уровня ЩФ будет отправной точкой в дифференциальной диагностике младенческой и детской форм гипофосфатазии с другими вариантами рахитоподобных заболеваний. Следует помнить, что преждевременное выпадение молочных зубов иногда является первым и даже единственным признаком гипофосфатазии. При этом выпадение зубов происходит без рассасывания корня, сопровождается уменьшением высоты альвеолярной кости и расширением корневых каналов.
Непрогрессирующая проксимальная миопатия может быть ранним признаком гипофосфатазии. Считается, что симптомы могут возникать в результате повышения уровня пирофосфата или из-за других, пока неизвестных факторов, которые способны ингибировать мышечную функцию. У детей с гипофосфатазией может быть «утиная» (ковыляющая) и замедленная походка[5].
В описанных клинических случаях 2 и 3 признаки гипофосфатазии определялись уже в первом полугодии жизни, в дальнейшем появлялись новые симптомы, однако верификация диагноза произошла только в дошкольном возрасте. Нельзя исключить наличие младенческой формы заболевания в этих случаях.
ЗАКЛЮЧЕНИЕ
Следует обратить внимание врачей на обязательную оценку уровня щелочной фосфатазы (ЩФ) как основополагающего лабораторного теста для подтверждения диагноза гипофосфатазии при дифференциальной диагностике метаболических заболеваний костей. Важно отметить, что показатели активности ЩФ имеют возрастные особенности, следовательно, лечащий врач должен убедиться, что сообщаемые лабораторией результаты отражают нормальный для пациента конкретного возраста уровень ЩФ.
Поступила: 10.04.2020
Принята к публикации: 20.04.2020








