Острый лимфобластный лейкоз (ОЛЛ) занимает ведущее место в онкогематологической патологии в детском и подростковом возрасте. На его долю приходится до 20% от всех злокачественных заболеваний и до 75% от всех лейкемий у детей и подростков[32, 43, 49]. Принципиальная возможность излечения подавляющего большинства пациентов и их возвращения к полноценной жизни явилась, безусловно, главным результатом серии клинических исследований, выполненных на протяжении пяти десятилетий в США и Европе[1, 42]. Это стало одной из наиболее ярких страниц современной медицины.
РАЗВИТИЕ ПРИНЦИПОВ ТЕРАПИИ ОСТРОГО ЛИМФОБЛАСТНОГО ЛЕЙКОЗА
Исследования применения химиотерапии (ХТ) в лечении злокачественных опухолей начались в 40-е годы XX века, главным образом в США. Несмотря на активный поиск новых лекарств и их комбинаций, до 60-х годов ОЛЛ оставался смертельным заболеванием и большинство детей с лейкемией умирали в течение 2 месяцев после диагностики, а химиопрепараты использовались в основном для паллиативной терапии.
Одной из групп, принимавших участие в кооперированном проекте по изучению ОЛЛ у детей Национального института рака США (National Cancer Institute), была группа D. Pinkel в госпитале Святого Иуды в Мемфисе (St. Jude Children’s Research Hospital). С 1962 г. она провела ряд клинических исследований, которые определили фундаментальные основы «тотальной терапии» ОЛЛ с целью «необратимого» излечения этого заболевания.
D. Pinkel и соавт. установили уникальность комбинации глюкокортикоидов (ГК), в частности преднизолона (Pred), с представителем семейства алкалоидов барвинка розового — винкристином (Vcr) для достижения (индукции) ремиссии, такая комбинация позволяла добиться ее у 90% пациентов. Другим ключевым компонентом явилась поддерживающая терапия (ПТ), представлявшая собой длительное применение 6-меркаптопурина и метотрексата (МТХ). ПТ позволила увеличить безрецидивную выживаемость (relapse-free survival — RFS) у большинства больных до 3–5 лет и более. Однако о возможности полного излечения от ОЛЛ стали говорить только после внедрения третьего ключевого компонента «тотальной терапии» — лечения, направленного на предотвращение лейкемического поражения ЦНС, состоявшего из краниального облучения (КО) и интратекального введения химиопрепаратов[40, 41].
В целом лечение «оккультной» (скрытой) нейролейкемии стало главным событием конца 60-х годов XX века. За счет полихимиотерапии удавалось достигать ремиссии у 80% больных, но в последующем более чем у 50% пациентов развивались рецидивы в ЦНС, хотя первично опухолевые клетки в ликворе обнаруживались менее чем в 5% случаев. Это наблюдение привело к пониманию того, что у всех пациентов с ОЛЛ изначально существует клинически скрытое поражение мозговых оболочек. Не подвергаясь воздействию применявшейся в то время ХТ, опухолевые клетки в ЦНС становились источником не только нейрорецидивов, но и последующих костномозговых рецидивов. Только после введения терапии, направленной на профилактику поражения ЦНС, 50% детей с ОЛЛ стали выздоравливать, а частота нейрорецидивов снизилась до 5%[11, 13, 40, 41, 47, 53].
Следующий важный шаг в улучшении терапии ОЛЛ у детей был сделан руководителем отделения гематологии детской клиники Свободного университета (Западный Берлин) H. Riehm, который заявил, что по-настоящему интенсивная программа лечения ОЛЛ с целью максимального уничтожения опухолевых клеток еще не создана и что для ее создания необходимы срочное развитие методов сопроводительной терапии и принципиально иная организация работы в клинике. Идея интенсификации индукции ремиссии ОЛЛ у детей, предложенная H. Riehm, оказалась успешной, однако данное лечение стало возможным только в условиях высококвалифицированного отделения с обученным персоналом и хорошими техническими возможностями, где рано распознавались опасные для жизни осложнения терапии и принимались необходимые меры[32, 46, 47].
Учитывая первые успехи пилотного протокола в Берлине, с 1974 г. его проведение началось в Мюнстере (руководитель — проф. G. Schellong), а с 1975 г. — во Франкфурте-на-Майне (руководитель — проф. B. Kornhuber). Объединившись, в 1976 г. клиники организовали кооперированное исследование ALL-BFM 76 (BFM — Berlin, Frankfurt, Münster)[46]. Основной идеей стала стратификация пациентов на группы риска. Следствием этого явилась концепция риск-адаптированной терапии, согласно которой пациенты с благоприятными характеристиками должны получать минимально токсичную терапию, не подвергаясь риску развития тяжелых осложнений, в то время как у пациентов с неблагоприятными формами ОЛЛ высокоинтенсивная терапия увеличивает шансы на излечение. Для стратификации пациентов был введен эмпирически определенный прогностический индекс риска, учитывавший инициальное количество лейкоцитов, наличие поражения ЦНС и средостения, Т-иммунофенотип, цитохимические особенности бластных клеток, возраст и органомегалию. У пациентов с индексом риска 3 и более дополнительно проводился реиндукционный курс ХТ (протокол II), разработанный еще в 1974 г. для улучшения прогноза у пациентов с гиперлейкоцитозом. Концепция отсроченной интенсификации, разработанная группой BFM, вероятно, явилась одним из наиболее ценных вкладов в программы противолейкемической терапии, позволив существенно улучшить выживаемость у пациентов группы риска[24, 36].
К началу 80-х годов группе BFM удалось добиться резкого роста выживаемости детей с ОЛЛ, которая превысила 70%.
Прогресс в лечении ОЛЛ у детей, достигнутый группой BFM, не мог не привлечь внимание других исследовательских групп из различных стран. Концепция терапии, разработанная BFM, служит примером для создания собственных программ ХТ — появляются так называемые BFM-ориентированные протоколы. При этом каждая группа инициирует собственные исследования отдельных терапевтических элементов и факторов риска, результаты которых зачастую даже более интересны, чем те, что были получены в «основном» исследовании группы BFM.
В большинстве современных протоколов можно выделить три основных этапа терапии: индукцию ремиссии, интенсивную постремиссионную терапию и ПТ. При этом терапевтические элементы, направленные на контроль нейролейкемии, являются одной из важнейших составляющих успеха.
ИНДУКЦИОННАЯ ТЕРАПИЯ
Глюкокортикоиды. ГК являются существенным компонентом терапии ОЛЛ. Попытки исключить их из индукционных протоколов привели к существенному ухудшению результатов[23]. Исторически основным ГК в терапии ОЛЛ являлся Pred, однако в ряде протоколов в качестве базового ГК применяется дексаметазон (Dexa). Основанием для этого выбора стала высокая эффективность последнего в профилактике нейролейкемии[22, 29, 35].
Существующие на сегодняшний день сравнительные данные о токсичности Pred и Dexa противоречивы[52]. В одних исследованиях выявлена бо́льшая токсичность Dexa[10, 26], в то время как другие исследователи описывают одинаковую токсичность этих ГК[27, 34].
На основании известных данных сформировалось мнение, что оптимальный ГК для лечения ОЛЛ все еще не найден. Pred обладает высокой антилейкемической активностью, однако он проникает в ликвор хуже, чем Dexa, который, в свою очередь, наряду со всеми своими преимуществами, значительно снижает сопротивляемость к инфекциям и обладает высокой токсичностью в отношении развития эндокринных и психических нарушений, остеонекрозов[9, 28, 33].
Метотрексат. Хотя эффективность MTX в лечении ОЛЛ широко исследовалась[12, 20], данные о сравнительной эффективности его высоких (HD-MTX) и низких доз (LD-MTX) противоречивы. Включение HD-MTX в протоколы лечения ОЛЛ происходило без рандомизированных клинических исследований, лишь на основании небезосновательных предположений о том, что высокие концентрации MTX в плазме приведут к лучшему проникновению в ЦНС и другие «забарьерные» органы и, соответственно, будут эффективны в лечении «скрытой» нейролейкемии и профилактике поражения яичек.
К сожалению, имеется мало хорошо организованных исследований с прямым сравнением HD-MTX и LD-MTX. Результаты двух таких исследований говорят в пользу HD-MTX[12, 39], в то же время в исследованиях UKALL и CCG преимуществ использования HD-MTX получено не было[22, 35]. В исследовании UKALL XI у пациентов, получавших HD-MTX, отмечено меньше нейрорецидивов, но параллельное увеличение количества костномозговых рецидивов привело к эквивалентной бессобытийной выживаемости пациентов (event-free survival — EFS)[25]. Группа BFM описала снижение частоты развития тестикулярных рецидивов при введении в протокол промежуточной дозы MTX (0,5 г/м2). В то же время использование HD-MTX (5 г/м2) в ее исследовании не привело к более эффективной профилактике тестикулярных рецидивов[19], как и в исследовании UKALL XI[25]. Метаанализ, проведенный исследователями из Оксфорда, показал, что HD-MTX оказывают небольшое влияние на частоту развития нейрорецидивов, но, вероятно, снижают риск развития костномозговых рецидивов по сравнению с LD-MTX[16].
Критическим вопросом в настоящий момент является не выбор оптимальной дозы MTX, а скорее определение подгрупп пациентов, в которых HD-MTX более эффективны[12]. Ранние исследования SJCRH свидетельствуют о том, что HD-MTX приносят пользу ограниченной подгруппе детей с ОЛЛ (с лейкоцитозом менее 25 × 109/л, белой расы, в возрасте 2–10 лет, с гиперплоидией, без значимых транслокаций)[51].
L-аспарагиназа (L-asp). Это уникальный по своей ферментативной природе противоопухолевый химиопрепарат, не обладающий выраженной миелотоксичностью и специфически влияющий на лимфобласты[46]. В течение последних 25 лет использование L-asp с Vcr, ГК и антрациклинами является «золотым стандартом» большинства индукционных протоколов лечения детей с ОЛЛ[23, 41].
Значительные достижения в оптимизации терапии L-asp сделаны благодаря исследованиям Онкологического института Дана — Фарбера США (Dana-Farber Cancer Institute). В них было показано значимое улучшение EFS при включении 20-30-недельной терапии L-asp в протоколы консолидации (пятилетняя EFS составила 72% против 47% без использования L-asp). При этом прогноз у пациентов, которые получали сокращенный курс L-asp (менее 25 недель) из-за непреодолимых побочных эффектов, был хуже, чем у тех, кто получил полный курс препарата[50].
В 1994 г. при изучении фармакокинетики L-asp фирмы MEDAC в исследованиях BFM было показано, что полная деплеция аспарагина как в плазме, так и в ликворе наблюдается при использовании L-asp в дозах 10 000, 5000 и даже 2500 ЕД/м2, но при использовании последней дозы терапевтическая активность препарата в плазме (более 100 ЕД/л) была достигнута лишь у половины пациентов, поэтому в индукции ремиссии протоколов BFM начиная с 1995 г. L-asp стала применяться в разовой дозе 5000 ЕД/м2. Необходимо отметить, что все фармакокинетические исследования проводились на небольших группах больных и без учета различных факторов риска, никаких больших контролируемых мультицентровых исследований различных дозовых режимов L-asp в мире до сих пор не проведено.
В практике препарат вводится внутривенно, внутримышечно или подкожно[7, 8]. Хотя это может приводить к различиям в фармакокинетике, информация по значимости путей введения весьма ограниченна[45]. M. Nesbit и соавт. описали меньшую частоту развития аллергических реакций при внутримышечном введении, чем при внутривенном[38].
Важной проблемой использования L-asp является образование антител, которые существенно влияют на аспарагиназную активность[7]. Это может клинически проявляться аллергическими реакциями[37], которые развиваются у 2/3 пациентов, получавших терапию нативной L-asp[12, 45], или приводить к быстрому снижению ферментативной активности без клинических проявлений[8, 54]. Частоту развития такой «молчаливой инактивации» еще предстоит изучить, но содержащиеся в литературе данные позволяют предположить, что она имеется более чем у 50% пациентов с рецидивом ОЛЛ, получавших L-asp в составе терапии первой линии[31].
В целом, несмотря на более чем 30-летний опыт использования L-asp, оптимальные дозы и режимы ее введения у различных подгрупп пациентов с ОЛЛ остаются неясными.
ТЕРАПИЯ, НАПРАВЛЕННАЯ НА ПРОФИЛАКТИКУ ПОРАЖЕНИЯ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
Начало 70-х годов ХХ века ознаменовалось введением терапии, направленной на профилактику поражения ЦНС, базовыми элементами которой явились КО и интратекальное введение химиопрепаратов[13, 41]. Третьим методом улучшения контроля нейролейкемии является интенсификация системной терапии с включением терапевтических элементов, обладающих высокой активностью в отношении менингеального поражения[41].
К 1990-м годам появилась статистика вторых опухолей, возникавших у «детей-долгожителей», которые получили терапию в раннем детстве и находились в стойкой продолжительной ремиссии ОЛЛ[39]. Возникновение вторых опухолей было обусловлено канцерогенным эффектом некоторых химиопрепаратов, но прежде всего КО в рамках профилактики нейролейкемии. Хотя частота развития осложнений широко варьирует в разных исследованиях, вероятно, она выше у девочек[49, 53], а также у детей раннего возраста[15].
Ввиду побочных явлений КО, включая нейропсихологические и эндокринные последствия и вторичные опухоли, получили развитие альтернативные стратегии терапии, направленной на профилактику нейрорецидивов[13, 53].
Начиная с середины 80-х годов ХХ века исследователи стали широко использовать HD-MTX с целью профилактики развития нейрорецидивов и лечения «скрытой» нейролейкемии. Однако их результаты различались. В некоторых исследованиях HD-MTX были эффективнее КО в отношении профилактики нейрорецидивов[12, 21], тогда как в других не было показано их преимуществ над КО[12]. В нескольких исследованиях была выявлена равная эффективность HD-MTX и КО[12, 17, 25]. Необходимо отметить, что HD-MTX без интратекальной терапии не обеспечивают адекватной «ЦНС-направленной» терапии[44]. Метаанализ международных исследований, включавший почти 3000 пациентов, показал, что добавление HD-MTX в различных дозировках и режимах введения не принесло улучшения с точки зрения ЦНС-терапии[16, 51]. В том же метаанализе была показана эквивалентность лучевой терапии и длительного использования интратекальных введений[16].
Таким образом, несмотря на большое количество исследований по изучению эффективности терапии, направленной на профилактику поражения ЦНС, оптимальный риск-адаптированный терапевтический режим по-прежнему не разработан. Результаты некоторых исследований говорят о том, что ранняя интенсификация интратекальной терапии, наряду с интенсивной системной терапией, фактически предотвращает возникновение нейрорецидивов у детей с ОЛЛ[25], а также что большинство детей с ОЛЛ с большой вероятностью могут быть защищены от развития нейрорецидивов без использования КО[11, 22, 25, 29, 44].
ПОДДЕРЖИВАЮЩАЯ ТЕРАПИЯ
За интенсивной фазой следует этап ПТ. Механизм противолейкемического действия ПТ остается невыясненным. Согласно одной из современных гипотез, эффект низкодозной «метрономной» терапии опосредованно реализуется через ангиогенное действие и угнетение стромальных элементов[49]. Основными препаратами на этом этапе являются пуриновые антиметаболиты и MTX, ключевая роль MTX заключается в облегчении метаболической активации 6-меркаптопурина в клетках.
Основные мировые кооперированные группы считают достаточной общую длительность терапии в 24 месяца[14]. Некоторые группы используют более длительную ПТ, особенно у мальчиков, в то же время в исследовании CCG показано, что продолжение ПТ более 3 лет не повышает эффективности лечения[32, 43, 49]. С другой стороны, попытки уменьшить ее продолжительность приводят к существенному ухудшению общей выживаемости (overall survival — OS) пациентов[36]. Однако в одном из исследований приблизительно половина пациентов, получавших терапию длительностью только 1 год, остаются в полной продолжительной ремиссии[36]. Этот факт говорит о том, что у части пациентов, по всей вероятности, может использоваться и менее длительная терапия, хотя до настоящего времени нет ни клинических, ни биологических индикаторов, позволяющих идентифицировать таких пациентов[32, 43, 49]. Залогом успеха ПТ является ее непрерывность, что подтверждено рядом исследований, согласно им выполнение ПТ в объеме менее 80% от требуемого является неблагоприятным прогностическим фактором в отношении развития рецидива[14, 49].
Наряду с «классической» ПТ, представляющей собой длительное применение антиметаболитов, некоторые исследовательские группы используют пульсы Vcr + Dexa[22, 48]. Метаанализ, проведенный S. Richards и соавт., показал, что введение реиндукции/интенсификации приводит к 10–15%-му увеличению EFS у пациентов с ОЛЛ[14]. С другой стороны, V. Conter и соавт. не нашли различий в EFS у пациентов группы промежуточного риска (ImRG), получавших или нет пульсы Vcr + Dexa во время ПТ[18].
ТЕРАПИЯ ОСТРОГО ЛИМФОБЛАСТНОГО ЛЕЙКОЗА У ДЕТЕЙ В РОССИИ
До 90-х годов XX века в России не существовало программного лечения ОЛЛ у детей. Различные клиники проводили лечение пациентов с помощью чередующихся схем введения химиопрепаратов (ВАМП — Vcr, 6-меркаптопурин, метотрексат, Pred; ЦАМП — то же, но вместо Vcr циклофосфамид; применение интерферона и т. д.). Отсутствие в нашей стране организованной системы онкологической статистики, оценивающей результаты лечения, не позволяло назвать точную выживаемость детей с ОЛЛ, однако по данным ведущих клиник уровень пятилетней OS не превышал 20%, а десятилетней — 7%[1, 3, 4]. Одним из путей улучшения результатов лечения стало применение испытанных на Западе интенсивных программ ХТ с хорошо известными конечными результатами[5]. Именно по такому пути пошли многие отечественные центры и отделения детской гематологии/онкологии. Протоколы немецкой исследовательской группы BFM явились первой западной программой ХТ, которая начала широко использоваться в онкогематологических отделениях нашей страны и в 90-х годах стала стандартом de facto в России[5].
С 1991 г. НИИ детской гематологии (ныне Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачёва Минздрава России, Москва) использует для лечения детей с ОЛЛ оригинальный отечественный протокол «Москва — Берлин» (ALL-MB 91), созданный в сотрудничестве с клиникой «Шарите» (Берлин, Германия). Результаты терапии по протоколу ALL-BFM 90, полученные в данной клинике, были сопоставимы с результатами западных клиник[5], однако авторы считали, что эту довольно интенсивную и сложную программу терапии будет непросто проводить в России, поскольку она часто сопровождается тяжелыми побочными явлениями, требующими высококачественной и дорогостоящей сопроводительной терапии. Поэтому решено было создать такую же эффективную, но менее агрессивную и дорогую программу лечения с возможностью ее применения в других гематологических клиниках России. Специальными требованиями к новому протоколу были: отказ от применения высокодозной интенсивной ХТ; уменьшение потребности в трансфузиях компонентов крови; лечение пациентов в основном амбулаторно; отказ от облучения у большей части больных.
Основной научной идеей данной программы ХТ являлось представление о ключевой роли «оккультной» нейролейкемии в возникновении рецидивов и, следовательно, в неудачах лечения ОЛЛ у детей. В рамках этой концепции вместо классического стероида Pred был использован Dexa. Кроме того, были введены новый режим длительного (в течение нескольких месяцев) применения L-asp и локальная химиопрофилактика нейролейкемии путем TIT (тройная интратекальная терапия — MTX, цитарабин, Pred)[2]. Важными особенностями нового режима терапии ОЛЛ явились полный отказ от HD MTX, циклофосфана и цитарабина, значительная редукция кумулятивной дозы антрациклинов и отказ от КО для большинства больных.
В первом исследовании ALL-MB 91 пациенты были разделены на две группы риска: группу стандартного риска (SRG) и группу риска (RG). В основу определения групп риска были положены два основных фактора — возраст и инициальный лейкоцитоз.
Для того чтобы результаты такого исследования были объективными, решено было сравнить новый протокол по эффективности и токсичности со стандартным протоколом ALL-BFM 90 в режиме моноцентрового рандомизированного исследования. К 1995 г. повторные статистические анализы данных показали абсолютную идентичность результатов лечения ОЛЛ у детей по двум протоколам ХТ. Вместе с тем протокол ALL-MB 91 уже в этом раннем исследовании обнаружил ряд преимуществ. При лечении по протоколу ALL-BFM 90 более 60% детей с ОЛЛ были отнесены к группам среднего (MRG) и высокого риска (HRG). Все эти дети получали КО. Подавляющее большинство (84%) пациентов, леченных по протоколу ALL-MB 91, относились к SRG, и облучение головы у этих детей не использовалось. У этой же группы пациентов была резко редуцирована кумулятивная доза антрациклинов. Побочные эффекты на программе ALL-MB 91 были умеренно выражены, пациентам требовалось меньше трансфузий эритроцитов, антибиотиков, и они меньше и реже находились в отделении[2].
С августа 1995 г. началось мультицентровое исследование ALL-MB 91/ALL-BFM 90m[1], в рамках которого набор больных был закончен в мае 2002 г. При этом в результате постепенного присоединения новых клиник в исследование было включено более 700 пациентов из 11 центров детской онкологии/гематологии России.
По результатам данного исследования, эффективность нового протокола ALL-МВ 91 оказалась такой же, как у ALL-BFM 90m. Несмотря на отсутствие интенсивной высокодозной терапии, EFS больных ОЛЛ соответствовала стандартам, установленным в большинстве современных западных протоколов, и составляла 67 ± 3%, причем у пациентов SRG она равнялась 73%, а у пациентов RG — 54%. Между двумя режимами не наблюдалось различий по частоте достижения полных ремиссий и числу рецидивов, а также по кривой выживаемости за 10 лет наблюдения как в целом, так и в зависимости от отдельных факторов риска[2].
Несмотря на хорошие результаты, оставался целый ряд нерешенных проблем терапии: высокая летальность в связи с терапией и высокая частота нейрорецидивов у больных RG[2, 6].
Успешный опыт исследования ALL-MB 91/ALL-BFM 90m показал эффективность технологии мультицентровых исследований для оптимизации терапии в гематологии/онкологии и оказал огромное влияние на изменение менталитета детских врачей-онкогематологов по всей России. Внедрение новых технологий лечения и подготовка медицинского персонала позволили распространить современные протоколы терапии ОЛЛ не только в клинике института, но и в крупнейших краевых, областных гематологических центрах РФ и Беларуси. Поэтому было решено продолжить совместную работу центров в виде постоянно действующей кооперированной группы «Москва — Берлин», организовав новое исследование ALL-MB 2002.
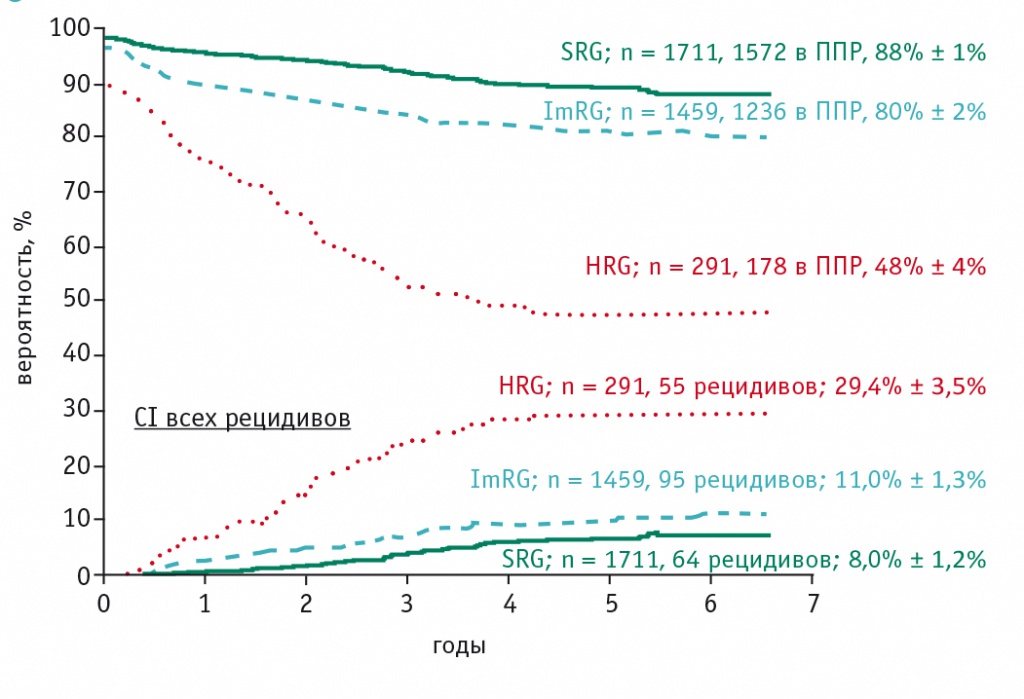
Протокол ALL-MB 2002 проводился в России в 2002–2008 гг. В исследовании приняли участие более 30 центров России и Белоруссии, за 5 с половиной лет исследования зарегистрировано более 1500 пациентов. Совершенствование принципов сопроводительной терапии, повышение опыта и квалификации медицинского персонала позволили использовать в новом протоколе у отдельных пациентов более интенсивные элементы терапии. Так, была дополнительно выделена подгруппа больных HRG, главной особенностью которой является первичная резистентность ОЛЛ к химиотерапии. По своим параметрам она соответствовала группе высокого риска протоколов BFM. Однако принципы стратификации остальных групп риска (в этом исследовании они стали называться «группа стандартного риска» — SRG и «группа промежуточного риска» — ImRG) остались прежними.
Несмотря на успех кооперированной группы «Москва — Берлин», не являющейся по идеологии БФМ-ориентированной, и конкурентные результаты лечения в целом, в ходе исследования ALL-MB 2002 был выявлен ряд проблем терапии ОЛЛ у детей в России. В первую очередь отмечена высокая летальность на этапе индукционной терапии и в состоянии ремиссии по сравнению с ведущими зарубежными клиниками. Частота смертей на этапе индукционной терапии была довольно высокой и составляла для всех пациентов 4,21%, а в группе HRG — 9,18%. Летальность в ремиссии у пациентов SRG и ImRG не различалась и составляла около 5%; у пациентов HRG, получавших интенсивную высокодозную терапию, — 11,22%. Причинами высоких показателей летальности стали относительно поздняя диагностика ОЛЛ в России и поступление детей в специализированные центры в плохом общем состоянии.
Полученные данные были положены в основу исследования ALL-MB 2008, одной из основных идей которого стала новая стратификация на группы риска. Учитывая сохраняющуюся высокую летальность на этапе индукционной терапии, исследователи решили использовать в фор-фазе и на ранних сроках индукции PEG-аспарагиназу (PEG-asp) в надежде на более раннее достижение ремиссии, улучшение ответа на 8-й и 15-й дни терапии и, как следствие, на сокращение длительности аплазии, уменьшение частоты тяжелых инфекций и снижение ранней смертности. У части пациентов SRG согласно рандомизации антрациклины в индукции не использовались вовсе, при этом одной из задач являлось решение вопроса о том, приведет ли это к уменьшению токсичности без потери эффективности терапии. Еще одной задачей стало рандомизированное сравнение эффективности 9 введений PEG-asp в дозе 1000 МЕ/м2 и 18 введений аспарагиназы Escherichia coli в дозе 5000 МЕ/м2 в терапии консолидации у больных SRG. В протоколе ALL-MB 2008 было также продолжено рандомизированное сравнение эффективности HD-MTX и LD-MTX. Одной из крайне важных задач исследования ALL-MB 2008 было решение вопроса о том, возможен ли полный отказ от КО у всех больных ОЛЛ или в отдельных подгруппах пациентов ImRG, а также достаточно ли для контроля нейролейкемии применения дополнительных интратекальных введений в терапии консолидации.
Исследование ALL-MB 2008 было успешно завершено в 2014 г. Итоги этого исследования обсуждаются, и кооперированная группа готовится к публикациям. Материал, которым располагает кооперированная группа, уникален: в протокол включен 3461 больной со сроком наблюдения до 6 лет в возрасте от 1 месяца до 28 лет. По предварительным данным, 86% пациентов живы; EFS составила 81% (рис. 1, 2). Протокол имеет международную регистрацию и, по существу, является визитной карточкой российской клинической науки.
Рис. 1. Бессобытийная выживаемость пациентов и кумулятивный риск развития рецидивов в протоколах серии «Москва — Берлин» (данные ФНКЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачёва).
Примечание. Здесь и на рисунке 2: ППР — полная продолжительная ремиссия, CI — кумулятивный риск, EFS — бессобытийная выживаемость
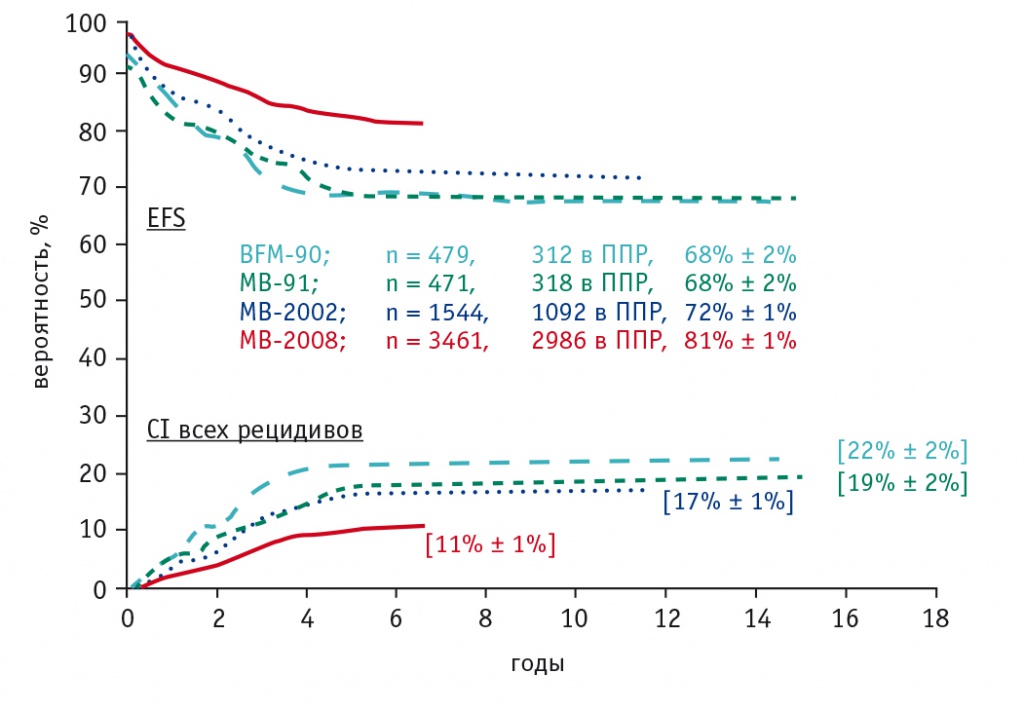
Рис. 2. Бессобытийная выживаемость пациентов в зависимости от группы риска на протоколе ALL-MB 2008 (данные ФНКЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачёва)
В 2015 г. начато исследование эффективности нового протокола ALL-MB 2015. Принципиальным отличием этого исследования является новая концепция стратификации на терапевтические группы, в которой основополагающую роль играют иммунофенотип и молекулярная генетика бластных клеток. Впервые разработана совершенно новая стратификация на группы риска для пациентов с Т-клеточным ОЛЛ, основанная как на клинических параметрах и ответе опухоли на терапию, так и на экспрессии CD1a на бластных клетках. Пациенты с ОЛЛ из В-клеток-предшественников старше 15 лет выделяются в отдельную подгруппу, и среди них предполагается провести прямое рандомизированное сравнение эффективности различных ГК. На основе результатов предыдущих исследований вводятся обязательное применение у всех пациентов PEG-asp на 3-й день терапии, LD-MTX в консолидациях и дополнительная интратекальная терапия вместо КО у большей части пациентов. В надежде на возможное уменьшение токсичности терапии предполагается рандомизированное исследование преимуществ прерывистого курса Dexa в индукции перед его постоянным приемом. Планируется исследование эффективности использования новых препаратов у отдельных подгрупп пациентов с плохими результатами терапии.
ЗАКЛЮЧЕНИЕ
Таким образом, бессобытийная выживаемость детей, больных острым лимфобластным лейкозом (ОЛЛ), увеличилась с 5% в 1960-е до 75–80% в 2000-е годы. Ключевыми компонентами такого знаменательного прогресса являются: 1) 3–4-компонентная индукционная терапия (достижение ремиссии у 98–99% пациентов); 2) профилактика поражения ЦНС (уменьшение частоты нейрорецидивов до значений менее 10%); 3) интенсивная фаза терапии; 4) продолжительная фаза поддерживающей терапии.
Несмотря на то что современные программы химиотерапии позволяют добиваться излечения 80% детей с ОЛЛ, терапия остается достаточно интенсивной и токсичной. По-видимому, дальнейшего улучшения результатов можно добиться, сделав ее более эффективной и менее токсичной для определенных подгрупп пациентов. Остаются спорными следующие вопросы:
- клинические и лабораторные признаки, определяющие прогноз и, соответственно, выбор терапии;
- прогностическая значимость определения минимальной остаточной болезни;
- необходимая интенсивность инициальной индукционной терапии;
- оптимальный режим профилактической ЦНС-терапии;
- оптимальная продолжительность терапии;
- показания к проведению трансплантации гемопоэтических стволовых клеток в первой ремиссии;
- эффективность и необходимость использования высоких доз метотрексата (HD-MTX) и др.








