Дисфункция почек представляется одним из наиболее частых патологических состояний у реанимационных пациентов, нередко являясь симптомом полиорганной недостаточности. Под острой почечной недостаточностью (ОПН) принято понимать остро возникшие нарушения гомеостатической функции почек вследствие их органического повреждения, что проявляется в быстром и выраженном снижении диуреза и азотовыделительной функции, водно-электролитном и кислотно-щелочном дисбалансе, а также сопровождается поражением фактически всех органов и систем организма[4–6].
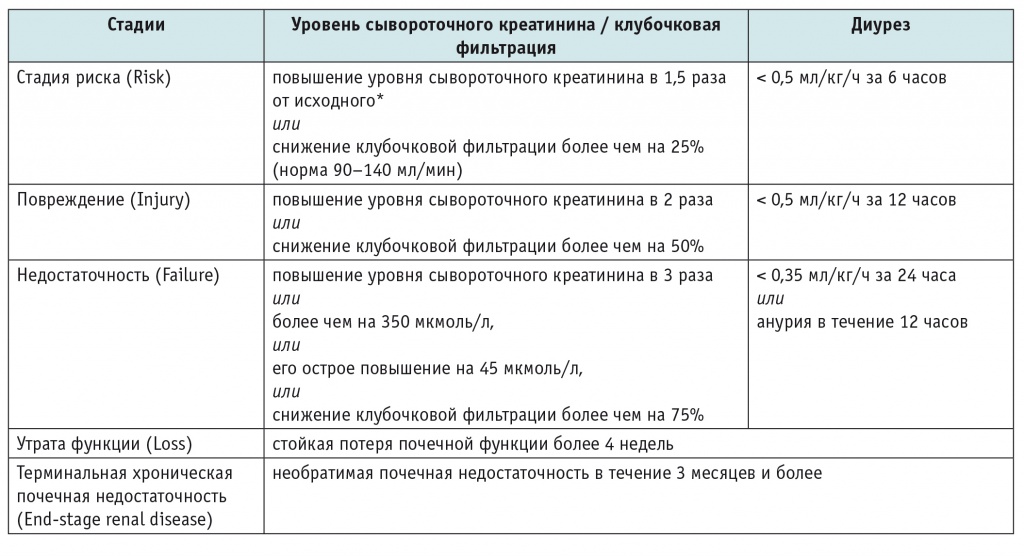
В 2004 г. на Второй Международной консенсус-конференции группы Acute Dialysis Quality Initiative (ADQI) термин «острая почечная недостаточность» был заменен на «острое почечное повреждение» (ОПП) и была принята новая классификация, получившая название RIFLE — Risk (риск), Injury (повреждение), Failure (недостаточность), Loss (утрата), End-stage renal disease (терминальная хроническая почечная недостаточность)[13]. Согласно данной классификации, стадирование ОПП осуществляют на основе повышения уровня сывороточного креатинина (СК) крови или снижения расчетной величины клубочковой фильтрации либо диуреза (табл. 1)[10, 13].
Таблица 1
Классификация острого почечного повреждения RIFLE[13]
* Норма сывороточного креатинина — 44–88 мкмоль/л[1]
В 2012 г. были приняты «Практические Клинические рекомендации «Болезни почек: улучшение глобальных результатов» (Kidney Disease: Improving Global Outcomes — KDIGO) международной Рабочей группы по острому почечному повреждению (Acute Kidney Injury Work Group), определяющие ОПП как повышение уровня СК на 0,3 мг/дл или более (≥ 26,5 мкмоль/л) в течение 48 часов или в 1,5 раза или более по сравнению с исходным уровнем (если данное повышение произошло в течение предшествующих 7 дней). Диагноз ОПП устанавливают также, если объем выделяемой мочи составляет менее 0,5 мл/кг/ч за 6 часов[20]. Стадирование ОПП согласно рекомендациям KDIGO представлено в таблице 2.
Таблица 2
Стадии острого почечного повреждения согласно клиническим рекомендациям Kidney Disease: Improving Global Outcomes[20]

Нарушение функции почек встречается у 2–7% пациентов стационаров, у пациентов же реанимационных отделений частота ОПП достигает 35%[7].
Около 5% пациентов реанимационных отделений нуждаются в почечно-заместительной терапии (ПЗТ). В некоторых группах, например среди больных, перенесших кардиохирургические операции или с определенными нозологиями (сепсисом и др.), число пациентов, которым требуется ПЗТ, достигает в отдельных случаях 70%[20, 23, 24, 28]. В целом количество больных в отделениях интенсивной терапии, нуждающихся в таком лечении, возросло с 50 человек на 1 млн населения в конце 80–90-х годов ХХ века до 270 на 1 млн населения в 2006 г. Для сравнения: количество пациентов с острым повреждением легких, которым требуется проведение ИВЛ, оценивают в 112–323 человека на 1 млн населения[2, 9, 28].
Считается, что повышение уровня СК на 45 мкмоль/л ассоциировано с 6,5-кратным повышением риска смерти, 3,5-кратным увеличением длительности госпитализации и дополнительными затратами на лечение, составляющими около 7500 долларов США[9, 24].
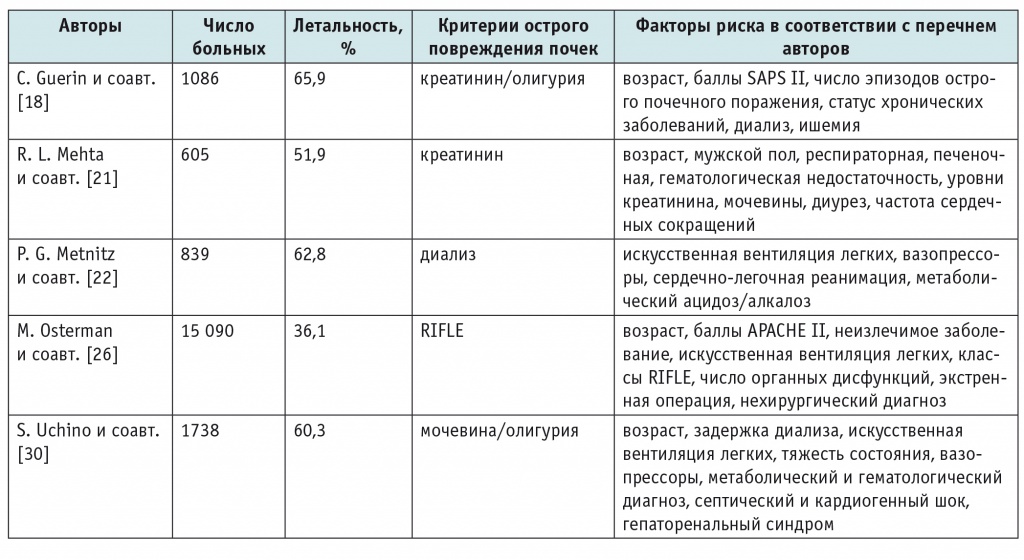
Несмотря на значительные достижения в области почечно-заместительных технологий, летальность, ассоциированная с ОПП в отделениях интенсивной терапии остается неизменной на протяжении последних трех десятилетий и достигает 50%[2, 5]. Факторы риска летального исхода, обусловленного ОПП, представлены в таблице 3.
Таблица 3
Факторы риска смерти критических пациентов с острым повреждением почек по результатам многофакторного анализа
В последние годы состояние пациентов реанимационного профиля с ОПП значительно улучшилось за счет развития продленной ПЗТ. Под этим понимают любые экстракорпоральные методы лечения, используемые круглосуточно в течение длительного периода. В настоящее время проводят несколько процедур: гемофильтрацию, гемодиализ, гемодиафильтрацию и ультрафильтрацию[11].
При постоянной вено-венозной гемофильтрации кровь течет по одну сторону высокопроницаемой мембраны. Это происходит из-за конвекции, когда вода и маленькие молекулы (менее 20 кДа, в зависимости от размера пор фильтра) проходят сквозь мембрану из зоны высокого давления в область низкого давления. Ультрафильтрат замещается физиологичным раствором до фильтра (предилюция) или после фильтра (постдилюция) по принципу «разбавить и отжать». Белки плазмы и клетки крови слишком велики и поэтому не проникают через мембрану. Чем выше объемы ультрафильтрации, тем больше клиренс молекул. При продленной вено-венозной ультрафильтрации происходит изолированное удаление воды.
При постоянном вено-венозном гемодиализе кровь течет по одну сторону высокопроницаемой мембраны, диализат — по другую сторону и в противоположном направлении относительно тока крови. За счет диффузии маленькие молекулы проходят сквозь мембрану по градиенту концентрации (вода не перемещается через мембрану) со скоростью, обратно пропорциональной их молекулярной массе. Постоянная вено-венозная гемодиафильтрация сочетает в себе принципы диффузии и конвекции.
Продленные почечно-заместительные процедуры позволяют постоянно медленно удалять жидкость, корригировать нарушения кислотно-щелочного, осмолярного и электролитного состояний, не влияя существенным образом на гемодинамику, благодаря чему в выборе лечения пациентов реанимационных отделений с ОПП им отдается приоритет перед более традиционной интермиттирующей диализной терапией. Дополнительные эффекты ПЗТ включают регрессию интерстициального отека, массивное удаление широкого спектра патогенных субстратов, коррекцию гипертермии и т. д.
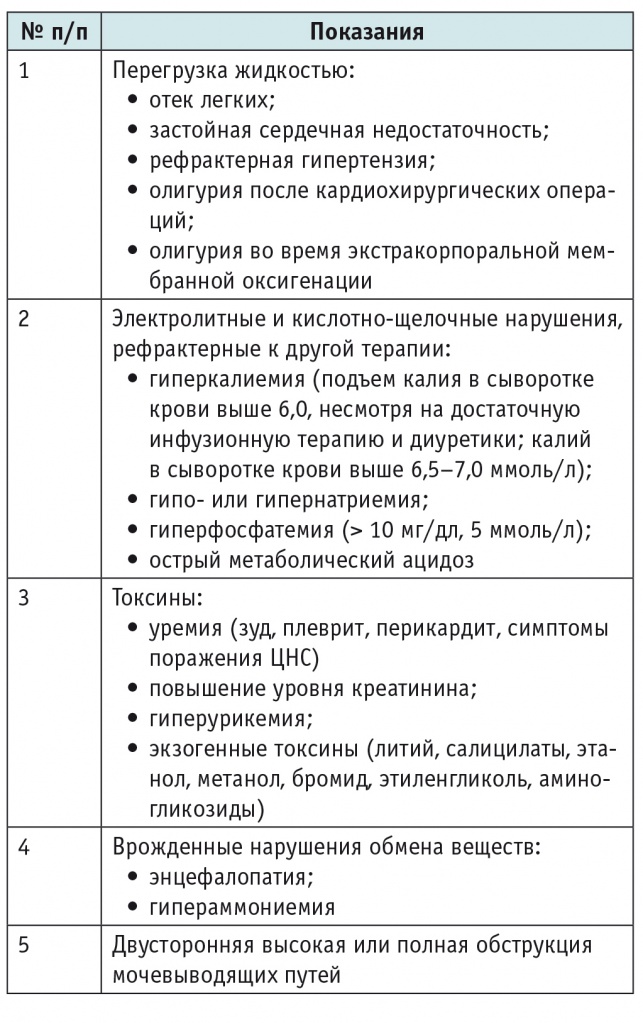
Основным показанием к началу острого диализа служит ОПП, соответствующее критериям «Повреждение» или «Недостаточность» по классификации RIFLE: олигоанурия с темпом диуреза менее 0,3–0,5 мл/кг/ч (< 50 мл/м2/ч) без ответа на введение фуросемида в дозе 10 мг/кг/сут на фоне 2–3-кратного повышения уровня СК. Для педиатрии существенной проблемой также является формирование выраженного отечного синдрома, особенно с развитием клиники отека легких, сердечной недостаточности, рефрактерной гипертензии. Ургентными показаниями к началу диализной терапии являются электролитные нарушения, прежде всего гиперкалиемия и диснатриемия (табл. 4).
Таблица 4
Показания к острому диализу у детей[3, 11, 12, 25]
В 2012–2014 гг. в отделении реанимации Федерального научно-клинического центра детской гематологии, онкологии и иммунологии имени Дмитрия Рогачёва было проведено 176 сеансов почечно-заместительных процедур для лечения 69 детей: 25% детей были первого года жизни, 22% больных находились в раннем детском возрасте (1–3 года), 24% — в возрасте от 4 до 10 лет, 29% — старше 10 лет.
Основным показанием к началу диализной терапии в 27 (39,1%) случаях служило развитие почечной недостаточности в структуре полиорганной недостаточности, как правило, на фоне развития тяжелого сепсиса и септического шока. В 18 (26,1%) случаях триггером для начала диализа был нараставший уровень азотемии со средним уровнем мочевины 16,0 ± 6,25 ммоль/л и креатинина 127,6 ± 65,3 мкмоль/л. У 11 пациентов (15,9%) показанием являлась анурия. С меньшей частотой встречались электролитные нарушения (у 7 больных, 10,1%) и нарастание клинически значимого отечного синдрома (у 6 пациентов, 8,7%).
У большинства детей (38 из 69) основными диагнозами были злокачественные образования лимфоидной и кроветворной ткани (лимфобластные и миелобластные лейкозы, лимфомы и т. д.), у 20 из 69 — солидные опухоли различной локализации.
Одной из особенностей онкогематологической патологии является развитие синдрома острого лизиса опухоли (СОЛ), который послужил причиной развития ОПП приблизительно у каждого седьмого из наших пациентов (13%).
СОЛ может быть спонтанным, но как правило, индуцируется началом химиотерапии и сопровождается развитием комплекса метаболических расстройств в результате массивного распада опухолевых клеток и высвобождения в плазму крови внутриклеточного содержимого и метаболитов. Данное состояние часто сопровождается развитием почечной недостаточности, которое чаще всего развивается в течение первых четырех дней после начала специфической противоопухолевой химиотерапии, возможен и более поздний дебют синдрома (до 7 дней).
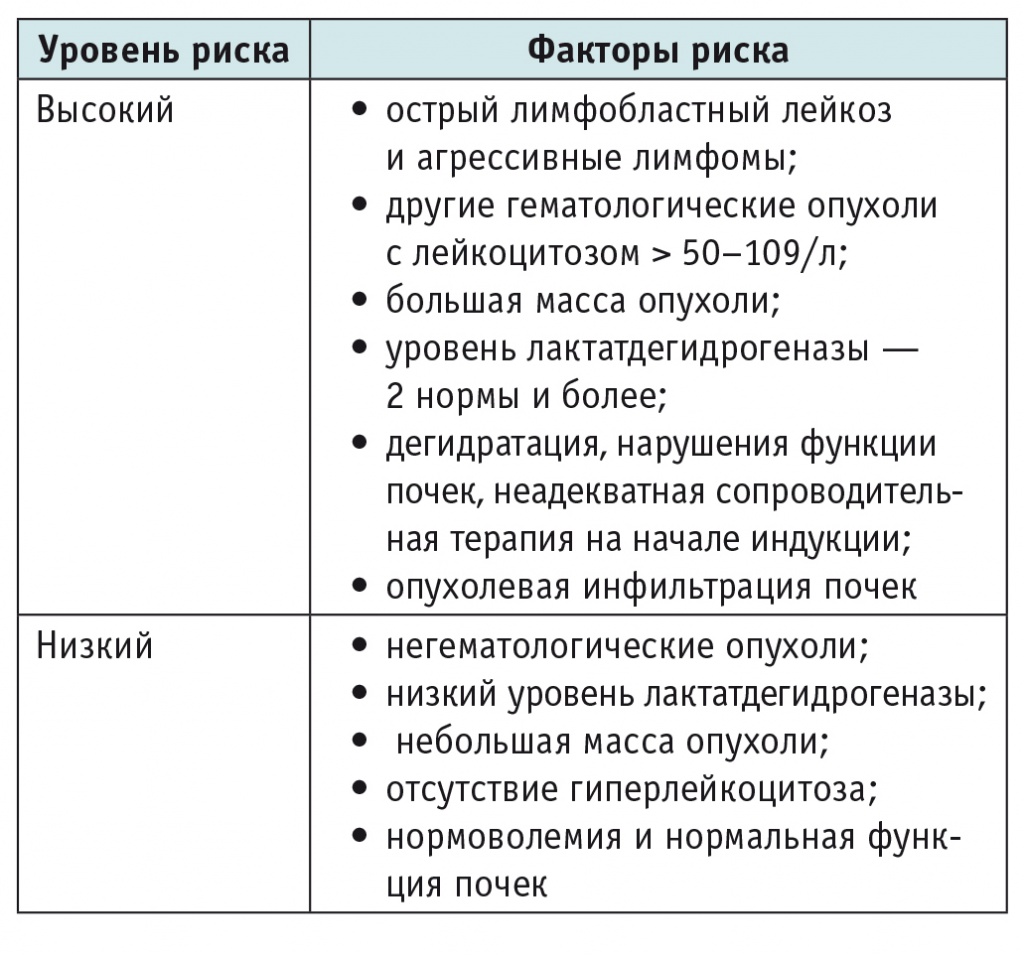
Наиболее часто СОЛ развивается у пациентов с агрессивными лимфоидными опухолями, особенно с острым лимфобластным лейкозом и лимфомой Беркитта, которые высокочувствительны к глюкокортикоидам и химиопрепаратам (табл. 5). К другим факторам риска относятся большая масса опухоли, гиперлейкоцитоз, наличие дегидратации, неадекватная сопроводительная терапия на начале индукционной химиотерапии. Риск развития ОПП при СОЛ повышен в группе больных с предшествующим поражением почек[8].
Таблица 5
Группы риска развития синдрома острого лизиса опухоли[8]
По классификации M. S. Cairo и M. Bishop (2004), различают лабораторный и клинический СОЛ (табл. 6). Лабораторный СОЛ характеризуется развитием гиперурикемии, повышением уровня калия, гиперфосфатемии и снижением уровня кальция. При клиническом СОЛ, наряду с лабораторными показателями, нарушается сердечный ритм (вплоть до остановки сердца), развивается судорожный синдром, возникают отеки, дыхательная недостаточность и другие клинически значимые симптомы[14].
Таблица 6
Классификация синдрома острого лизиса опухоли[14]
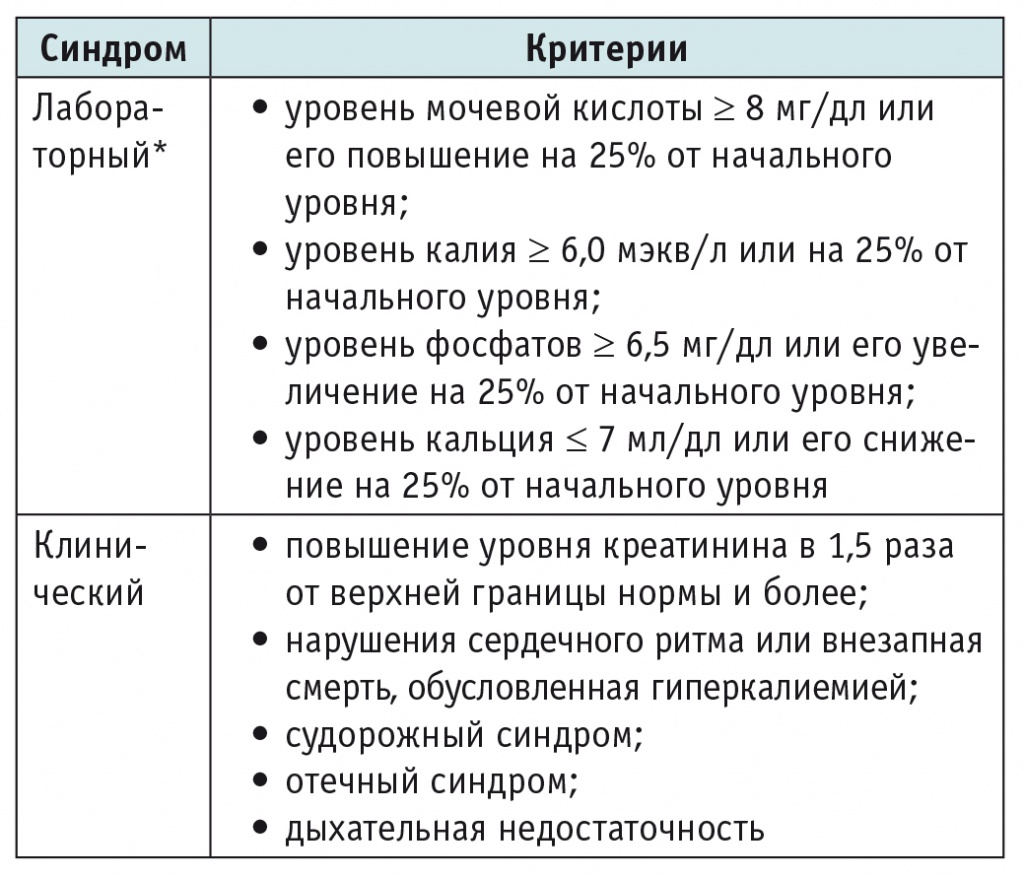
* Лабораторный синдром острого лизиса опухоли включает два критерия или более в период трех дней до начала химиотерапии и семи дней после ее проведения.
Значительную часть рассматриваемой группы наших пациентов, получивших ПЗТ, составляли дети после трансплантации гемопоэтических стволовых клеток (ТГСК). Это был практически каждый четвертый больной, находившийся на продленном диализе (18 пациентов, 26%). Согласно литературным данным, перегрузка жидкостью более чем на 20% является независимым фактором риска летального исхода у критически больных детей после ТГСК. При этом начало ПЗТ улучшает оксигенацию у пациентов после ТГСК, по крайней мере, в первые 48 часов после начала терапии. Однако выживаемость среди детей после ТГСК, кому потребовалось одновременное проведение ИВЛ и диализной терапии, согласно литературным данным, варьирует от 0 до 17%[16].
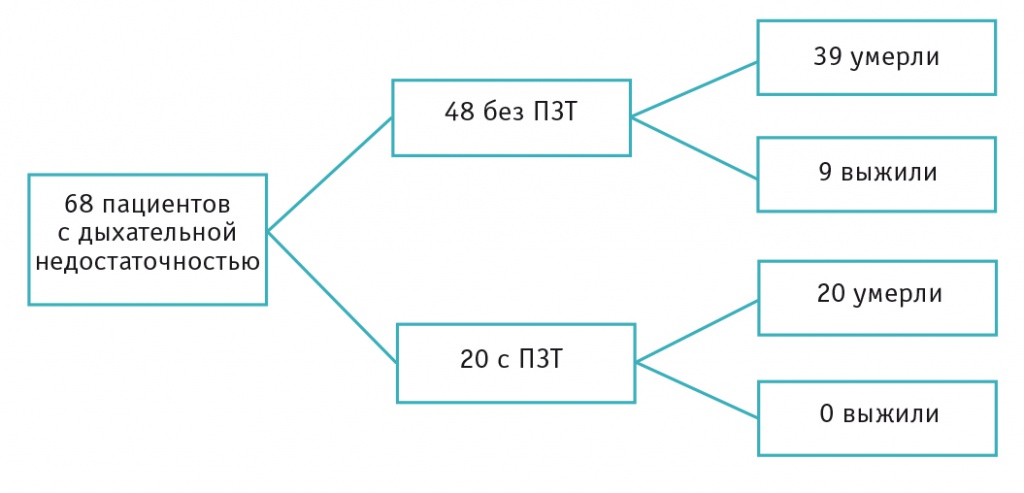
В работе С. Gilbert и соавт. (2013) был проведен анализ лечения 319 пациентов после ТГСК[12]. Из них у 68 (21,3%) развилась дыхательная недостаточность, потребовавшая ИВЛ. У 20 пациентов (6,3%), наряду с дыхательной недостаточностью, развилась почечная недостаточность, потребовавшая ПЗТ. Тридцатидневная, госпитальная и общая смертность у всех пациентов, которым проводили ИВЛ, составила соответственно 55,9% (38 из 68), 63,2% (43 из 68) и 86,8% (59 из 68).
У тех пациентов, которым проводили ИВЛ и ПЗТ одновременно, тридцатидневная, госпитальная и общая смертность составила соответственно 60,0% (12 из 20), 90,0% (18 из 20) и 100% (20 из 20). Общая смертность у пациентов, которым потребовалась ИВЛ без ПЗТ, составила 81,3% (39 из 48) (рис. 1)[17].
Рис. 1. Результаты выживаемости реанимационных пациентов после трансплантации гемопоэтических стволовых клеток, которым проводили искусственную вентиляцию легких и почечно-заместительную терапию (ПЗТ)[17]
Среди наших пациентов, перенесших ТГСК и получавших ПЗТ, летальность в 2012–2014 гг. составила 55%. Низкие показатели выживаемости, на наш взгляд, объясняются крайней степенью тяжести состояния, как правило, наличием тяжелой полиорганной недостаточности, аплазии кроветворения, тяжелых инфекционных проблем смешанной (бактериально-грибково-вирусной) этиологии. Это подтверждается и литературными данными[19].
По данным J. H. Chewning и соавт., на основе анализа 132 детей, которым проводили ТГСК, показано, что распространенность почечной недостаточности на 30-й день после ТГСК может превышать 50% с летальностью на 100-й день после ТГСК выше 70%[15]. Авторы исследования выявили, что наличие ОПП на 30-й день после ТГСК ассоциировано с летальностью до 100-го дня после трансплантации. Вместе с тем не было показано статистически значимого влияния ОПП на летальность в конце первого года после трансплантации (табл. 7).
Таблица 7
Распространенность острой почечной недостаточности (ОПП) и летальность среди детей после трансплантации гемопоэтических стволовых клеток (ТГСК)[15]
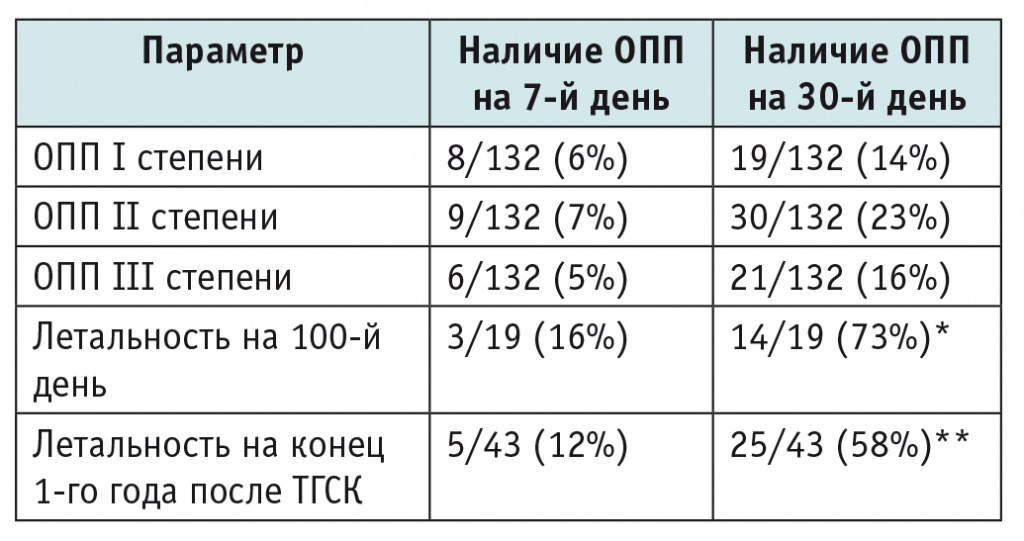
* P = 0,05.
** P = 0,4.
Примечание. Частота ОПП разной степени рассчитана в процентах от общего количества обследованных детей, летальность — от общего числа летальных случаев в указанные сроки.
Среди наших пациентов после ТГСК у 8 (44,4%) человек показанием к началу ПЗТ была ОПП в структуре полиорганной недостаточности, у 5 (27,8%) — сепсис, у 3 (16,7%) — анурия и у 2 (11,1%) — нарастающая азотемия. Среднее значение мочевины на момент начала ПЗТ в данной группе пациентов составило 16,8 ± 6,2 ммоль/л, а креатинина — 110,7 ± 53,4 мкмоль/л.
Проведение ПЗТ характеризуется некоторым процентом осложнений. Более ранний возраст пациентов (< 12 месяцев), а следовательно, и меньшая масса тела (< 10 кг) ассоциированы с определенными трудностями обеспечения сосудистого доступа, что может встречаться, по литературным данным, у 10% детей[10, 23, 27]. Среди других осложнений, связанных с проведением острого диализа у детей, отмечают гипотензию (до 30% случаев; как правило, ее возникновение не связано с теми или иными характеристиками пациента или типом выполняемой процедуры) и клинически значимый геморрагический синдром (до 10% случаев)[27].
Проблемы при катетеризации имели место у 11 (15,9%) из 69 наших пациентов, а клинически значимый геморрагический синдром, потребовавший прекращения ПЗТ, наблюдали у 3 детей (4,3%).
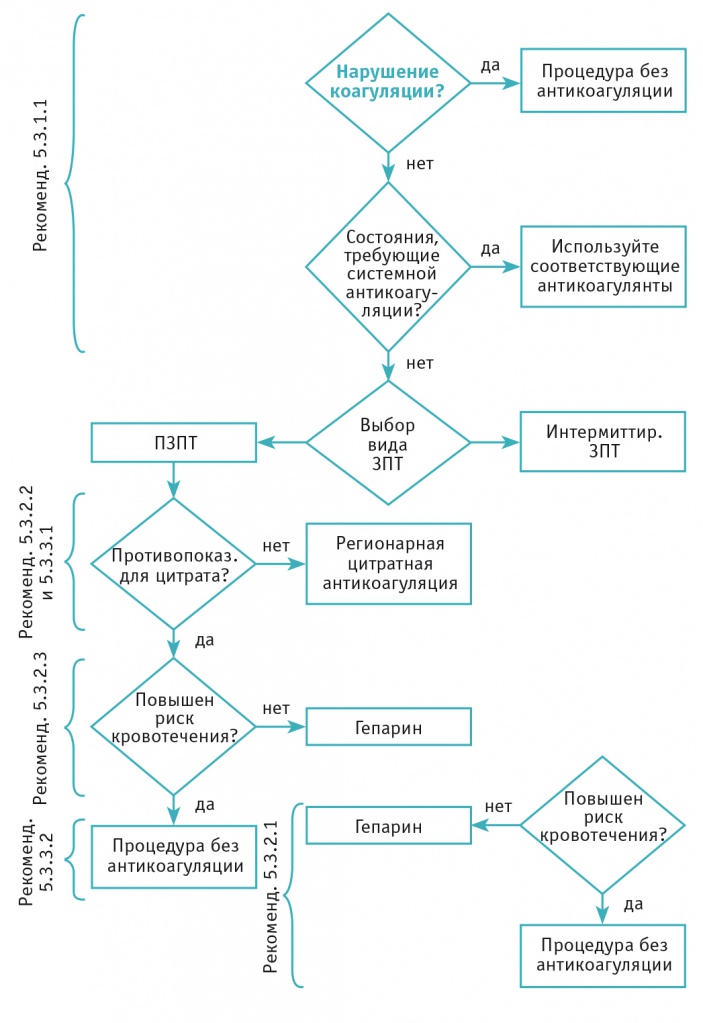
В связи с риском развития геморрагических осложнений, при проведении экстракорпоральных технологий достаточно пристальное внимание уделяют антикоагуляционной терапии. Согласно рекомендациям KDIGO[20], у больных без высокого риска кровотечения или нарушений коагуляции при проведении интермиттирующего диализа следует использовать антикоагуляцию нефракционированным или низкомолекулярным гепарином (эти средства предпочтительнее других антикоагулянтов). При продленной ПЗТ рекомендуется применять регионарную антикоагуляцию цитратом (предпочтительнее, чем использовать гепарин) у больных, не имеющих противопоказаний для введения цитрата (рис. 2).
Рис. 2. Оценка потенциального риска и пользы антикоагулянтов в соответствии с практическими рекомендациями Kidney Disease: Improving Global Outcomes (2012)[20]
В качестве стандартной поддерживающей дозы гепарина при ПЗТ рекомендовано использование 10–20 ЕД/кг/ч (табл. 8)[7].
Таблица 8
Рекомендации по антикоагулянтной терапии
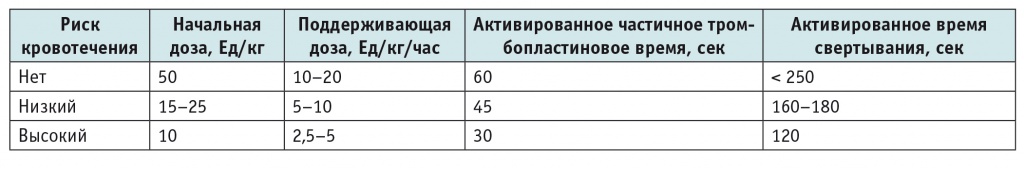
Однако практически все пациенты онкогематологического профиля, имея индуцированную химиотерапией или обусловленную основным заболеванием аплазию кроветворения, имеют и низкий уровень тромбоцитов, а также нередко нарушения коагуляционного гемостаза, причиной которых является печеночная недостаточность. Так, средний уровень тромбоцитов на момент начала ПЗТ составлял 59 × 109/л, протромбиновый индекс — 56,3 ± 22,7%, а показатель фибриногена — 2,43 ± 1,29 г/л.
В 80% случаев мы использовали существенно меньшие дозы гепарина — как правило, около 5–10 Ед/кг/ч, а в 20% случаев доза гепарина была меньше 5 Ед/кг/ч или не использовалась вообще.
Кроме того, необходимо сказать, что до недавнего времени мы старались воздерживаться от переливания тромбоцитарной массы у пациентов, находящихся на диализе, опасаясь тромбирования сета. Однако это переливание у пациентов при экстремально низкой тромбоцитопении, на первый взгляд, не сопровождалось уменьшением сроков службы сетов, и мы хотели бы показать это в дальнейшем в разработанном и спланированном исследовании.
Все бо́льшую актуальность из-за высокого риска кровотечений в данной группе пациентов приобретает гемодиализ с регионарной цитратной антикоагуляцией. Такой метод мы использовали в 2012–2014 гг. у 4 (5,8%) пациентов.
Ряд исследований продемонстрировал достаточную эффективность и безопасность цитратного диализа даже у маленьких детей. Так, в работе 2014 г. J. Soltysiak и соавт. проводили ретроспективный анализ 30 критически больных детей: 16 пациентам выполняли регионарную цитратную антикоагуляцию (РЦА-ПЗТ) и 14 — антикоагуляцию гепарином (ГА-ПЗТ), длительность ПЗТ составляла по меньшей мере 24 часа[21]. Средний вес детей — 8,69 ± 5,63 кг. Среднее время на РЦА-ПЗТ и ГА-ПЗТ — 148,73 ± 131,58 и 110,24 ± 105,38 часа соответственно. Продолжительность работы сета была значительно выше при РЦА-ПЗТ, чем при ГА-ПЗТ. Использование цитратного диализа у маленьких детей характеризовалось более продолжительной жизнью сета (58,04 ± 51,18 часа против 37,64 ± 32,51 часа; p = 0,03) и бо́льшим процентом выживаемости детей (37% против 14%). Однако в группе цитратного диализа чаще наблюдали электролитные и метаболические нарушения. Кроме того, основным противопоказанием для использования цитрата является наличие печеночной недостаточности.
Летальность среди детей, нуждающихся в проведении ПЗТ, так же как и среди взрослых, достигает 50%[2, 19, 28]. Синдром полиорганной недостаточности встречается в педиатрических реанимациях, по данным литературы, у 30–50% детей с летальностью (особенно при сепсисе), по результатам некоторых исследований, до 90%[16, 19].
Показано, что больший процент перегрузки жидкостью (более 20%) ассоциирован с повышенной летальностью, более длительным восстановлением функции почек, а также с более продолжительной ИВЛ, более длительным прбыванием в реанимационном отделении и с бо́льшей длительностью общей госпитализации[16, 19, 23, 24].
Среди других факторов, влияющих на летальность у детей с ОПП, отмечают позднее начало ПЗТ (по прошествии более чем 5 суток от начала заболевания), при котором летальность выше, чем при раннем начале (менее 5 суток), с отношением шансов 1,56 (95%-ный ДИ: 1,02–2,37). Независимыми предикторами летальности являются более выраженная тяжесть состояния на момент поступления пациента в отделение реанимации и интенсивной терапии, оцениваемая по шкале Pediatric Risk Of Mortality, онкологический диагноз как основная нозология и малый вес ребенка[10, 23].
Среди наших пациентов общая летальность составила 63% и в подавляющем большинстве случаев была обусловлена синдромом полиорганной недостаточности.
ЗАКЛЮЧЕНИЕ
В интенсивной терапии детей с онкогематологическими заболеваниями ПЗТ становится одним из основных методов лечения наряду с ИВЛ. Однако, несмотря на возможности раннего протезирования почечной функции у детей онкогематологического профиля, выживаемость среди пациентов, получающих данный вид терапии, остается чрезвычайно низкой, что является отражением общей тяжести состояния пациентов.
Высокий риск геморрагического синдрома на фоне аплазии кроветворения, нарушения коагуляционного гемостаза актуализируют более широкое внедрение РЦА-ПЗТ, не сопряженной с риском увеличения частоты осложнений и уменьшения продолжительности жизни сета. В перспективах развития данного вида лечения намечается использование колонок, обработанных полимиксином, в терапии тяжелого сепсиса и септического шока, вызванных полирезистентной грамотрицательной флорой.








