Цель исследования: выявить биомаркеры транзиторного и персистирующего фенотипов синдрома бронхиальной обструкции у детей раннего и дошкольного возраста.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективное когортное клиническое исследование был включен 101 ребенок с рецидивирующим СБО — 60 мальчиков (59,4%) и 41 девочка (40,6%) в возрасте от 1 года до 6 лет, получавшие лечение в Детской городской клинической больнице № 2 г. Астрахани в период с 2010 по 2011 г.
Критериями включения детей в клиническое исследование являлись:
- возраст от 1 года до 6 лет;
- патогномоничные признаки бронхиальной обструкции;
- наличие трех и более эпизодов СБО в течение года;
- информированное добровольное согласие родителей на участие в исследовании.
- ОРВИ, перенесенная в предшествующие 3 недели;
- рентгенологические признаки инфильтрации легочной ткани;
- наличие врожденных пороков развития челюстно-лицевой зоны, сердечно-сосудистой системы и респираторного тракта, бронхиальной астмы (БА), бронхолегочной дисплазии, а также генетических дефектов, сопровождающихся первичной или вторичной дыхательной недостаточностью.
Иммунологическое исследование включало: определение относительного количества Т- и В-лимфоцитов в периферической крови; исследование фагоцитарного звена иммунитета с определением процента фагоцитоза (ПФ) и индекса фагоцитоза (ИФ), оценкой функциональной активности фагоцитов с использованием спонтанного и индуцированного теста с нитросиним тетразолием (НСТ-тест); изучение в сыворотке крови уровней иммуноглобулинов (IgA, IgG, IgM) иммуноэлектрофоретическим методом [3] и интерлейкинов (IL-1β, IL-4, IL-6, IL-8) «сэндвич»-методом твердофазного ИФА с применением коммерческих наборов производства ООО «Цитокин» (г. Санкт-Петербург).
В ходе динамического наблюдения в течение 6 лет из группы исследования выбыли 18 детей по причине смены местожительства (переезд в другой город или страну), и/или отсутствия первичной медицинской документации, и/или отказа родителей от участия детей в исследовании. Таким образом, под наблюдением остались 83 ребенка.
На основании катамнестических данных были выделены 39 детей с благоприятным исходом заболевания (первая группа с транзиторным СБО, англ. transient wheeze) и 44 ребенка с исходом в БА (вторая группа с персистирующим СБО, англ. persistent wheeze). Диагноз БА верифицировали в соответствии с национальной программой «Бронхиальная астма у детей. Стратегия лечения и профилактика» [1, 2, 4].
В контрольной группе были обследованы 32 условно здоровых ребенка в возрасте от 1 года до 6 лет: 19 (59,4%) мальчиков и 13 (40,6%) девочек. Дети контрольной группы в течение 4 недель, предшествовавших обследованию, не болели вирусными и бактериальными инфекциями.
Исследования проводились на основе собственных наблюдений и данных медицинской документации в соответствии с текущей версией Хельсинкской декларации по медицинским исследованиям [5] при условии отсутствия необходимости в дополнительных заборах крови или амбулаторных посещениях.
Статистическая обработка полученных данных выполнена с использованием пакета SPSS Statistics 17.0 for Windows (SPSS Inc., США) и Microsoft Office Excel 2007. Описательная статистика представлена в виде М ± m, где М — среднее арифметическое значение, m — среднеквадратичное отклонение. В случае нормального распределения признака использовали количественные переменные. При ненормальном распределении признака и/или малом размере выборки сравнение проводили с помощью непараметрического критерия Манна — Уитни (U) для двух независимых выборок и критерия Краскела — Уоллиса для трех и более независимых выборок. Качественные признаки описаны в виде относительной частоты наблюдений (%). Результаты рассматривали как статистически значимые при р ≤ 0,05.
РЕЗУЛЬТАТЫ
Особенностью иммунной системы у детей как первой, так и второй группы было изменение фагоцитарной активности. Наиболее выраженные нарушения выявлены в системе фагоцитоза. Они характеризовались снижением ПФ у 17 (43,6%) детей с транзиторным СБО (первая группа) и 18 (40,9%) детей с персистирующим СБО (вторая группа); среднее значение ПФ составило 49,6 ± 2,7% и 48,9 ± 2,9% соответственно (р = 0,800; критерий Краскела — Уоллиса). При этом отмечалось усиление поглотительной функции фагоцитов у детей с рецидивирующим СБО по отношению к контрольному показателю. Так, ИФ был повышен у 33 (84,6%) детей с транзиторным СБО и 36 (81,8%) детей с персистирующим СБО; среднее значение ИФ в первой группе составило 17,5 ± 1,1 усл. ед., во второй группе — 16,2 ± 1,2 усл. ед. (в обоих случаях различия с контролем статистически значимы: р = 0,002 и р = 0,020 соответственно; критерий Манна — Уитни).
Снижение поглотительной функции нейтрофилов, способствующее рецидивированию респираторных инфекций, формированию гиперреактивности дыхательных путей, зафиксировано только у 7 (15,9%) пациентов с персистирующим СБО.
Изменения в иммунограмме у детей с рецидивирующим СБО характеризовались усилением функциональных особенностей фагоцитов путем активации кислородозависимых механизмов киллинга у 20 (51,3%) пациентов первой группы и 22 (50,0%) — второй группы. Спонтанный НСТ-тест: 45,2 ± 5,5 усл. ед. (при сравнении с контролем р = 0,003; критерий Манна — Уитни) и 45,4 ± 5,9 усл. ед. (при сравнении с контролем р = 0,020; критерий Манна — Уитни) в первой и второй группах соответственно. Недостаточность кислородозависимого метаболизма фагоцитов определена у 2 (5,1%) пациентов с транзиторным СБО и 5 (11,4%) — с персистирующим СБО.
У детей сравниваемых групп выявлено повышение резервных возможностей фагоцитов в сравнении с контролем. Так, показатель индуцированного НСТ-теста у детей с транзиторным СБО составил 69,6 ± 5,0 усл. ед. (р = 0,040; критерий Манна — Уитни), у детей с персистирующим СБО — 77,9 ± 5,2 усл. ед. (р = 0,009; критерий Манна — Уитни). Интересно отметить снижение результатов индуцированного НСТ-теста у 4 (10,3%) пациентов первой группы и 8 (18,2%) — второй группы.
Изучение показателей активности Т- и В-клеточного звеньев иммунитета у детей с рецидивирующим СБО показало отсутствие статистически значимых отличий обеих основных групп от контроля. Выявленные с помощью рутинных методов диагностики изменения иммунологической реактивности у детей с рецидивирующим СБО не имели межгрупповых различий. Поэтому чрезвычайно важным представлялось исследовать цитокиновую регуляцию врожденного и адаптивного иммунитета с целью изучения цитокинового профиля у детей с транзиторным и персистирующим СБО.
Концентрации IL-4, IL-6, IL-8 в сыворотке крови у обследованных детей статистически значимо различались между группами (р < 0,05; критерий Краскела — Уоллиса). Обращает на себя внимание, что у детей с персистирующим СБО показатели IL-4, IL-6, IL-8 были статистически значимо выше, чем в контрольной группе (р < 0,05; критерий Манна — Уитни), в отличие от пациентов с транзиторным СБО, у которых из трех названных цитокинов статистически значимые различия обнаружены только по уровню IL-6 (рис. 1–3). Показатель IL-1β в обеих группах исследования был близок к контрольному (p > 0,05; критерий Манна — Уитни) (рис. 4). При парном сравнении между первой и второй группами выявлены статистически значимые различия по показателям IL-4, IL-6 и IL-8 (р < 0,05; критерий Манна — Уитни): уровень IL-4 в первой группе составил 4,1 ± 0,4 пг/мл, во второй — 9,9 ± 1,5 пг/мл (р = 0,001); уровень IL-6 у детей с транзиторным и персистирующим СБО был равен 11,7 ± 1,4 пг/мл и 15,5 ± 1,4 пг/мл соответственно (р = 0,025); уровень IL-8 у детей первой и второй групп составил 5,6 ± 0,6 пг/мл и 10,1 ± 1,6 пг/мл соответственно (р = 0,004) (см. рис. 1–3).
Рис. 1. Уровень IL-4 у детей с транзиторным и персистирующим фенотипами бронхообструкции, пг/мл
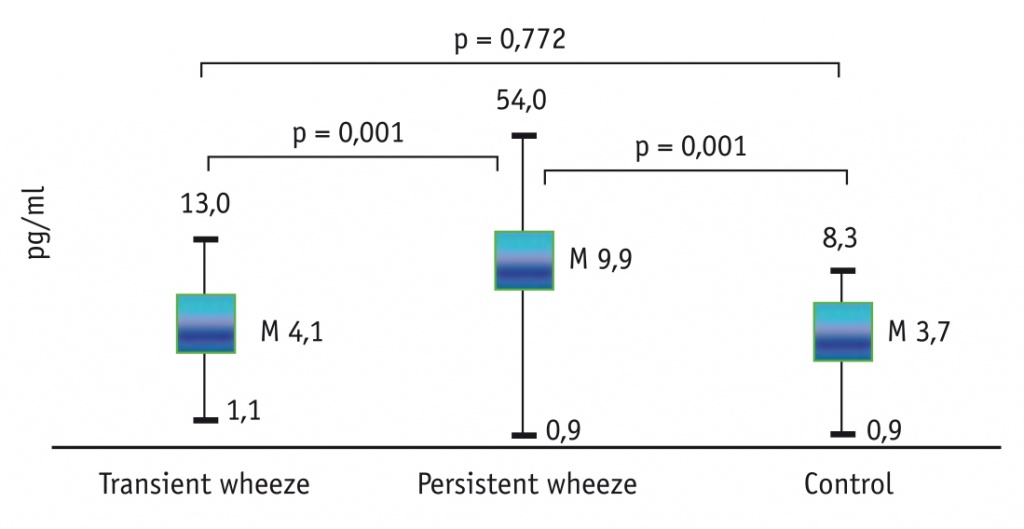
Рис. 2. Уровень IL-6 у детей с транзиторным и персистирующим фенотипами бронхообструкции, пг/мл
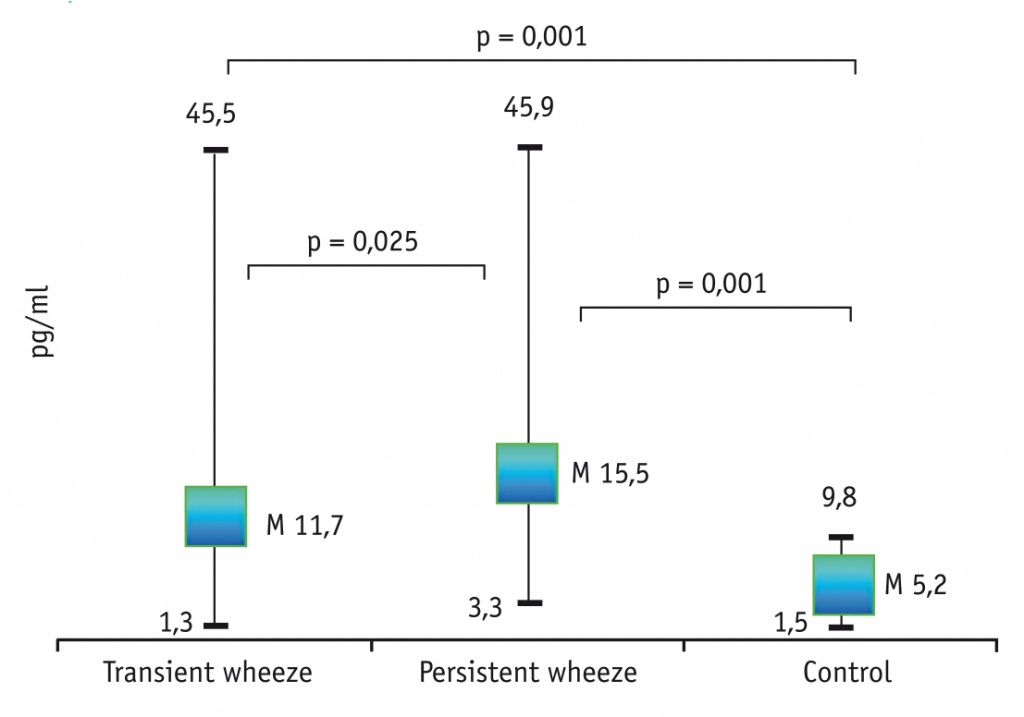
Рис. 3. Уровень IL-8 у детей с транзиторным и персистирующим фенотипами бронхообструкции, пг/мл
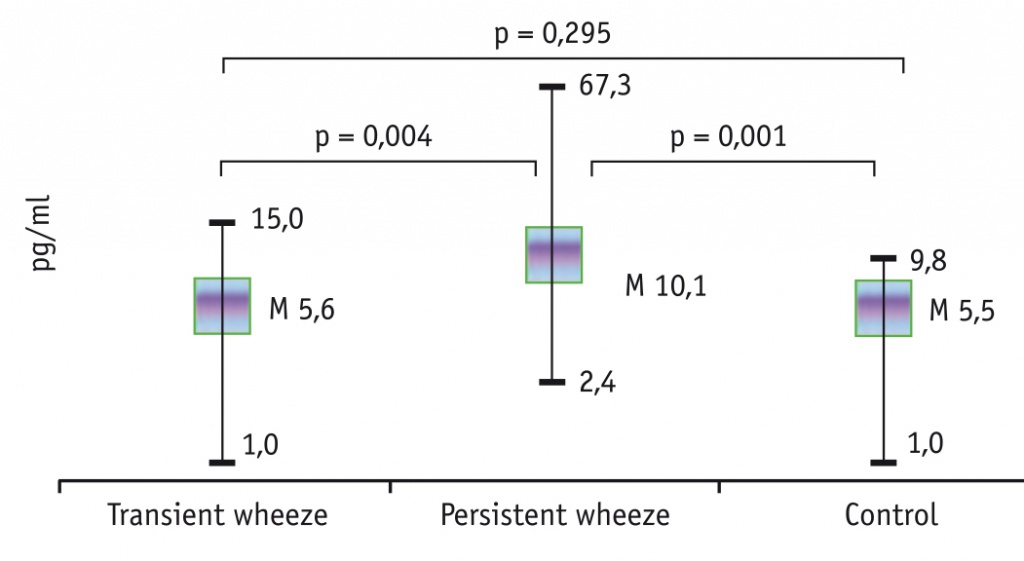
Рис. 4. Уровень IL-1β у детей с транзиторным и персистирующим фенотипами бронхообструкции, пг/мл
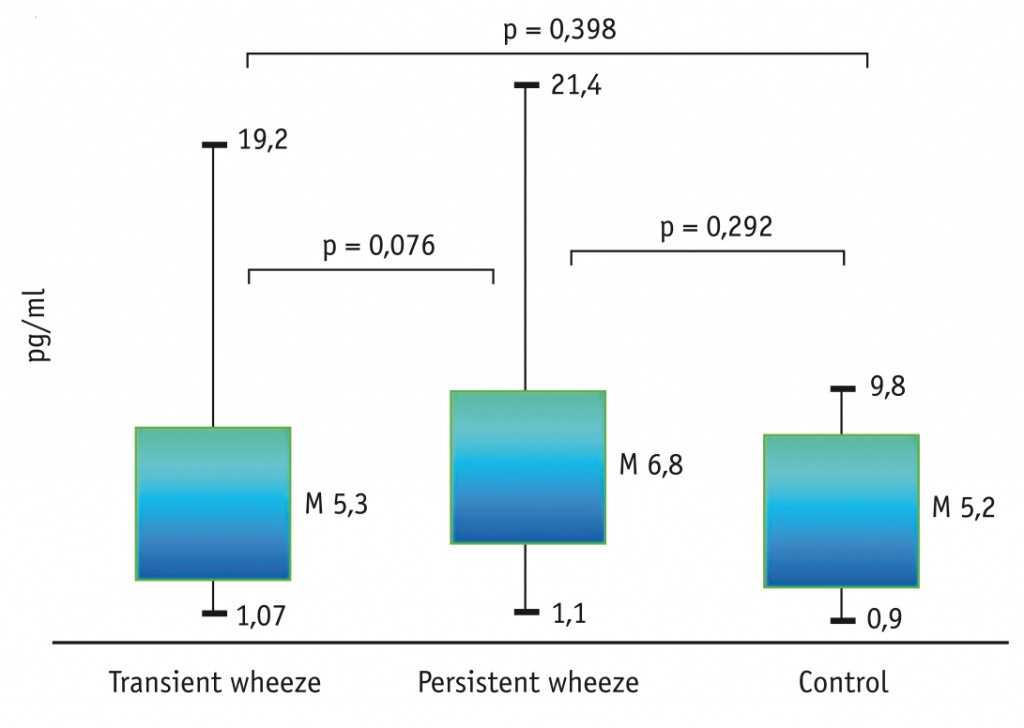
ОБСУЖДЕНИЕ
Результаты исследования свидетельствуют, что у детей с персистирующим фенотипом бронхиальной обструкции вне зависимости от пола и возраста статистически значимо повышаются концентрации как провоспалительных (IL-6, IL-8), так и противовоспалительных цитокинов (IL-4). Клинические данные свидетельствуют о значимости Th2-цитокина IL-4 в поддержании воспаления и формировании бронхиальной гиперреактивности [6–10]. Вместе с тем в ряде исследований показано, что повышение уровней провоспалительных цитокинов является особенностью созревания иммунной системы в раннем возрасте; появляется все больше доказательств того, что экспрессия Th1-цитокинов (IL-1β, IL-8) имеет существенное значение в патогенезе рецидивирующего СБО у детей [10, 11].
В литературе имеются данные, что у детей с рецидивирующим бронхообструктивным синдромом после купирования обструкции сохраняются умеренно высокие уровни провоспалительных цитокинов IL-1β, IL-6, способные стимулировать активность моноцитарно-фагоцитарного звена, и адаптивный иммунитет, который, с одной стороны, направлен на потенцирование бактерицидности, а с другой — способствует поддержанию воспаления, приводя к гиперреактивности дыхательных путей [12].
ЗАКЛЮЧЕНИЕ
У детей с персистирующим фенотипом бронхообструкции отмечается экспрессия медиаторов воспаления, инициирующих как Th2-, так и Th1-иммунный ответ. По-видимому, это объясняется вовлечением в патологический процесс более одного иммунного механизма, запускающего каскад патологических событий, которые направлены на поддержание воспалительных реакций, приводящих к рецидивам бронхообструктивного синдрома.
Высокие уровни IL-4, IL-8 могут быть биомаркерами для исходного фенотипирования рецидивирующего синдрома бронхиальной обструкции у детей раннего и дошкольного возраста с последующим прогнозированием риска развития бронхиальной астмы, что нацелит на персонифицированную профилактику заболевания.








