ВВЕДЕНИЕ
Понтоцеребеллярные гипоплазии (ПЦГ) представляют собой гетерогенную группу аутосомно-рецессивных нейродегенеративных заболеваний, характеризующихся пренатальным началом замедления роста мозжечка, лобных и затылочных областей коры больших полушарий, гипоплазией варолиева моста и ядра олив, микроцефалией, нарушением двигательного и психического развития тяжелой степени и эпилептическими приступами[1].
Термин ПЦГ был впервые предложен R. Brun в 1917 году при описании пороков развития головного мозга[2]. Клиническая картина впервые подробно описана в 1926 году S. Koster[3]. В настоящее время, исходя из особенностей клинической картины и наследования, выделяются одиннадцать подтипов заболевания[4]. При всех наблюдаются прогрессирующая микроцефалия, выраженные нарушения моторного, психического и речевого развития. Распространенность, по данным I.H. Pacheva и соавт., составляет 1 : 200 тыс. новорожденных[5].
Характерные для заболевания дыхательные нарушения, дискинезия, хорея, эпилепсия, тяжелые нарушения развития на фоне прогрессирующей микроцефалии обусловливают неблагоприятный прогноз, в том числе высокую вероятность смерти в позднем младенчестве или в раннем детстве[4, 6, 7]. Плохой прогноз при прогредиентном течении имеет и ПЦГ типа 2А (ПЦГ2А)[8].
Три варианта ПЦГ — типы 2А, 4 и 5 — являются аллельными, обусловленными различными мутациями в гене TSEN54 (здесь и далее — данные в формате международной баз данных OMIM). Выделение этих трех генетических вариантов основано на различии в тяжести клинических проявлений и типах мутаций в гене TSEN54[4, 8].
Наибольшей злокачественностью отличается течение ПЦГ5. Показано, что на долю этой группы приходится около половины всех случаев аутосомно-рецессивных вариантов заболевания[9].
Чаще других подтипов встречается ПЦГ2А, характеризующаяся экстрапирамидными расстройствами и развитием генерализованных дискинезий и хореоатетоидных движений. К настоящему моменту описаны около 80–100 случаев[5].
В исследованиях последних лет показано, что наследуется ПЦГ2А чаще по аутосомно-рецессивному типу[8, 10, 11]; 90% пациентов несут миссенс-мутацию с.919G>T (p.A307S) в гене TSEN54, локализованном на 17-й хромосоме, определяющем клиническую форму заболевания (OMIM 608755). Другие типы ПЦГ2 (ПЦГ2B, ПЦГ2C и ПЦГ2D) вызваны мутациями в разных генах, таких как TSEN2, TSEN34 и SEPSECS соответственно[10, 11].
Ген TSEN54 кодирует субъединицу эндонуклеазного комплекса сплайсинга транспортной РНК, который катализирует удаление интронов из предшественников транспортной РНК[8]. Молекулы РНК имеют большое значение для нормального функционирования нейронов. Ген TSEN54 участвует в синтезе и обработке молекул РНК и является «строителем» нейронов мозжечка, варолиева моста и оливарного комплекса.
Механизмы развития фенотипа ПЦГ в настоящее время активно изучаются. По мнению R. Battini и соавт. и I.L. Rudaks и соавт., в основе развития фенотипа ПЦГ лежит, вероятно, аномальный синтез РНК[12, 13].
Наиболее распространенный и относительно менее злокачественный вариант ПЦГ — ПЦГ2А. Он манифестирует с рождения, но характеризуется умеренными нарушениями дыхания и вскармливания, дискинезиями, хореическими гиперкинезами, мышечной гипотонией, спастичностью, эпилептическими приступами, прогрессирующей микроцефалией и отсутствием структурных изменений в спинном мозге. Показано, что на долю этого генетического варианта приходится около половины всех случаев аутосомно-рецессивных ПЦГ[12–14].
Клинические проявления могут фиксироваться внутриутробно, обычно же заболевание проявляет себя уже в 1-е сутки после рождения видимой микроцефалией, неонатальными эпилептическими приступами, спастическим тетрапарезом и выраженными дыхательными нарушениями, как правило, требующими ИВЛ[11]. Часто дети рождаются с контрактурами конечностей и погибают в период новорожденности или в грудном возрасте, но в ряде случаев доживают до пубертата. По мере развития заболевания микроцефалия усугубляется, и все более прогрессируют нарушения моторного, психического и речевого развития вплоть до тяжелой степени выраженности[11].
Эпилептические припадки отмечаются в большинстве случаев ПЦГ2 (81,5%, по данным Y. Namavar и соавт.), и вероятность их развития увеличивается с возрастом[8]. В некоторых случаях обилие дистонического компонента в картине припадка затрудняет его дифференцировку с дискинезиями экстрапирамидной природы.
Упомянутые выше нарушения структуры головного мозга выявляются при проведении МРТ в виде гипоплазии мозжечка (наиболее выраженной в области гемисфер) и ствола мозга. В 40% случаев они сочетаются с атрофией коры больших полушарий и истончением мозолистого тела[15].
Специфическое лечение ПЦГ2 в настоящее время не разработано. Существенные сложности вызывает подбор противоэпилептической терапии. Причиной тому является сочетание в патогенезе элементов нарушений нейрональной миграции в пренатальном онтогенезе с прогрессирующей атрофией коры головного мозга в постнатальном периоде. Это определяет высокую частоту фармакорезистентных случаев эпилептического процесса при данной патологии.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Представляем описание клинического случая ПЦГ2А пациентки 4 лет 5 месяцев с тяжелым, медленно прогрессирующим нарушением двигательного и психического развития, с эпилептическими и экстрапирамидными пароксизмами. Девочка обследована на базе ГБУЗ «Детская городская поликлиника № 143 ДЗМ», период наблюдения — 2017–2021 гг.
При обращении основные жалобы матери были на длительные приступы напряжения мышц рук, ног, туловища девочки и вычурные движения пальцами, возникающие как в покое, так и при перемене положения тела, длительностью от 20–30 минут до 5 часов с частотой 2–3 раза в неделю. Ее также беспокоили практически недоступный контакт с ребенком, почти полное отсутствие произвольных движений, сходящееся косоглазие, нарушение глотания твердой пищи, девочка плохо следила глазами за движущейся игрушкой, не переворачивалась, плохо держала голову в положении на животе, у нее практически отсутствовала речь.
Перинатальный анамнез не отягощен. Ребенок от 1-й беременности, в третьем триместре выявлены признаки преждевременного старения плаценты, на сроке 28 недель — вагинальный гарднереллез. Роды срочные, самопроизвольные, с эпидуральной анестезией. Масса тела — 3480 г, оценка по шкале Апгар — 9/9 баллов. Состояние при рождении расценивалось как удовлетворительное.
Однако в динамике состояние ребенка ухудшилось. С первых суток жизни возникли признаки угнетения ЦНС, нарушение дыхания (апноэ), пневмопатия, тонико-клонические эпилептические приступы. Переведена в ОРИТ, назначена вальпроевая кислота в каплях. Затем девочку направили на второй этап выхаживания с диагнозом синдрома угнетения ЦНС, неонатальных тонико-клонических приступов, пневмопатии, где она находилась до 1,5 месяцев.
На МРТ головного мозга в возрасте 4 дней — гипоплазия мозжечка. Нейросонографически — существенное расширение большой мозговой цистерны (до 13 мм).
На МРТ головного мозга от 17.11.2014 г. (в возрасте 2 недель жизни): умеренная наружная регионарная гидроцефалия (транзиторная?). Гипогенезия мозжечка.
МРТ всех отделов позвоночника и спинного мозга от 17.11.2014 г. (в возрасте 2 недель) не позволила выявить структурную патологию.
До 3 месяцев пациентку кормили через назогастральный зонд. С 3 месяцев гипотония постепенно трансформировалась в гипертонус. Присоединились ежедневные приступы напряжения мышц рук и ног с элементами торсионной дистонии с хореоатетозными движениями длительностью до 5 часов, возникавшими в покое и при изменении положения тела. Получала плановое стационарное лечение с диагнозом: Последствия перинатального поражения ЦНС, спастический тетрапарез тяжелой степени выраженности, вторичная пароксизмальная дискинезия, врожденная гипоплазия мозжечка, ретроцеребеллярная киста, задержка психомоторного развития.
После самостоятельной отмены матерью вальпроевой кислоты в каплях у девочки в 4 месяца появились эпилептические спазмы. Прием вальпроевой кислоты был возобновлен. С 6 месяцев на фоне применения вальпроевой кислоты в дозе 400 мг в сутки (50 мг/кг/сут) отмечались тонические эпилептические пароксизмы, серийные, до 20 раз в серию, до 3–6 серий в сутки.
Тандемная масс-спектрометрия от 26.05.2015 г. (в возрасте 6 месяцев): данные о наследственных аминоацидопатиях, органических ацидуриях, дефектах митохондриального β-окисления не выявлены.
Цитогенетическое исследование от 06.06.2015 г. (в возрасте 7 месяцев): 46 ХХ.
С 8-месячного возраста видимые припадки не фиксировались.
В 10 месяцев поставлен диагноз: Церебральный паралич, спастико-гиперкинетическая форма, мультифокальная эпилепсия, клиническая ремиссия. Вторичная пароксизмальная дискинезия. Псевдобульбарный синдром. Частичная атрофия зрительных нервов. Гипоплазия мозжечка. Нарушения психического и речевого развития тяжелой степени.
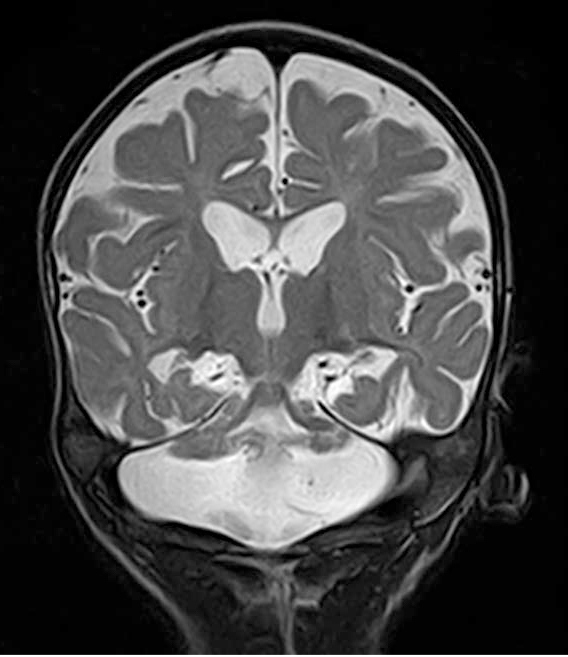
МРТ головного мозга в динамике от 07.07.2015 г. (в возрасте 10 месяцев): на Т2-взвешенных изображениях гиперинтенсивные участки в перивентрикулярном белом веществе с распространением в подкорковые структуры с обеих сторон (задние бедра внутренних капсул и подушки зрительных бугров), наводящие на мысль о гипомиелинизации. В трех проекциях отчетливо прослеживаются признаки диффузной атрофии вещества больших полушарий конечного мозга (рис. 1); заместительная наружно-внутренняя сообщающаяся гидроцефалия, расширение субарахноидальных пространств по конвексу лобно-теменных областей, увеличение боковых желудочков (рис. 2). Сагиттальные и фронтальные срезы демонстрируют истончение мозолистого тела, истончение ствола головного мозга и гипоплазию моста (рис. 3), гипоплазию мозжечка с преобладанием поражения его полушарий и относительной сохранностью червя — феномен «стрекозы» (рис. 4). Заместительно увеличена церебелломедуллярная цистерна (рис. 5). В сравнении с МРТ от 17.11.2014 г. — отрицательная динамика.
Рис. 1. Диффузная атрофия вещества больших полушарий конечного мозга. Здесь и далее в статье иллюстрации авторов
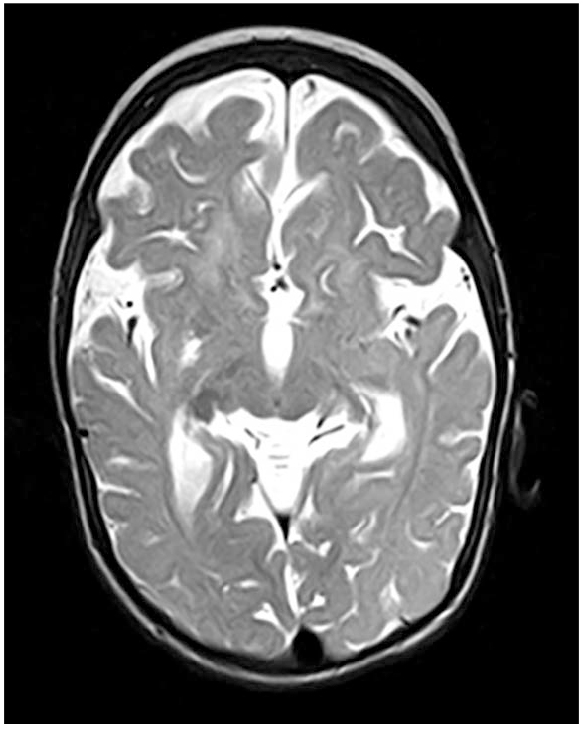
Рис. 2. Расширение субарахноидальных пространств по конвексу лобно-теменных областей, увеличение боковых желудочков
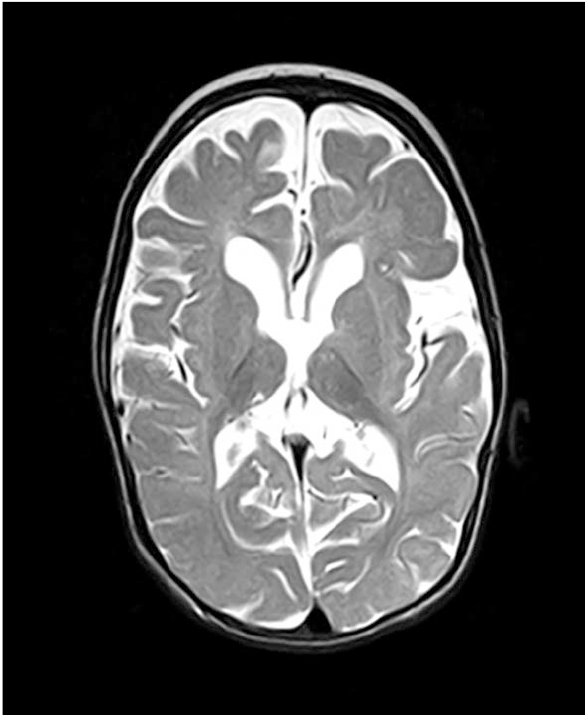
Рис. 3. Истончение ствола головного мозга и гипоплазия моста
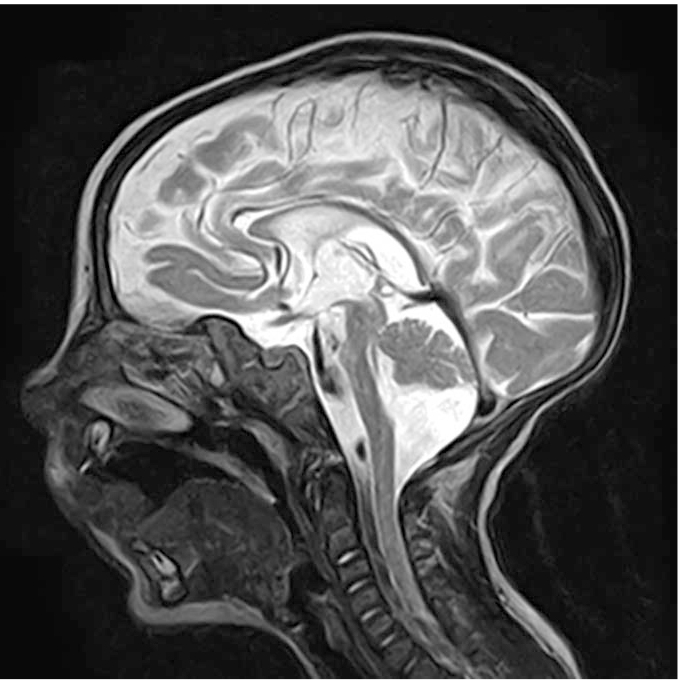
Рис. 4. Феномен «стрекозы»
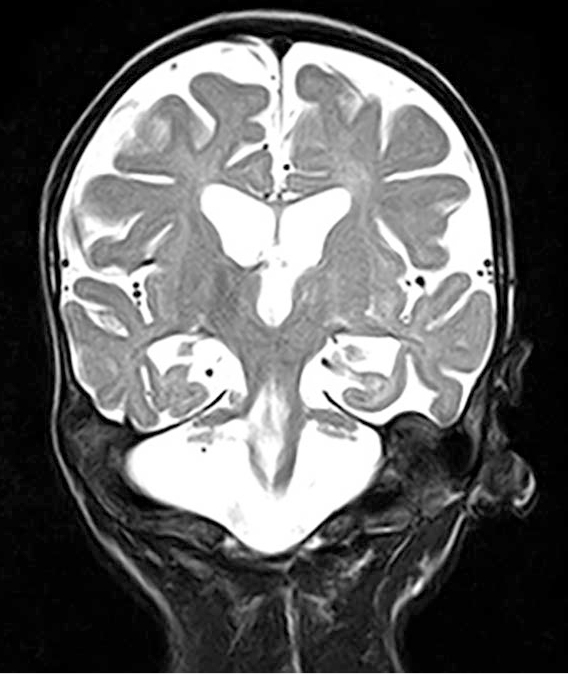
Рис. 5. Заместительно увеличенная церебелломедулярная цистерна
С 10 до 14 месяцев жизни не регистрировалась эпилептиформная активность на ЭЭГ. В возрасте 14 месяцев у пациентки усилились приступы напряжения мышц рук и ног с элементами торсионной дистонии с хореоатетозными движениями длительностью до 6 часов в сутки, ежедневно возникавшими в покое. При проведении ЭЭГ-видеомориторинга в 14 месяцев выявлены два вида пароксизмов: дистонические пароксизмы и эпилептические приступы субклинического характера.
С этого времени девочка последовательно получала в возрастных дозировках зонисамид (отменен из-за вялости, снижения массы), леветирацетам (на фоне приема отмечено улучшение в эмоциональном статусе при нарастании эпилептиформной активности на ЭЭГ), клоназепам и вигабатрин — без эффекта. Ламотриджин вызвал повышение тонуса, тромбоцитопению, увеличение шейных лимфатических узлов. Дистонические пароксизмы сохранялись.
Зрительные вызванные потенциалы 15.04.2016 г. (в возрасте 1,5 года): признаки деафферентации по зрительным путям на исследованных уровнях.
Зрительные вызванные потенциалы от 26.05.2017 г. (в возрасте 2,5 года): данные о признаках деафферентации по зрительным путям на исследованных уровнях. Острота зрения на уровне 0,01–0,03. По сравнению с предыдущим исследованием от 15.04.2016 г. отмечена положительная динамика. Прогноз для улучшения функции проводящих путей зрительного анализатора благоприятный.
По результатам секвенирования ДНК (панель «Наследственные эпилепсии»), проведенного в медико-генетическом центре «Геномед» 01.02.2017 г. (в возрасте 2 лет 3 месяца), найдена ранее описанная гомозиготная мутация в экзоне 8 гена TSEN54 (chr17:73518081G>T, rs113994152), приводящая к замене аминокислоты в 307 позиции белка (p.Ala307Ser, NM_207346.2). Мутация описана в гомозиготной форме и компаунд-гетерозиготной форме вместе с другими мутациями у пациентов с ПЦГ типов 2А, 4 и 5 (OMIM: 608755#0001). Частота мутации в контрольной выборке ExAC составляет 0,1229%. По совокупности сведений, мутацию следует расценивать как патогенную.
Анализ жалоб (медленное прогредиентное ухудшение моторного, психического и речевого развития, приступы торсионной дистонии с хореическими гиперкинезами, возникающими в покое), анамнеза (неотягощенный перинатальный анамнез, доношенный ребенок с оценкой по шкале Апгар 9/9 баллов, рожденный в удовлетворительном состоянии с нормальной массой и длинной тела), клинической картины и данных параклинического обследования (отрицательная динамика на МРТ головного мозга, гомозиготная мутация в экзоне 8 гена TSEN54) позволили выставить диагноз: Понтоцеребеллярная гипоплазия 2А типа. Спастический тетрапарез. V уровень по Gross Motor Function Classification System. Псевдобульбарный синдром. Вторичная пароксизмальная дискинезия. Мультифокальная эпилепсия, клиническая ремиссия. Выраженное нарушение психического развития тяжелой степени. Отсутствие экспрессивной и импрессивной речи.
Результаты ЭЭГ-видеомониторинга от 06.12.2018 г. (возраст — 4 года 1 месяц): во время бодрствования и во сне зарегистрирована мультифокальная эпилептиформная активность, в проекции левой лобной доли — с выраженной тенденцией к распространению на близлежащие отделы полушария, контралатерально, с формированием разрядов комплексов «пик — медленная волна». Эпилептиформная активность регистрировалась в структуре устойчивого продолженного дельта-замедления корковой ритмики; в проекции левой задневисочно-затылочной области (Т5-О1) и, независимо, в правой затылочно-задневисочной области (Т6-О2) — с тенденцией к диффузному распространению в виде биокципитальных разрядов, сгруппированных комплексов «пик — медленная волна» различной степени синхронизации с выраженной тенденцией к диффузному распространению.
Многократно в состоянии бодрствования — короткие эпизоды быстроволновой ритмической активности (fast activity) на фоне диффузного электродекремента серийного характера.
Указанные ЭЭГ-паттерны не ассоциировались с убедительными отчетливо видимыми клиническими проявлениями и расценены как субклинические паттерны. Индекс представленности эпиактивности во время бодрствования в пределах средних, на отдельных эпохах — ближе к высоким значениям. Во сне отмечено нарастание индекса до высоких значений.
На рисунках 6–8 представлены эпохи видео-ЭЭГ-мониторинга пациентки с ПЦГ2А в возрасте 4 лет 1 месяца.
Рис. 6. В ходе видео-ЭЭГ-мониторинга регистрируются продолженные бифронтальные, бифронто-центро-темпоральные и диффузные разряды различной степени билатеральной синхронизации комплексов «острая — медленная волна», «полипик — волна» на фоне фронтальной периодической ритмической дельта-активности
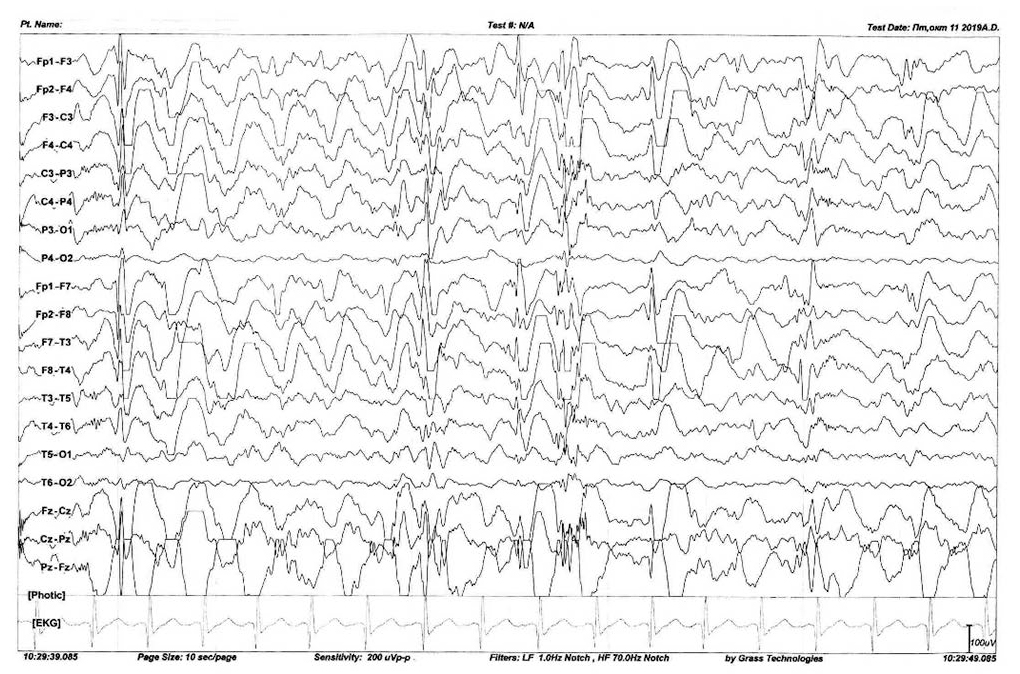
Рис. 7. В период проведения видео-ЭЭГ-мониторинга регистрируются короткие диффузные разряды низкоамплитудной быстроволновой активности, возникающие на фоне кратковременной супрессии корковой ритмики — ЭЭГ-паттерн тонического спазма. Указанные паттерны протекали субклинически
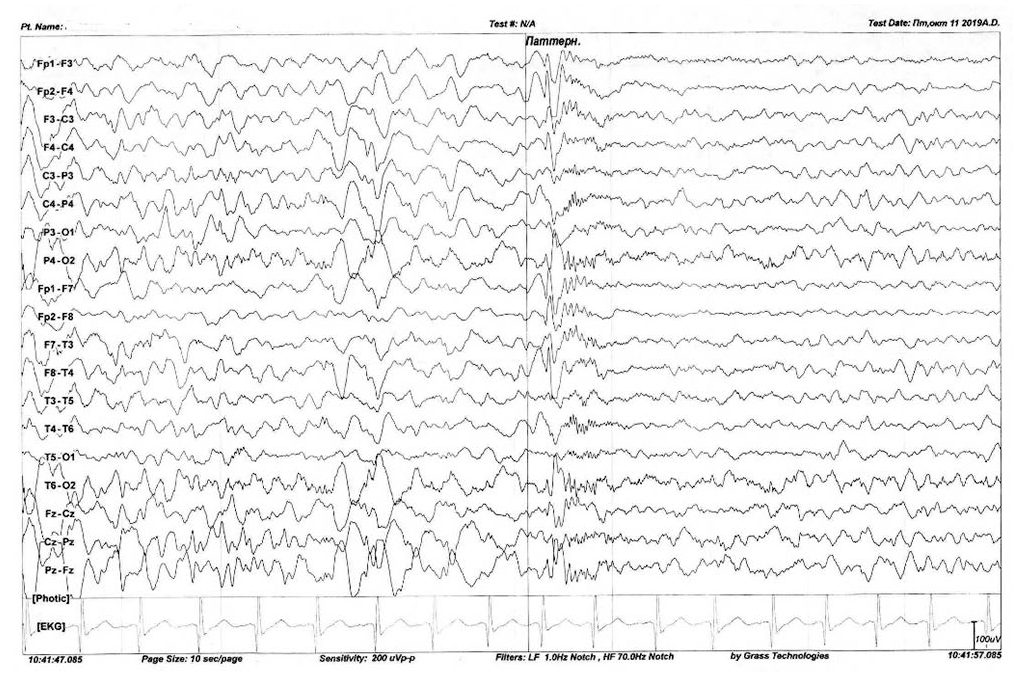
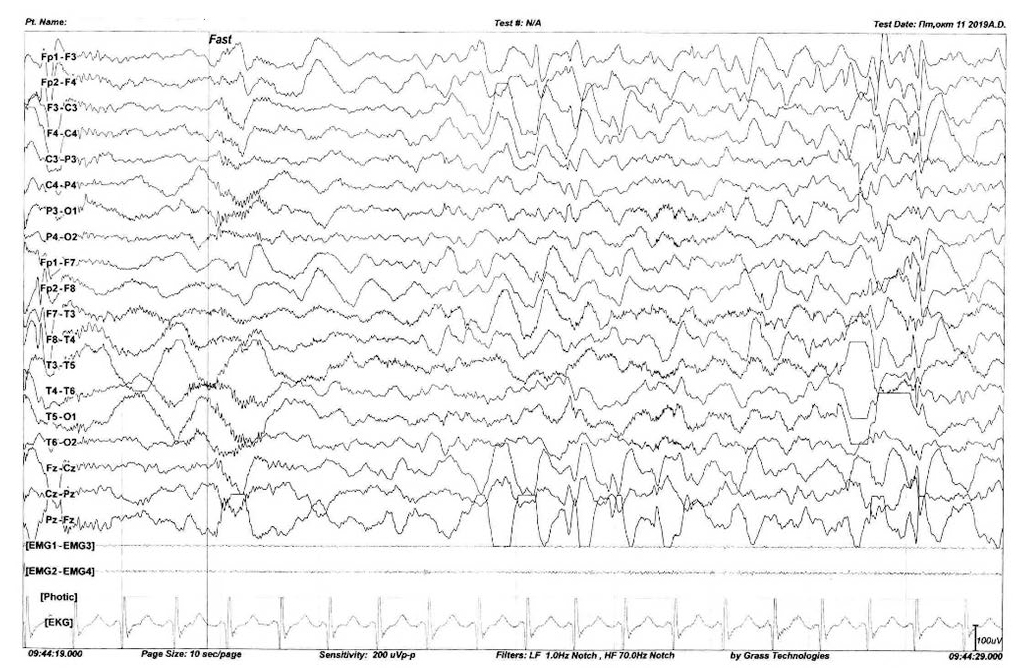
Рис. 8. В ходе видео-ЭЭГ-мониторинга выявляются диффузное и бифронтальное дельта-замедление, короткие диффузные разряды низкоамплитудной быстроволновой активности, мультирегиональная и диффузная эпилептиформная активность
Объективно: ребенок 4 лет 5 месяцев, пониженного питания (гипотрофия II), масса — 15 кг. В сознании, но дезориентирована, контакту мало доступна. Менингеальной симптоматики нет. Грубое отставание в психическом и речевом развитии. В речи — элементы гуления. Интеллект существенно снижен. Дифференцирует близких, иногда улыбается.
Микроцефалия (окружность головы — 44 см), «плавающие» движения глазных яблок, двустороннее сходящееся косоглазие. Гиперсаливация. Гипомимия. Проявления псевдобульбарного синдрома. В двигательно-рефлекторной сфере — спастический тетрапарез с акцентом в верхних конечностях.
Оценка тонуса мышц по шкале Ashworth — 3 балла симметрично в руках и ногах. Контрактур нет. Гипотрофии мышц средней степени выраженности. Отмечались кратковременные приступы напряжения мышц рук и ног с элементами торсионной дистонии с хореоатетозными движениями, которые провоцировались изменением положения тела. Контроль за тазовыми функциями отсутствует. В положении лежа голову удерживает кратковременно. Не переворачивается. Будучи посаженной, сидит с поддержкой «с круглой спиной» непродолжительное время.
На основании полученных данных осмотра и в соответствии с диагнозом, верифицированным генетически в 2 года 3 месяца, терапия была дополнена перампанелом в дозировке 4 мг/кг/сут. При длительных (более 2 часов) пароксизмальных дискинезиях был рекомендован диазепам per rectum в возрастной дозе.
После установления диагноза девочка наблюдалась у нас еще 3 года. На фоне терапии отмечена положительная динамика в виде уменьшения частоты и продолжительности вторичных пароксизмальных дискинезий с 2 раз до 1 раза в неделю, длительностью от нескольких минут (купирующихся самостоятельно) до нескольких часов (купирующихся диазепамом). Однако медленно прогрессировало нарушение психического развития тяжелой степени. Экспрессивная и импрессивная речь по-прежнему отсутствовала.
ОБСУЖДЕНИЕ
Анализируя представленный клинический случай, мы выделили клинические и нейровизуализационные признаки, по которым можно заподозрить ПЦГ2А на первом году жизни. Нормально протекающая беременность, доношенность, росто-весовые показатели в норме, высокий балл по шкале Апгар, однако фенотип первичной микроцефалии, в первые сутки жизни — дыхательные расстройства в виде эпизодов апноэ, судороги, двигательные нарушения, вторичные дистонии, задержка психомоторного развития, при нейровизуализации определяется гипоплазия мозжечка.
Названные клинические и нейровизуализационные отличия согласуются с описанием отечественных авторов клинической картины и результатов нейровизуализации у пяти пациентов с ПЦГ2А[16].
Мутация TSEN54 p.Ala307Ser является самой частой при ПЦГ2А. В статье авторы предлагают при подозрении на любую ПЦГ применять следующий диагностический алгоритм: «… диагностика начинается с анализа мутации с.919G>T (p.Ala307Ser). При ее обнаружении в гомозиготном состоянии диагноз считается уточненным. При обнаружении мутации в гетерозиготном состоянии поиск этиологического фактора необходимо продолжить с помощью секвенирования экзома нового поколения»[16].
Проведение видео-ЭЭГ-мониторинга позволило в нашем случае дифференцировать эпилептический и экстрапирамидный генез пароксизмов и вывести на первый план неэпилептические моторные расстройства. Согласно литературным данным, эффективным для лечения экстрапирамидных расстройствах было применение препаратов леводопы[11], однако в нашем случае удалось добиться значимого клинического эффекта назначением перампанела, подавляющего глутаматергическую передачу импульсов на постсинаптическом уровне, селективно связывающегося с ионотропными α-амино-3-гидрокси-5-метил-4-изоксазол-пропионат глутаматными рецепторами на постсинаптических нейронах. Данный факт может указывать на своеобразие патогенеза двигательных расстройств при рассматриваемой патологии за счет участия в нем глутаматергической системы мозга.
Важна своевременная дифференциальная диагностика церебрального паралича с клинически сходными генетическими заболеваниями[17, 18]. Верификация диагноза в 2 года у нашей пациентки позволила внести ясность в течение и прогноз болезни[15]. Родители информированы о клиническом прогнозе ПЦГ2А, что улучшило комплаенс.
Реабилитация не была противопоказана. Родители проводили реабилитацию в полном объеме, что позволило избежать формирования контрактур и облегчить уход. Мать пациентки владеет приемами Войт-терапии.
Данный клинический случай демонстрирует важность своевременного генетического обследования для назначения адекватной медикаментозной терапии и своевременной физической реабилитации.
В нашем случае родители обратились к генетику и верифицировали генетический диагноз у ребенка в 2 года, так как планировали деторождение и хотели определить риск болезни у будущих детей. Семье был разъяснен 25% риск повторного рождения больного ребенка с ПЦГ вне зависимости от пола[19]. Родителей информировали о возможности проведения доимплантационной (с ЭКО) или дородовой (на сроке беременности 10–11 недель) ДНК-диагностики[20–22]. Родители учли наши рекомендации, в настоящее время проходят ЭКО.
ЗАКЛЮЧЕНИЕ
Своевременная генетическая диагностика у детей с фенотипом микроцефалии и церебрального паралича позволяет выйти на этиологический диагноз, определить тактику лечения, реабилитационный прогноз и помогает в дальнейшем планировать рождение в семье здоровых детей.
Поступила: 19.03.2022
Принята к публикации: 04.07.2022








