ВВЕДЕНИЕ
Синдром короткой кишки (СКК) — это морфофункциональная форма хронической кишечной недостаточности, обусловленная утратой части кишечника вследствие хирургического вмешательства или заболевания, что приводит к зависимости от парентерального питания (ПП)[1].
В педиатрии СКК чаще всего является исходом пороков развития, диффузных нейро- и миопатий кишечника или неонатальных заболеваний кишечника, приводящих к обширным кишечным резекциям. Менее существенный вклад в формирование хронической кишечной недостаточности вносят аутоиммунные поражения кишечника, в том числе в рамках первичных иммунодефицитов, врожденные нарушения структуры и нарушения транспортных систем энтероцитов, резекции кишки вследствие травм, новообразований и мезентериальных тромбозов у детей более старшего возраста[1, 2–4].
Распространенность СКК значительно варьирует во взрослой (2–3 случая на 100 тыс. населения) и детской (24,5–30,0 случаев на 100 тыс. живорожденных) популяциях[1–3]. Отмечается значительный рост данной патологии у детей благодаря современным возможностям неонатальной хирургии и распространению современных технологий выхаживания недоношенных и детей с экстремально низкой массой тела, угрожаемых по развитию некротических энтероколитов[5, 6]. Социальную значимость проблемы определяет высокая смертность в когорте детей с СКК, низкое качество жизни таких детей и их родителей, а также высокие расходы на здравоохранение, определяемые сложной многоэтапной курацией и обеспечением детей с СКК питанием, средствами медицинского назначения и лекарственными препаратами.
Значительные успехи в разработке специальных сложных питательных растворов для ПП, создание центров мультидисциплинарных команд специалистов по кишечной реабилитации, появление технологии длительного домашнего ПП позволили значительно увеличить продолжительность и качество жизни детей с хронической кишечной недостаточностью, уменьшить смертность в этой непростой категории пациентов — выживаемость при СКК в настоящий момент превышает 90%[1–3, 7, 8].
СКК характеризуется широким спектром клинической симптоматики и различных осложнений как самого заболевания, так и длительно применяемого ПП. Целью специалиста, курирующего ребенка с хронической кишечной недостаточностью, является достижение полной кишечной автономии, т.е. независимости от ПП[7], для достижения которой сегодня используется широкий спектр техник энтеропластики[2, 3, 10], до применения тедуглутида — синтетического аналога глюкагоноподобного пептида-2, повышающего функциональную возможность энтероцитов к всасыванию нутриентов, на фоне физиологического роста ребенка и, соответственно, длины тонкой кишки — протяженности поверхности всасывания, так называемая кишечная адаптация[11]. Потенциальные возможности кишечной адаптации у детей выше, чем у взрослых, и связаны с продолжающимся ростом и развитием кишки. Средняя длительность достижения кишечной автономии у детей составляет 2 года[1–3].
У ребенка, находящегося на ПП, вполне ожидаемы ранние и поздние осложнения, связанные с центральным венозным доступом (катетер-ассоциированные инфекции, тромбозы), метаболические расстройства (энцефалопатия, лактат-ацидоз, желче- и мочекаменная болезни), дефицитные состояния (анемии различного генеза, нарушение минеральной плотности костной ткани, нарушения роста и нутритивный дефицит), хронические болезни печени (стеатогепатоз, гепатит, холангит, фиброз и цирроз печени), синдром бактериальной транслокации (синдром избыточного бактериального роста) и пр. (таблица)[1–3, 12].
Таблица
Осложнения синдрома короткой кишки[1, 2, 4]
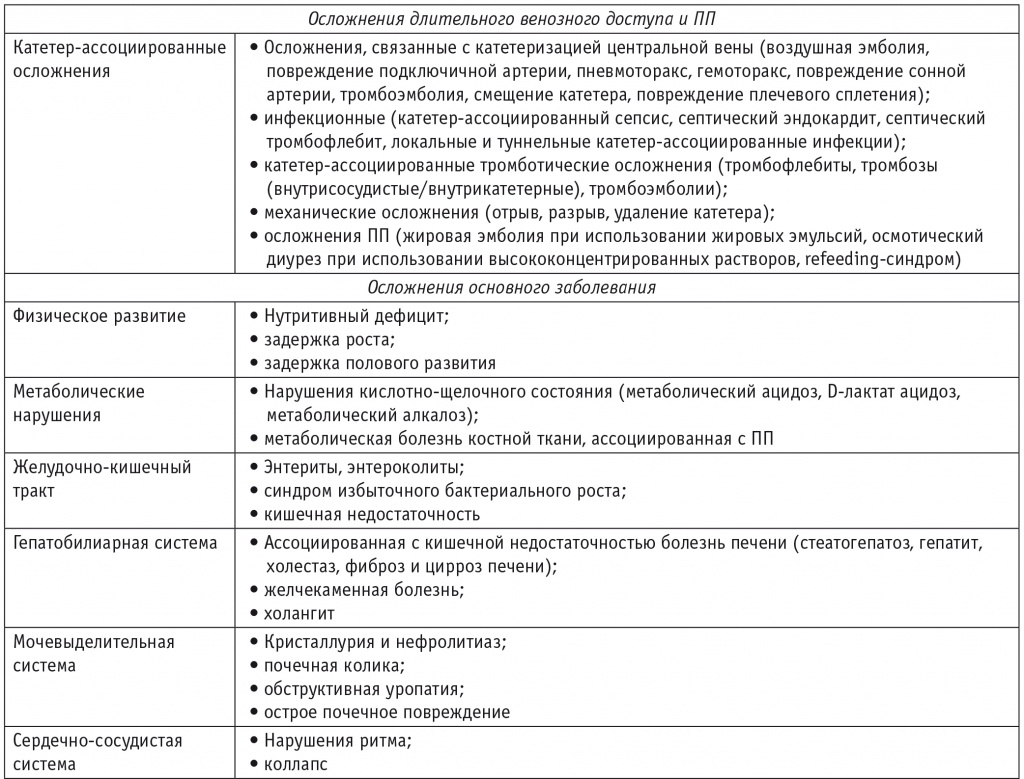

Однако даже после достижения кишечной автономии, когда наблюдение за таким ребенком, уже не такое детальное и частое, осуществляется в амбулаторных условиях педиатрами и гастроэнтерологами, сохраняются риски различных нежелательных явлений, связанных с нарушением анатомической структуры желудочно-кишечного тракта и утратой его части. Снижение инфекционного риска не уменьшает высокую вероятность задержки физического развития, дефицитных состояний, метаболических расстройств и синдрома избыточного бактериального роста у таких детей[1, 2]. Данные о частоте отдаленных последствий среди детей с СКК крайне скудно представлены в отечественной и иностранной литературе.
Приводим клиническое наблюдение ребенка 13 лет спустя 10 лет от приобретения кишечной автономии с отдаленными последствиями пострезекционного СКК.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Мальчик 13 лет поступил в гастроэнтерологическое отделение Университетской детской клинической больницы (УДКБ) ПМГМУ им. И.М. Сеченова в октябре 2021 г. с жалобами на снижение аппетита, эпизодическую рвоту и неустойчивый стул, ноющие боли в верхних отделах живота, отставание в физическом развитии, быструю утомляемость и сниженную успеваемость, головокружение, ухудшение зрения, снижение чувствительности в ногах.
Ранний анамнез до 2 лет. Известны отрывочные сведения (ребенок приемный — в семье с 2 лет): информации о наследственности и течении родов, неонатального периода нет, к 2 годам отмечалась задержка моторного развития (пошел в 2 года), речевого развития (речь простыми предложениями с 3 лет). Профилактическая вакцинация по индивидуальному календарю (часто болеющий ребенок), аллергоанамнез не отягощен, детских инфекционных заболеваний не переносил. Мальчик наблюдается у эндокринолога с диагнозом «кишечная низкорослость».
Анамнез заболевания. В 1-е сутки жизни оперирован по поводу атрезии подвздошной кишки (резекция кишки), в послеоперационном периоде повторная резекция тонкой кишки (некроз выделенного участка тонкой кишки). На длительном ПП, синдром мальнутриции, мальдижестии, мальабсорбции. В 10 мес. перенес повторную операцию: разделение спаек, реконструкция тонко-толстокишечного анастомоза. Затем длительно наблюдался в Российской детской клинической больнице РНИМУ им. Н.И. Пирогова МЗ РФ с диагнозом: «Нарушение кишечного всасывания. Синдром короткой кишки пострезекционный. Состояние после многократных оперативных вмешательств — множественной резекции тонкой кишки. Низкорослость. Нутритивный дефицит II–III степени. Метаболическая болезнь костной ткани. Дисметаболическая нефропатия. Латентный дефицит железа». На длительном сочетанном энтерально-парентеральном питании. Центральный венозный катетер удален в 2011 г. в связи с достижением кишечной автономии. Далее нерегулярное наблюдение амбулаторно. С 2019 г. периодически у пациента возникают боли в животе, тошнота, эпизоды рвоты на фоне погрешностей в диете, аппетит стойко снижен. В декабре 2019 г. находился на госпитализации в отделении гастроэнтерологии УДКБ Сеченовского Университета с диагнозом «Эрозивный рефлюкс-эзофагит. Эрозивный гастрит, Н. рylori-негативный. Стеатогепатоз. Спленомегалия. Дисфункция билиарного тракта. Реактивные изменения поджелудочной железы». В терапии: ингибитор протонной помпы (ИПП) эзомепразол, панкреатин микрокапсулированный, миотропные спазмолитики, пробиотики — с клиническим эффектом. При повторных госпитализациях в связи с изменениями в копрограмме (синдром колита), стойким абдоминальным болевым синдромом проведена илеколоноскопия — явления анастомозита. Также обращали внимание явления стеатогепатоза, гепатоспленомегалии, низкой непрямой гипербилирубинемии (общий билирубин до 35 мкмоль/л). К терапии (курс ИПП, микрокапсулированного панкреатина) дополнительно получил курс месалазина с тонкокишечным высвобождением, 40 мг/кг/сут. На фоне нарушений в диете (употребление молочных продуктов) отмечали возникновение тошноты и рвоты, болей в животе, головокружение, кратковременную потерю сознания. Мальчик был доставлен бригадой скорой медицинской помощи в ГБУЗ «Морозовская ДГКБ ДЗМ» с предварительным диагнозом «нарушение кишечного всасывания, обострение хронического гастрита», где после исключения острых причин нарушения сознания была рекомендована повторная плановая госпитализация в гастроэнтерологическое отделение УДКБ.
При поступлении: состояние средней тяжести. При осмотре отмечается задержка физического развития: рост 130 см (–2,74 SDS — низкорослость), вес 22,3 кг (–2,51 SDS), ИМТ 13,2 кг/м2 (–2,63 SDS — нутритивная недостаточность II степени). Подкожная жировая клетчатка развита недостаточно, распределена равномерно. Кожные покровы и слизистые оболочки бледно-розовые, чистые, эластичность и тургор кожи удовлетворительные. Периферические лимфоузлы — подчелюстные до 0,5 см, безболезненные, подвижные. При аускультации легких везикулярное дыхание, хрипов нет. Границы относительной тупости сердца не расширены, тоны сердца приглушены, ритмичны, функциональный шум в проекции верхушки сердца. Язык обложен бело-желтым налетом. Передняя брюшная стенка с множественными постоперационными рубцами, без признаков воспаления и несостоятельности. Живот мягкий, болезненный в эпигастральной области, зоне Шоффара, точке Кера, чувствителен в правой подвздошной области. Размеры печени и селезенки пальпаторно не изменены. Стул оформленный, регулярный, без патологических примесей. Мочеиспускание свободное, безболезненное. Симптом поколачивания отрицательный.
При рутинном лабораторном обследовании: в гемограмме — признаки гиперхромной макроцитарной среднетяжелой анемии (HCT 26,3%, HGB 88 г/л, MCH 38,5 пг, MCHC 333 г/л, MCV 115,7 фл, PLT 314 × 109/л, RBC 2,28 × 1012/л, RDW 21,9%, цветовой показатель 1,16, WBC 4,8 × 109/л, BAS 0%, LYM 72%, MON 5%, NEUT 21,2% (b 1%, s 17%), EOS 5%, ESR 5 мм/ч); показатели общеклинического анализа мочи, копрограммы, биохимического анализа крови (АСТ, АЛТ, общий белок, билирубина фракции, ЩФ, ГГТ, глюкоза, СРБ, сывороточное железо, ферритин, церулоплазмин, кальций, фосфор, протеинограмма), иммунограммы (IgA, IgM, IgG), коагулограммы (МНО, фибриноген, протромбин, АЧТВ) — в пределах референсных значений. Цианкобаламин крови 50 пг/мл (норма 187–883 пг/мл).
Реакция пассивной гемагглютинации с иерсинеозным, сальмонеллезным, шигеллезным диагностикумом: Anti-Shigella flexneri I–V, VI и Anti-Shigella sonnei, Anti-Salmonella A, B, C1, C2, D, E, Anti-Yersinia pseudotuberculosis и Anti-Yersinia enterocolitica — не обнаружено.
Данные инструментального обследования. УЗИ органов брюшной полости — эхо-признаки диффузных изменений печени, спленомегалии, уплотнения стенок желчного пузыря, реактивных изменений поджелудочной железы, минимальных структурных изменений стенок толстой кишки. Илеоколоноскопия: зона анастомоза с множественными эрозиями и язвами, покрытыми фибрином (анастомозит). Слизистая слепой, ободочной, сигмовидной и прямой кишки бледно-розовая с четким сосудистым рисунком, сохранной анатомической структурой, равномерным просветом (морфологически: картина илеита умеренной активности).
Эзофагодуоденоскопия: эрозивный гастрит, недостаточность кардии нижней трети, гастрит антрального отдела. Хелпил-тест отрицательный (слизистая антрального отдела — нет уреазной активности).
Консультирован неврологом: B12-ассоциированная полинейропатия, атаксия.
Осмотр эндокринолога: низкорослость алиментарная (кишечная).
Развернутый (полный) клинический диагноз. Основной диагноз: Синдром короткой кишки, синдром нарушенного кишечного всасывания. Состояние после резекции тонкой кишки от 15.09.2008, наложения тонко-толстокишечного анастомоза от 10.05.2009. Осложнения: В12-дефицитная анемия II степени. B12-ассоциированная полинейропатия, атаксия. Низкорослость алиментарная. Нутритивная недостаточность II степени. Синдром избыточного бактериального роста, анастомозит. Сопутствующий диагноз: рефлюкс-эзофагит. Хронический гастрит, не ассоциированный с H. pylori, обострение. Стеатогепатоз. Дисфункция билиарного тракта. Реактивные изменения поджелудочной железы.
Терапия: основной вариант стандартной диеты Стол № 5 с ограничением цельномолочных продуктов, пищевое страхование полимерными изокалорийными формулами в объеме 500 мл/сут, ИПП (эзомепразол 20 мг/сут), панкреатин микрокапсулированный, цианокобаламин 300 мкг/сут в подкожных инъекциях, фолиевая кислота 0,4 мг/сут, месалазин 1 г/сут.
Клинический эффект в виде купирования абдоминального болевого синдрома на 5-е сутки терапии. Осмотр через 1 мес после госпитализации: жалоб нет, активен, аппетит сохранен, +2 кг массы тела, в гемограмме — без патологических изменений.
ЗАКЛЮЧЕНИЕ
В описанном клиническом наблюдении у ребенка с множественными оперативными вмешательствами — протяженной резекцией тонкой кишки, СКК и зависимостью от ПП в анамнезе в настоящее время, несмотря на достигнутую 10 лет назад кишечную автономию, наблюдается множество отдаленных осложнений в виде синдрома мальабсорбции, дефицитных состояний — осложненной В12-дефицитной анемии, задержки физического развития (среднетяжелый нутритивный дефицит и низкорослость)[13]. Данные серии иностранных и отечественных наблюдений взрослых и детей с СКК показали ожидаемое при резекции подвздошной кишки, особенно ее терминального отдела, снижение всасывания жирорастворимых витаминов и витамина В12, бивалентных катионов (кальция, магния, цинка, селена); нарушение обмена желчных кислот, липидов, повышения всасывания оксалата и снижение бактериальной ферментации углеводов[1, 2]. Задержка физического развития — частое и долгосрочное последствие кишечных резекций у детей: так, в ретроспективном катамнестическом поперечном исследовании взрослых, перенесших в детстве тонкокишечную резекцию, получавших ПП в течение в среднем 110 дней, низкорослость отмечалась у 78% исследуемых[15]. Синдром избыточного бактериального роста в условиях отсутствия илеоцекального угла и баугиниевой заслонки приводит к персистирующему анастомозиту.
Таким образом, детям с пострезекционным СКК после приобретения кишечной автономии по-прежнему требуется длительное наблюдение с контролем параметров физического развития, дефицитных состояний (уровней кальция, магния, калия, железа, витамина B12, альбумина, гемоглобина, показателей коагулограммы), минеральной плотности костной ткани. После отказа от ПП показан режим длительного поддерживающего пищевого страхования формулами энтерального питания для профилактики формирования дефицитных состояний и задержки физического развития. Рост и развитие детей следует рассматривать в качестве первичных параметров исхода заболевания[2, 3, 13, 14].
Совет экспертов на тему «Синдром короткой кишки у пациентов детского возраста. Текущее состояние проблемы и лечения пациентов в России», обсуждавший современное состояние проблемы в России, рекомендовал участие различных специалистов (детский хирург, гастроэнтеролог, диетолог, психотерапевт, реабилитолог, клинический психолог, врач по паллиативной медицинской помощи) в лечении детей с СКК[3]. Аналогичное мульдисциплинарное ведение таких пациентов практикуется и иностранными центрами кишечной реабилитации[7, 16]. Очевидно, что дальнейшее диспансерное наблюдение ребенка с СКК после приобретения независимости от ПП не завершается, состав команды и кратность наблюдения могут быть изменены с учетом клинической ситуации. Такой подход позволит своевременно провести эффективную коррекцию выявленных нарушений здоровья у этой сложной категории детей.
Поступила: 03.10.2022
Принята к публикации: 20.10.2022








