Научно-клинические исследования представляют собой основной инструмент изучения эффективности новых методов диагностики, лечения, медицинской реабилитации и других медицинских вмешательств, в том числе с применением новых лекарственных средств (ЛС). Они основаны на проведении организованных на междисциплинарном уровне клинико-лабораторных исследований, «золотым стандартом» которых являются многоцентровые проспективные рандомизированные контролируемые (сравнительные) клинические исследования, а также популяционных исследований с оценкой эффективности применения изучаемого вмешательства[3, 5]. При этом в первом случае объектом исследования служат отдельные пациенты или группы пациентов, объединенных какой-либо нозологией, а во втором — группы населения (определенные популяции).
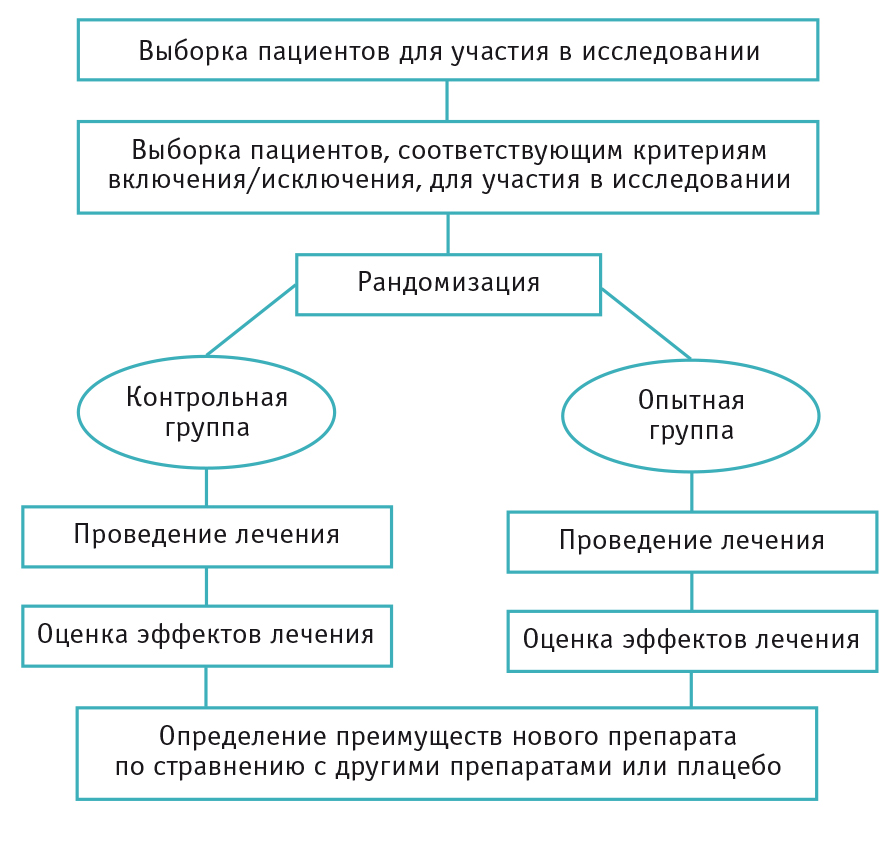
Любое экспериментальное клиническое исследование проводят с целью сравнения определенного вмешательства (например, нового ЛС или новой программы, протокола лечения и/или профилактики заболевания) с отсутствием лечения или с применением стандартных видов лечения, а также с целью изучения связи определенного эффекта с обусловившей его причиной. Экспериментальные исследования всегда проспективные. Их дизайн предполагает отбор определенной категории пациентов из общей популяции, распределение участников по группам сравнения, наблюдение в течение заданного периода времени, определение исходов, обусловленных применением нового ЛС, метода лечения или другого вмешательства (рис. 1). Экспериментальные клинические исследования — основа разработки и применения современных методов научных исследований в медицине. Их проведение сопряжено со значительными трудностями, которые не встречаются при постановке классического лабораторного эксперимента. Эксперимент в лаборатории подразумевает строго контролируемые условия и небольшой набор переменных, в то время как на результаты клинических исследований оказывают влияние разнообразные факторы окружающей среды.
Рис. 1. Пример дизайна экспериментального клинического исследования (рисунок авторов)
Экспериментальные исследования обладают целым рядом преимуществ перед другими методами эпидемиологических исследований. Рандомизированные контролируемые клинические исследования позволяют оценить эффективность и безопасность нового ЛС или другого вмешательства с минимальной вероятностью систематической ошибки. Рандомизация (случайное распределение пациентов на группы) дает возможность сформировать группы пациентов, сопоставимые по продолжительности и тяжести заболевания, полу, возрасту, сопутствующим заболеваниям и терапии, и устранить влияние различных факторов (как известных, так и неизвестных) на результаты лечения[6].
При включении пациентов в экспериментальное исследование ученый или группа ученых собирают подробную информацию об исходном состоянии определенных параметров, а затем получают аналогичную информацию через установленные промежутки времени в динамике наблюдения. Таким образом, исследователи могут постоянно контролировать изменения переменных в ходе исследования, регулировать дозу изучаемого ЛС или комбинации ЛС, а также интенсивность вмешательства[1].
Контрольные группы, в которых проводят лечение с уже известной эффективностью и переносимостью или применяют плацебо (отсутствие лечения), предоставляют возможность количественно оценить влияние нового ЛС или другого вмешательства на исход.
Недостатки экспериментальных исследований связаны прежде всего с тем, что жесткие критерии отбора пациентов приводят к формированию весьма однородной выборки, это ограничивает возможности обобщения полученных результатов и их распространения на пациентов другого возраста, пола, расы и больных, страдающих сопутствующими заболеваниями или получающих другие средства. Так, в клинических исследованиях принимает участие ограниченное число тщательным образом отобранных пациентов, которые получают лечение и находятся под наблюдением в течение ограниченного срока и в контролируемых искусственных условиях. При изучении хронических заболеваний принципиально важно длительное наблюдение за пациентами для определения исходов лечения. Это приводит к существенному повышению затрат, вероятности потерь пациентов в ходе наблюдения, а также к отсрочке получения научно обоснованных рекомендаций по лечению.
Для подтверждения различий эффективности и безопасности протоколов лечения в исследуемой и контрольной группах обычно необходим большой объем выборки, особенно при значительной вариабельности ответа пациентов на проводимое лечение. Большой размер выборки обусловливает высокую стоимость клинических исследований, а включение в исследование достаточного числа пациентов может представлять значительные трудности. Кроме того, при планировании исследования часто возникает целый ряд этических проблем (например, сомнения в допустимости использования плацебо, фазы «отмывки», ограничений сопутствующей терапии и т. д.), не позволяющих оптимально организовать исследование с научной точки зрения.
Соответственно, результаты применения ЛС в рандомизированных клинических исследованиях не позволяют в полной мере прогнозировать результаты их использования в обычной клинической практике.
Фармакоэпидемиологические исследования расширяют представления об эффективности и безопасности нового метода лечения, так как их проводят на больших и неоднородных группах пациентов в течение длительного времени. Таким образом, фармакоэпидемиологические исследования дают возможность изучать не только безопасность, но и терапевтическую эффективность нового препарата, в том числе его влияние на отдаленные исходы.
ВИДЫ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
Проведение клинических исследований новых ЛС необходимо для получения достоверной информации об их эффективности и безопасности и разрешения на применение препарата в клинической практике по определенному показанию. Клиническое исследование дает объективную информацию обо всех сторонах действия ЛС и определяет возможность его клинического использования[10]. Кроме того, результаты таких исследований служат основанием для выработки принципов применения ЛС в клинической практике. При их проведении необходимо получить статистически значимые результаты, не подвергая пациентов необоснованному риску[7].
Клинические исследования можно рассматривать в качестве альтернативы накоплению информации об эффективности и безопасности определенного метода лечения отдельными клиницистами в рамках практической работы. В клинических исследованиях сбор информации проводят систематизированно, в то время как наблюдения из практики врача обычно несистематические, качественные (а не количественные) и более субъективные. С другой стороны, клинические исследования способны дать ответ только на те вопросы, которые были определены при планировании работы. При анализе личного опыта врача иногда удается заметить и такие факторы, возможно, влияющие на безопасность и эффективность лечения, которые не были выявлены в клиническом исследовании.
В настоящее время существуют различные виды клинических исследований. Основная идея любого из них — испытание нового ЛС у пациентов после успешного завершения доклинических исследований (лабораторных исследований in vitro, опытов на животных и фармацевтических исследований), подтвердивших его безопасность, потенциальную эффективность и определивших режим дозирования. В соответствии с положениями Хельсинкской декларации Всемирной медицинской ассоциации, «биомедицинские исследования с участием людей должны <...> основываться на адекватно проведенных лабораторных исследованиях и экспериментах на животных»[11]. В то же время данные, полученные в доклинических исследованиях (в том числе на животных), нельзя прямо экстраполировать на людей, что определяет необходимость дальнейшего изучения.
Дизайн клинических исследований ЛС может различаться по видам изучаемого лечения и терапии сравнения, методикам отбора и распределения пациентов на группы, доступности информации о проводимом лечении для пациентов, врачей-исследователей и представителей спонсора.
При проведении проспективного исследования пациентов отбирают по заранее принятому плану (протоколу) и назначают им исследуемый препарат (метод лечения). В установленные сроки оценивают заранее определенные показатели — выживаемость, смертность, осложнения, рецидивы и т. д. В ретроспективных исследованиях анализируют уже произошедшие события, поэтому в них велика вероятность искажения результатов под влиянием многочисленных факторов.
Самый простой вид клинического исследования — несравнительное исследование, в котором все пациенты получают новое ЛС, а контрольная группа отсутствует. Обычно такие исследования проводят только для оценки определенного эффекта нового ЛС. Достоверные данные могут быть получены только в сравнительных (контролируемых) клинических исследованиях, в которых новое ЛС сравнивают с плацебо или стандартным препаратом, эффективность и переносимость которого известны. Сравнение двух ранее не изученных доз нового ЛС нельзя отнести к контролируемым исследованиям, так как неизвестны эффективность и переносимость обоих методов лечения. В то же время сравнение более высокой дозы препарата с уже изученной дозой можно рассматривать как контролируемое исследование[9].
Контрольную группу иногда составляют пациенты, которые получали определенное лечение в прошлом (исторический контроль) или получают его в настоящее время в рамках стандартного медицинского обслуживания. Другими словами, сравнительные клинические исследования не всегда предусматривают рандомизацию.
В качестве контроля в сравнительных клинических исследованиях могут выступать:
- плацебо;
- другой активный препарат, определенный протоколом исследования;
- пациенты, не получающие никакого лечения;
- пациенты, получающие другую дозу того же препарата;
- пациенты, получающие обычное лечение, которое строго не оговаривается протоколом;
- анамнестические данные включенных в исследование пациентов;
- анамнестические данные других пациентов.
Результаты исследований с историческим контролем менее достоверны, чем результаты проспективных рандомизированных контролируемых исследований, когда пациенты исследуемой и контрольной групп получают лечение одновременно (параллельно). Это связано прежде всего с тем, что в первом случае невозможно добиться достаточного сходства двух групп, так как со временем меняются структура населения, особенности образа жизни, питания и физической активности, качество диагностики и оказания медицинской помощи, а также квалификация врачей, организация работы лечебных учреждений и многое другое. В результате в большинстве исследований с историческим контролем эффективность лечения завышается. Подобные исследования подтверждали преимущества новых препаратов в 84% случаев, а параллельные исследования — только в 11%[20]. По данным B. Spilker, более высокая эффективность новых ЛС была установлена в 44 из 56 клинических исследований с историческим контролем, однако подтверждалась только в 10 из 50 проспективных рандомизированных контролируемых клинических исследований[18].
Чтобы обеспечить равномерное распределение пациентов на группы и добиться их максимального сходства по полу, возрасту, тяжести заболевания и другим показателям, проводят рандомизацию (от английского слова random — случайный). При рандомизации последовательность включения больных в ту или иную группу определяется на основании случайных чисел, сгенерированных компьютером. Выбор группы не зависит от предпочтений врача или пациента. Рандомизация — ключевой аспект и стандарт качества современных клинических исследований. Чтобы еще более сократить разницу между группами, используют стратификацию, или стратификационную рандомизацию, — разделение пациентов на подгруппы в зависимости от наличия какого-либо события в анамнезе, симптома, степени тяжести или осложнения заболевания и т. д.
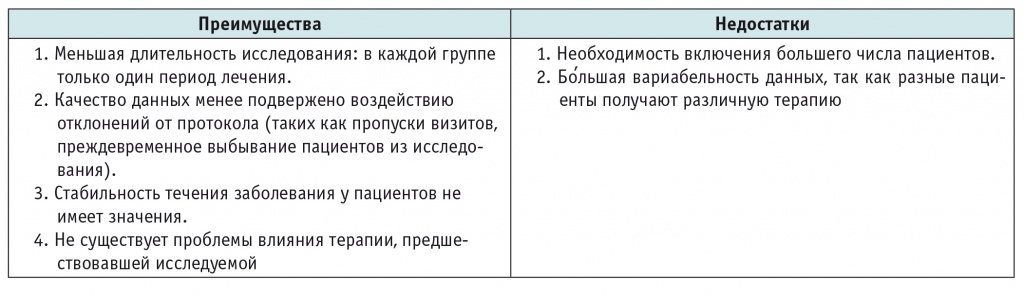
Сравнительные исследования могут быть параллельными или перекрестными. В параллельном исследовании пациенты каждой группы получают только один вид лечения, в то время как в перекрестном исследовании участники, распределенные на группы, получают все варианты лечения, но в разное время и в различной последовательности (рис. 2). Преимущества и недостатки параллельного дизайна по сравнению с перекрестным суммированы в таблице 1[2].
Рис. 2. Схема простейшего перекрестного исследования[5]
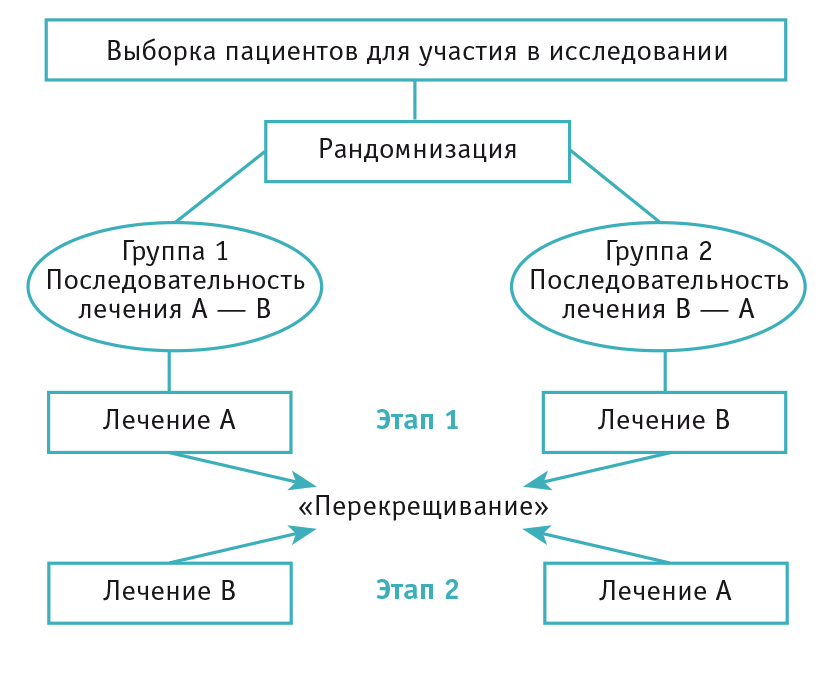
Таблица 1
Преимущества и недостатки параллельного дизайна клинического исследования в сравнении с перекрестным дизайном
Для исключения влияния субъективных факторов на оценку эффекта лечения применяют процедуру «ослепления» (маскирования), когда от пациента и врача скрывают принадлежность пациента к исследуемой или контрольной группе. В простых слепых исследованиях пациент, в отличие от исследователя, не знает, какое лечение ему назначено. В двойных слепых исследованиях эту информацию не имеют ни врач, ни пациент, а в тройных слепых — ни пациент, ни врач, ни организаторы исследования, которые обрабатывают полученные данные. В слепых исследованиях значительно снижается возможность преднамеренных искажений, а непреднамеренные распределяются между группами примерно в равной пропорции и нивелируют друг друга. Слепые исследования более достоверны; в некоторых областях медицины, где невозможно получать объективную информацию о состоянии пациентов с помощью приборов и где высока доля субъективной оценки, они представляют единственно верный выбор.
ФАЗЫ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
Выделяют четыре фазы клинических исследований нового ЛС (рис. 3).
Рис. 3. Общая схема исследований нового лекарственного средства (рисунок авторов)
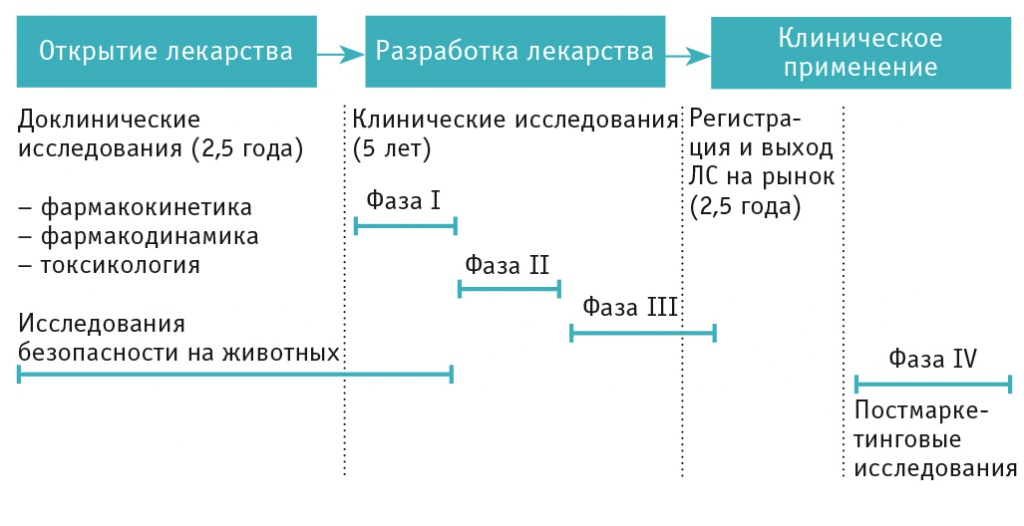
I фаза. Первый опыт применения нового активного вещества у человека. Клинические исследования проводят с участием небольшого числа здоровых добровольцев (10–20 взрослых мужчин). Если новый препарат (например, противоопухолевый) высокотоксичен, то в исследования I фазы включают пациентов с соответствующим заболеванием. Основная цель исследований I фазы — предварительно оценить безопасность и переносимость ЛС (определить наибольшую переносимую дозу, нежелательные явления), изучить фармакодинамику и фармакокинетику, а также решить, стоит ли продолжать его дальнейшую разработку. Изучение 60–80% новых препаратов прекращается на этом этапе из-за проблем с безопасностью.
II фаза. Первые контролируемые исследования ЛС у 100–300 пациентов с заболеванием, для лечения которого планируется применять ЛС. Задачи II фазы — подтверждение терапевтического эффекта, выбор эффективной дозы и режима назначения, а также дальнейшая оценка безопасности и переносимости нового ЛС. После завершения II фазы только треть препаратов продолжают изучать в исследованиях III фазы.
III фаза. Многоцентровые двойные слепые рандомизированные контролируемые клинические исследования с участием больших (и, по возможности, разнообразных) групп пациентов. Обычно в исследованиях III фазы принимают участие 1000–3000 пациентов, однако проводятся и мегаисследования среди 10 000–15 000 пациентов. Их основная цель — получение дополнительных доказательств эффективности и безопасности различных форм нового лекарственного препарата, его терапевтических и фармакоэкономических преимуществ и изучение основных нежелательных лекарственных реакций, возможного взаимодействия с другими ЛС, влияния возраста и сопутствующих состояний на эффективность и безопасность лечения. После успешного завершения III фазы клинических исследований производитель нового ЛС подает документы на регистрацию препарата в соответствующие государственные органы для применения его в клинической практике (см. рис. 3). Однако после исследований III фазы регистрируется только около 25% препаратов.
IV фаза. Пострегистрационные клинические исследования проводят после начала продаж препарата для дополнительной оценки безопасности и результатов длительного применении ЛС у различных групп пациентов (женщин, детей, лиц пожилого или старческого возраста). В данных исследованиях учитываются разнообразные факторы риска, сопутствующие заболевания и терапия.
Пострегистрационные исследования предполагают выявление нежелательных лекарственных реакций, факторов риска их возникновения и определение стратегии применения нового ЛС в клинической практике.
Если зарегистрированное ЛС планируют применять по новому, еще не зарегистрированному показанию, необходимо проведение дополнительных исследований (начиная со II фазы) для регистрации этого показания.
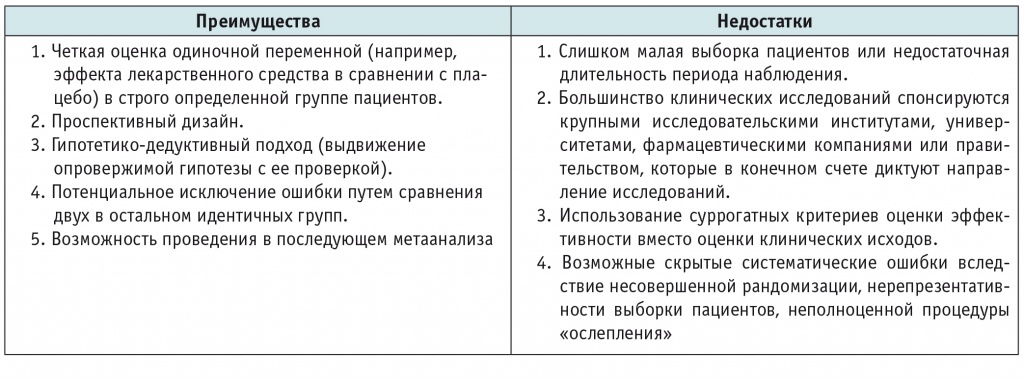
ПРЕИМУЩЕСТВА И НЕДОСТАТКИ РАНДОМИЗИРОВАННЫХ КОНТРОЛИРУЕМЫХ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
Совершенно очевидно, что клинические исследования, особенно рандомизированные контролируемые, являются отличным методом определения преимуществ новых ЛС, подходов к лечению. Рандомизированные контролируемые клинические исследования обычно считают наиболее строгим с научной точки зрения методом, используемым для проверки гипотез. В то же время они не лишены недостатков[15]. Так, рандомизированные контролируемые клинические исследования позволяют судить о способности нового ЛС, вида лечения или вмешательства давать желаемый эффект в «идеальных» условиях, созданных при проведении клинического исследования. В то же время они не дают возможности точно оценить их реальную эффективность и безопасность в обычной клинической практике, поскольку обстоятельства клинического применения ЛС значительно отличаются от условий, в которых оно изучалось в ходе клинического исследования (табл. 2)[2, 9].
Таблица 2
Преимущества и недостатки рандомизированных контролируемых клинических исследований[14]
РАЗЛИЧИЯ МЕЖДУ КЛИНИЧЕСКИМ ИССЛЕДОВАНИЕМ И КЛИНИЧЕСКОЙ ПРАКТИКОЙ
- Количество пациентов. После завершения предрегистрационных исследований и получения разрешения на клиническое применение препарата его начинают использовать у сотен тысяч пациентов в различных социально-экономических и клинических условиях, в то время как общее число участников рандомизированных клинических исследований III фазы составляет всего нескольких тысяч. Относительно небольшое число пациентов не позволяет выявить нежелательные эффекты ЛС, отмечающиеся с частотой менее 1/100 или 1/1000, а частота некоторых серьезных нежелательных реакций может составлять 1/10 000 или 1/100 000. Согласно так называемому правилу трех, для выявления (с вероятностью 95%) нежелательных лекарственных реакций, встречающихся с частотой 1/N, необходимо наблюдать в 3 раза больше пациентов (3 × N)[18]. Эти реакции, возможно, останутся незамеченными отдельными врачами, назначающими препарат своим пациентам, но могут иметь существенное значение для общественного здравоохранения, если, допустим, препарат ежедневно начинают принимать 100 000 больных, а нежелательная реакция создает угрозу для жизни. Кроме того, клинические исследования практически не позволяют выявить отсроченные нежелательные реакции (типа D): канцерогенные, мутагенные, тератогенные эффекты, нарушения со стороны репродуктивной системы, — которые могут возникать через месяцы или годы после лечения, в том числе у лиц, внутриутробно подвергшихся воздействию ЛС.
- Репрезентативность исследуемой популяции пациентов. Выборка пациентов, включаемых в то или иное клиническое исследование, редко бывает репрезентативной для всей генеральной совокупности пациентов с определенным заболеванием. Так, в клинические исследования обычно не включают несовершеннолетних пациентов или людей старческого возраста, больных с сопутствующими заболеваниями (хотя они имеются почти у 40% взрослых пациентов), лиц с возможными противопоказаниями к назначению нового ЛС или с факторами риска возникновения нежелательных лекарственных реакций и т. д. Например, по данным метаанализа клинических исследований при хронической сердечной недостаточности, средний возраст включенных в них пациентов составил 60 лет, 25% были женщинами и 86% получали лечение ингибиторами АПФ (иАПФ). В то же время в обычной медицинской практике средний возраст таких пациентов превышает 70 лет, женщины составляют не менее половины и только около 20% пациентов получают лечение иАПФ[19].
- Диагноз изучаемого заболевания. В развитых странах примерно 40% всех состояний в обычной медицинской практике не соответствуют принятым критериям диагноза. В рутинной практике лечение зачастую назначают без установления определенного диагноза, что не позволяет переносить результаты рандомизированных контролируемых клинических исследований на популяцию пациентов с недифференцированными состояниями.
- Лекарственные взаимодействия. Обычно в рандомизированных контролируемых клинических исследованиях строго оговаривается перечень разрешенных и запрещенных сопутствующих препаратов. Это снижает риск лекарственных взаимодействий по сравнению с условиями обычной клинической практики, когда пациент может принимать рецептурные и безрецептурные препараты, назначенные различными специалистами, в рамках самолечения, а также биологически активные добавки, средства народной медицины, лекарственные растения и определенные продукты питания (например, напитки, содержащие хинин, грейпфрутовый сок, и т. д.).
- Доза препарата. Пациенты в клинических исследованиях обычно более точно следуют рекомендациям в отношении приема исследуемого препарата, в то время как в обычной клинической практике доза и режим применения ЛС соблюдаются пациентами менее тщательно. Это может приводить как к недостаточной эффективности лечения, так и повышать вероятность возникновения дозозависимых нежелательных реакций (типа А).
- Использование суррогатных критериев эффективности, а не клинических исходов. Для определения клинических исходов в результате вмешательства обычно требуется длительное наблюдение за пациентами. Для сокращения продолжительности во многих рандомизированных контролируемых клинических исследованиях используют суррогатные маркеры, что может приводить к ложным заключениям. Классическим примером служит изучение эффективности антиаритмических препаратов при инфаркте миокарда, которые способны восстанавливать нормальный сердечный ритм (суррогатный маркер), но приводят к повышению смертности больных (клинический исход).
- Клиническая оценка и наблюдение за пациентами. В условиях клинического исследования наблюдение и оценку состояния пациентов обычно проводят более часто и тщательно, чем в повседневной клинической практике, где в силу различных причин менее вероятны соблюдение пациентами предписанных рекомендаций и проведение оптимальной терапии. Поэтому результаты лечения пациентов в клинических исследованиях обычно лучше, чем в реальных условиях.
- Оценка одного вмешательства, а не нескольких проводимых одновременно вмешательств. Дизайн клинического исследования обычно предусматривает оценку эффективности только одного вмешательства. Однако лечение хронических заболеваний в условиях реальной практики чаще всего требует одновременного проведения нескольких различных лечебных мероприятий, что, несомненно, влияет на результат.
- Проведение клинических исследований в условиях крупных лечебных учреждений. Клинические исследования в большинстве случаев проводят на базе крупных клинических больниц или центров. При этом категория пациентов (например, по тяжести заболевания, социальному статусу), стандарты диагностики и оказания медицинской помощи в таких клиниках могут значительно отличаться от условий первичного этапа оказания медицинской помощи.
Рандомизированные контролируемые клинические исследования можно считать «золотым стандартом» при проведении медицинских исследований только при соблюдении определенных условий. Такой дизайн оптимален при изучении эффективности лечебного или профилактического вмешательства, но он мало пригоден для оценки методов диагностики или скрининга (предпочтительный дизайн — поперечное исследование), определения прогноза заболевания (оптимальный дизайн — продольное когортное исследование), изучения этиологии заболевания (для этого проводят когортные исследования или исследования случай-контроль), в зависимости от распространения заболевания ценная информация может быть также получена путем описания отдельных случаев[9].
В определенной степени различия между условиями клинических исследований и реальной клинической практикой нивелируются при проведении крупных многоцентровых исследований, для которых отбирают пациентов в различных клинических центрах по единому протоколу. Это позволяет уменьшить некоторые из перечисленных выше недостатков за счет увеличения этнического разнообразия пациентов, участия большого числа различных клиник и специалистов и дает возможность более реалистично оценить эффекты проводимого вмешательства[4, 12, 17]. Другой возможный путь устранения недостатков предрегистрационных рандомизированных клинических исследований — проведение постмаркетинговых исследований IV фазы, в которых часто используют методы и дизайн классических фармакоэпидемиологических исследований[2] и метаанализ результатов клинических исследований[16, 21].
Таким образом, необходимо осознавать, что:
- даже прекрасно спланированные и выполненные, сложные и продолжительные рандомизированные контролируемые клинические исследования III фазы не всегда позволяют адекватно смоделировать эффективность и безопасность применения препарата в реальной практике;
- эта информация может быть получена в клинических исследованиях IV фазы, в которых используются различные методы клинической эпидемиологии;
- во многих случаях может оказаться правильным с этической, научной и политической точки зрения разрешить клиническое применение нового ЛС по результатам выполненных клинических исследований при условии безотлагательного проведения эпидемиологических исследований после регистрации нового ЛС[3].
МЕТААНАЛИЗ РЕЗУЛЬТАТОВ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
Метаанализ представляет собой статистический подход для объединения независимых научных исследований. Его основное значение заключается в получении новой информации путем анализа имеющихся результатов проведенных исследований. Метаанализ — систематический метод, использующий статистический анализ для объединения результатов отдельных исследований с целью количественной оценки общего влияния определенной процедуры или переменной на исход[13]. Помимо оценки общего эффекта метаанализ используют для выявления возможных причин различий результатов, полученных в отдельных исследованиях.
Отличительная черта этого метода в сравнении с традиционным качественным обзором литературы — систематизированное, структурированное и максимально объективное представление и анализ всей доступной информации. Традиционные обзоры литературы обычно являются субъективными.
Метаанализ обеспечивает концептуальные и количественные характеристики для проведения строгих систематических обзоров литературы, при этом сходные показатели из сравнимых исследований сводятся в таблицы, а показатели эффективности соответствующим образом комбинируются.
Чаще всего метаанализ выполняется для обобщения результатов рандомизированных контролируемых клинических исследований, направленных на изучение определенного вида лечения при конкретном заболевании. Обычно данный метод позволяет получить общую оценку эффективности определенного вмешательства в виде суммарного отношения шансов, которые могут быть определены для различных подгрупп пациентов, например только мужчин. Более сложные варианты метаанализов позволяют также изучить вариабельность результатов различных исследований и, если результаты противоречивы, установить возможные причины их расхождения.
Позднее появились метаанализы результатов обсервационных эпидемиологических исследований и публикации, посвященные особенностям их методологии[16, 21]. Такие метаанализы в большей степени ориентированы на выявление возможных причин расхождений полученных результатов, включая возможные систематические ошибки.
Основные цели метаанализа рандомизированных контролируемых клинических исследований:
- увеличение статистической мощности оценки основных критериев эффективности в различных подгруппах пациентов (в тех случаях, когда размеры выборок в отдельных исследованиях недостаточны для демонстрации статистической значимости различий);
- разрешение неопределенности в тех случаях, когда результаты проведенных исследований противоречивы;
- получение ответов на вопросы, которые не рассматривались в исходных исследованиях.
Метаанализ рандомизированных контролируемых клинических исследований может оказаться полезным при изучении целого ряда фармакоэпидемиологических вопросов, таких как:
- выявление относительно редких неблагоприятных исходов лечения (в частности, нежелательных лекарственных реакций), которые невозможно оценить
в отдельных клинических исследованиях;
- определение причин противоречивых результатов отдельных клинических исследований;
- выделение подгрупп пациентов, у которых определенное ЛС или другое вмешательство может оказаться более (или менее) эффективным;
- выбор оптимального вида лечения из нескольких альтернативных;
- исследование новых показаний к применению ЛС.
Преимущества метаанализа особенно очевидны в тех случаях, когда размеры популяций в отдельных клинических исследованиях недостаточны для оценки эффектов ЛС или получения статистически значимых результатов.
В то же время выполнение метаанализа сопровождается целым рядом методологических проблем, среди которых наиболее значимыми являются проблемы качества анализируемых исследований, допустимость объединения результатов различных исследований, вероятность систематической ошибки, связанной с преимущественным опубликованием положительных результатов исследований, возможность систематической ошибки, связанной с отбором данных для включения в метаанализ.
В последние годы метаанализы получают все большую популярность. Однако наряду с горячими сторонниками метаанализа, активно разрабатывающими и применяющими его для поиска ответов на разнообразные научные и практические вопросы, есть и противники данного метода, обоснованно указывающие на возможные источники ошибок, перечисленные выше.
Наиболее обширной базой, в которой собрано наибольшее количество метаанализов, выполненных независимыми экспертами, является Кокрановская электронная библиотека, которая доступна онлайн (http://www3.interscience.wiley.com) и на CD-дисках. Наполнением базы данных занимается Кокрановское сотрудничество врачей (названное так в честь английского эпидемиолога А. Кокрана, впервые сформулировавшего концепцию метаанализа). К настоящему времени Кокрановским сотрудничеством подготовлено почти 10 000 метаанализов в самых различных областях медицины. В Кокрановской библиотеке, помимо базы данных систематических обзоров и самих метаанализов, имеется также база данных контролируемых клинических исследований, отвечающих современным стандартам качества, реферативная база данных обзоров по эффективности медицинских вмешательств и база данных по методологии проведения обзоров.
Все более очевидно, что значение метаанализа как метода научного исследования, направленного на оценку эффективности различных вмешательств и формирование рекомендаций по тактике лечебных и профилактических медицинских мероприятий, постоянно растет. При взвешенной интерпретации результатов метаанализов с учетом их сильных и слабых сторон данный метод может оказаться весьма полезным в решении разнообразных фармакоэпидемиологических вопросов.
ЗАКЛЮЧЕНИЕ
Необходимо отметить, что ни один из видов исследований, описанных выше, по отдельности не позволяет дать однозначный ответ на наиболее важный вопрос профилактики и терапии: насколько определенный лекарственный препарат, метод лечения или профилактики, а также любое другое вмешательство являются эффективными и безопасными для клинической практики? Наиболее эффективным и доказательным методом выбора тактики и протокола лечения являются многоцентровые проспективные кооперированные клинические исследования, исключающие селекцию пациентов и лечащих врачей.
Важно отметить, что последовательное улучшение результатов приведенного на рисунке исследования не было связано с введением в протоколы лечения новых лекарств. Движущей силой успеха была научно-организационная составляющая на основе риск-зависимых модификаций лечения детей, больных острым лимфобластным лейкозом[8]. Из данного обзора следует, что только комплексное использование перечисленных методов и оценка результатов дают возможность определить наиболее безопасный и эффективный метод (протокол, технологию и т. д.), который следует внедрять в практику общественного здравоохранения.








