ВВЕДЕНИЕ
Прогноз у детей с хронической кардиальной патологией независимо от ее этиологии в настоящее время остается крайне неблагоприятным, поэтому вопросы профилактики и лечения ХСН постоянно находятся в центре внимания клиницистов. Приоритеты лечения определяются и воздействием на отдельные звенья патогенеза, и целенаправленным влиянием на этиологический фактор, который зачастую оказывается инфекционным[1, 2].
Наиболеее эффективная мера предотвращения инфекции — это вакцинопрофилактика, которая в должной мере не используется у детей с хронической патологией. До сих пор самыми частыми причинами нарушения графика вакцинации вплоть до полного отсутствия прививок у ребенка являются длительные необоснованные медицинские отводы от прививок[3].
У детей с ХСН зачастую респираторные инфекции приводят к развитию пневмонии на фоне полнокровия легких (при пороках с увеличенным легочным кровотоком) или на фоне хронической гипоксии (при пороках с уменьшенным легочным кровотоком). При этом факторами повторной госпитализации, связанной с инфекцией, у больных с ХСН становятся ранний возраст, среднее давление, отсутствие приема ингибиторов ангиотензинпревращающего фермента или блокаторов рецепторов ангиотензина II, необходимость поддерживающей терапии петлевым диуретиком и некоторые другие.
Повышенный риск смерти, связанный с декомпенсированной ХСН, в основном обусловлен инфекциями нижних дыхательных путей, инфекциями урогенитального тракта и сепсисом[2]. Установлена также прогностическая ценность соотношения концентраций цистатина С и преальбумина в сыворотке крови в сочетании с уровнем NT-proBNP для долгосрочного прогноза выживаемости пациентов с ХСН[4].
Одна из самых грозных респираторных инфекций — Streptococcus pneumoniae (пневмококк). Это грамположительный диплококк рода Streptococcus, малоустойчивый во внешней среде, но жизнеспособный до 2 месяцев в высушенной мокроте[5]. Наличие полисахаридной капсулы, которая типоспецифична, является основным фактором вирулентности. На основании серодиагностики определены 94 серотипа S. pneumoniae во всем мире, которые видоизменяются в зависимости от возраста, расы и территории. Из них около 20 серотипов в 80% случаев вызывают инвазивные пневмококковые инфекции в разных возрастных группах, а 13 серотипов считаются «педиатрическими», т. к. вызывают инвазивные заболевания у детей с частотой около 75%. Именно эти 13 штаммов были положены в основу конъюгированной 13-валентной пневмококковой вакцины[6].
Инфекционный процесс, вызванный S. pneumoniae, может проявляться у человека различными нозологическими формами: острым средним отитом, бронхитом, синуситом и конъюнктивитом; а также инвазивными заболеваниями: пневмонией, менингитом, бактериемией, эндокардитом, артритом
и сепсисом[7, 8]. Пневмококк является одной из важнейших причин заболеваемости и смертности среди детского и пожилого населения. Заболеваемость наиболее тяжелыми формами — инвазивными — варьирует в пределах 15–24 случая на 100 тыс. населения, существенно различаясь в разных возрастных группах: наибольшая частота отмечается у детей до 2 лет и пациентов старше 65 лет. Частота инфицирования S. pneumoniae в зависимости от возраста имеет ярко выраженную U-образную кривую с самой высокой заболеваемостью у младенцев и пожилых людей, что свидетельствует о повышении приобретенного иммунитета к S. pneumoniae у детей с возрастом. Наиболее он высок у молодых взрослых, затем ослабевает у пожилых людей[9].
Пневмококк — лидирующая причина внебольничных пневмоний у детей первых лет жизни. Во всем мире более 150 млн детей в возрасте до 5 лет ежегодно страдают от пневмонии, из них 1,4 млн погибают[10, 11].
Пневмококк часто колонизирует верхние дыхательные пути человека, особенно носоглотку. Колонизация носоглотки может начинаться с первых месяцев жизни. Распространенность носоглоточного носительства оценивается в 27–65% среди детей дошкольного возраста и снижается лишь во взрослом возрасте[12].
Частота назофарингеального носительства S. pneumoniae варьирует в зависимости от возраста, географического района, скученности коллектива, степени загрязнения воздуха, наличия сопутствующих заболеваний дыхательных путей, частых приемов антибиотиков, курения (в том числе пассивного), посещения детских дошкольных учреждений, генетических факторов. Носительство пневмококка опасно «прорывом» собственной инфекции в окружающие органы и ткани и возникновением заболевания, а также способностью заражать окружающих людей, не имеющих иммунитета к пневмококку.
Одной из наиболее тяжелых форм пневмококковой инфекции считается бактериальный менингит с летальностью от 30% и более в младших и пожилых возрастных группах. Частота неврологических осложнений после выздоровления, в том числе потеря слуха, может достигать 25–50%[13].
Сочетание пневмококкового менингита, пневмонии и эндокардита, известное также как «австрийский синдром», было описано более 100 лет назад У. Ослером. Случаи пневмококкового эндокардита, в том числе вызванные пенициллин-резистентными штаммами пневмококка, представлены в обзоре 2001 года. Чаще всего сообщалось о вовлечении аортального и митрального клапанов, при этом у большинства пациентов имелись врожденные пороки сердца (ВПС)[14].
В целом риск развития пневмококковой инфекции у детей с патологией сердца и сосудов, сопровождающейся ХСН, в 5 раз выше, чем у здоровых детей, а частота сердечно-сосудистых осложнений выше в 10 раз и составляет 10,6 на 100 тыс. детей в возрасте 5–17 лет.
Патогенез ХСН у детей отличается от такового у взрослых и обусловлен чаще всего нарушениями кровообращения при сложных ВПС и кардиомиопатиях (КМП), при которых сердце не обеспечивает необходимый объем системного кровотока, адекватный метаболическим потребностям растущего организма[15, 16].
Клинические исследования показывают более высокую смертность среди кардиологических пациентов с пневмококковой пневмонией[17]. Пневмококки могут проникать в сердце и образовывать микроповреждения, тем самым нарушая электрофизиологию и сократительную функцию кардиомиоцитов[18]. Показано, что пневмококковый порообразующий токсин PLY и пероксид играют важную роль в индукции сердечной недостаточности, убивая кардиомиоциты и инфильтрируя макрофаги[19].
Лечение пневмококкового заболевания у больных ХСН крайне затруднено по разным причинам и не всегда эффективно. Вакцинация детей с ХСН может стать клинически полезным и потенциально экономически выгодным вмешательством для улучшения результатов лечения и повышения качества жизни пациентов[20].
В настоящее время рекомендации по респираторной вакцинации больных детей с ХСН ограничены. Проводится преимущественно плановая ежегодная вакцинация против гриппа больных ХСН[21, 22]. Поэтому исследование безопасности и эффективности противопневмококковой вакцинации детей с заболеваниями сердца, сопровождающимися ХСН, является в настоящее время актуальным.
Цель данного исследования: проанализировать охват вакцинацией детей с хронической патологией сердечно-сосудистой системы, госпитализированных в ФГАУ «НМИЦ здоровья детей» в 2018–2019 гг., оценить безопасность и эпидемиологическую эффективность противопневмококковой вакцинации у данной категории больных.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование вошли 82 ребенка, находившиеся на обследовании и/или лечении в отделениях кардиологии и кардиохирургии ФГАУ «НМИЦ здоровья детей» в период с января 2018 г. по январь 2020 г.
Критерии включения: для статистической оценки клинико-лабораторных и иммунологических показателей в исследование включены дети от 1 месяца до 7 лет с ХСН II (А, В) степени на фоне рестриктивной, дилатационной КМП, корригированных ВПС.
Критерии исключения: отсутствие сердечной недостаточности или недостаточность I степени; противопоказания к проведению вакцинации против пневмококковой инфекции; отказ родителей от проведения вакцинации или включения пациента в исследование.
Анкетирование родителей включало вопросы о наличии/отсутствии информации о необходимости вакцинации против пневмококка; о возрасте, когда впервые была проведена вакцинация; причине отсутствия вакцинации у ребенка; наличии/отсутствии ревакцинации в декретированные сроки.
Все дети, находившиеся в отделениях кардиологии и кардиохирургии, проходили стандартное обследование (ЭКГ, ЭхоКГ, холтеровское мониторирование ЭКГ, осмотр, измерение уровня NTproBNP), в ходе которого определялась степень ХСН. Распределение по степени ХСН оказалось следующим: 72 (87,8%) — степень 2А, остальные 10 (12,2%) — степень 2Б. Не имели отягощенного аллергологического анамнеза 75 (91,5%) участников.
Среди 82 детей было 30 больных с ВПС. Из них, согласно классификации, 20 имели ВПС по бледному типу (сброс слева-направо), 6 — по синему типу (сброс справа-налево), 4 — неклассифицируемые ВПС. Остальные 52 ребенка имели ту или иную форму КМП.
Использовалась 13-валентная конъюгированная пневмококковая вакцина.
РЕЗУЛЬТАТЫ
При анкетировании выявлено, что иммунопрофилактику против пневмококка получили всего 16 (19,5%) пациентов, в то время как остальные 66 (80,5%) привиты не были. В качестве причин, по которым вакцинация не была проведена, родители 28 (42,5%) из 66 детей указывали отсутствие информации, 31 (47%) ребенка — медицинский отвод по основному заболеванию, рекомендованный лечащим врачом. Семь (10,5%) родителей приняли решение об отказе от вакцинации ребенка самостоятельно.
Из 82 детей 41 (50%) ребенок родился в состоянии легкой асфиксии (первая оценка по Апгар — 6–7 баллов), 28 (34,2%) детей — с умеренной асфиксией, 13 (15,8%) имели нормальную оценку по шкале Апгар (8–9 баллов). При рождении у 90% пациентов были стандартные массо-ростовые показатели: 3501 ± 76 г; 52 ± 1,8 см. Большинство детей (90%) родились доношенными, 8 (10%) рождены раньше срока, антропометрические показатели у них были меньше — 2400 ± 52 г; 46 ± 8 см, их гестационный возраст составил от 31 до 36 недель.
По данным анамнеза, при рождении 52 ребенка вакцинированы в родильном доме, согласно Национальному календарю профилактических прививок РФ (от гепатита В и БЦЖ-М), остальным 30 детям вакцинация не проводилась по причине рекомендованного медицинского отвода по основному заболеванию.
При изучении прививочных карт установлено, что к моменту обращения (в среднем в возрасте 32 месяца) 65 (79,3%) детей не имели достаточного набора профилактических прививок по возрасту, согласно Национальному календарю профилактических прививок РФ, в связи с длительными медицинскими отводами с момента постановки диагноза. Дети, у которых диагностировали ВПС в первые сутки жизни, получили первую дозу вакцины против пневмококковой инфекции в среднем в возрасте 32 ± 1,5 мес. При этом из 22 прооперированных по поводу ВПС детей 18 были вакцинированы после операции и только четверо — до оперативного вмешательства. После оперативного лечения вакцинация против пневмококковой инфекции произведена с отсрочкой: через 6 месяцев и более.
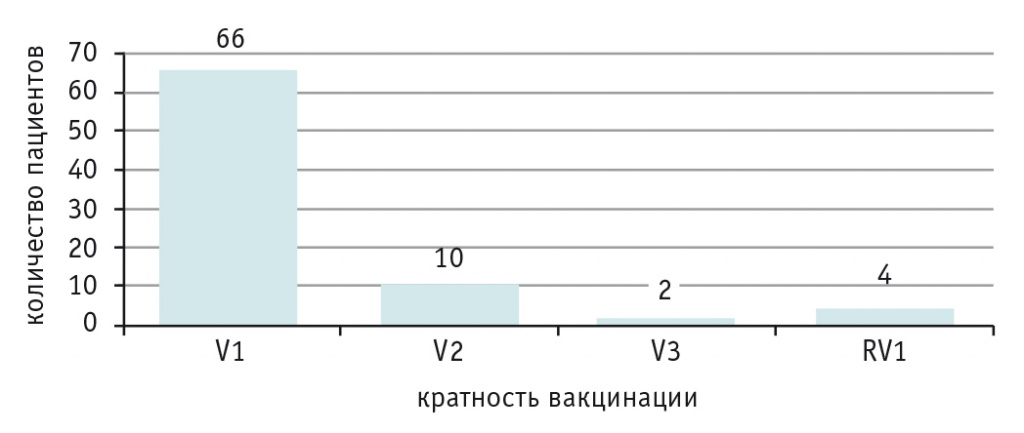
При анализе прививочных карт выяснено, что большинство детей (66) не имели ни одной прививки от пневмококка, в связи с чем им произведена первая вакцинация в ФГАУ «НМИЦ здоровья детей». Остальные дети получили соответственно вторую, третью дозу вакцины или ревакцинацию от пневмококка (рис. 1).
Рис. 1. Число детей, получивших первую (V1), вторую (V2), третью (V3) дозу вакцины или ревакцинацию (RV1) от пневмококка в ФГАУ «НМИЦ здоровья детей» Минздрава России
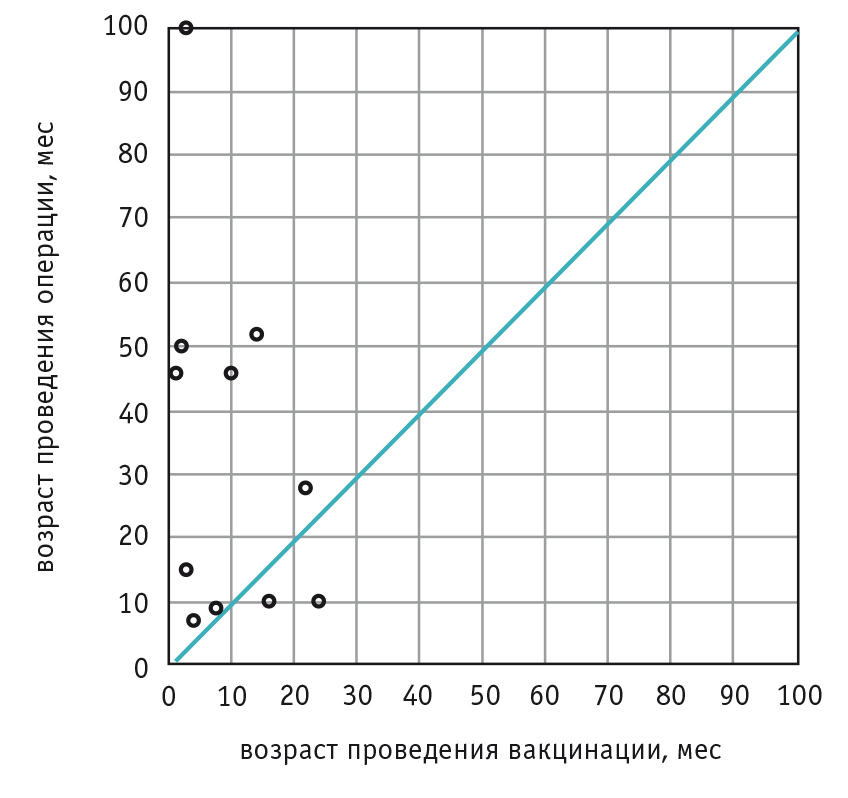
Дети с корригированными ВПС были вакцинированы в отдаленные сроки после проведенного оперативного вмешательства. Два ребенка с корригированным в первом полугодии жизни ВПС (дефектом межжелудочковой перегородки) получили первую дозу вакцины в возрасте до 1 года, однако большинство — 47 (57,3%) детей — вакцинировали в возрасте 1 года 3 мес — 2 года 6 мес, 33 (40,2%) ребенка были привиты в возрасте 2 года 7 мес — 4 года 8 мес. Как правило, дети из старшей возрастной группы имели в анамнезе несколько этапов оперативного вмешательства (рис. 2).
Рис. 2. Вакцинация пациентов в зависимости от сроков оперативного вмешательства
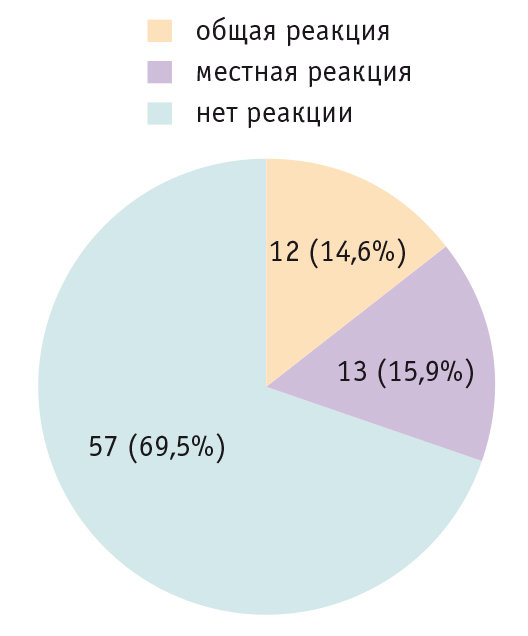
При наблюдении у вакцинированных детей не зафиксировано ни одного осложнения в поствакцинальный период. У 12 детей отмечался подъем температуры тела до субфебрильных цифр длительностью от нескольких часов до 2 суток, у 13 — та или иная местная реакция слабой или умеренной степени выраженности (рис. 3). Ни одному ребенку не потребовались терапевтическая помощь и дополнительная лекарственная терапия в поствакцинальной период.
Рис. 3. Переносимость вакцинации
До проведения необходимого оперативного лечения у данных пациентов часто отмечались бронхиты, отиты, пневмонии, их период восстановления после операции был сопряжен с более высокими рисками развития инфекционных осложнений.
Контрольное обследование детей осуществлялось в разное время в зависимости от возраста, степени тяжести заболевания, сопутствующих нарушений ритма сердца: 18 детей — в первые 3 месяца от момента вакцинации, 28 — в первые 6 месяцев, 36 — в первые 12 месяцев.
При контрольном стандартном обследовании не выявлено увеличение степени ХСН или ФК ХСН после прививки. До проведения вакцинации все дети относились к группе часто болеющих, острую пневмонию перенесли 14 детей, 2 ребенка — острый средний отит, 1 ребенок — менингит.
В течение 1-го года после вакцинации заболеваемость ОРВИ снизилась более чем в 2 раза, острую пневмонию перенесли 2 ребенка с легочной гипертензией. Ни у одного ребенка не диагностированы острый средний отит, менингит, отсутствовали обострения или утяжеление течения основного заболевания.
ОБСУЖДЕНИЕ
Проведенные в ФГАУ «НМИЦ здоровья детей» Минздрава России многочисленные исследования по вакцинации детей с различной хронической патологией позволяют сделать вывод о позднем начале вакцинопрофилактики таких детей. Пациенты, которые нуждаются в защите от инфекционных заболеваний в первую очередь, из-за длительных необоснованных медицинских отводов остаются в группе риска по тяжелому течению вакциноуправляемой инфекции. Продолжающаяся оценка безопасности и эффективности противопневмококковой вакцинации пациентов с ХСН уже показала хорошие результаты.
ЗАКЛЮЧЕНИЕ
Вакцинация против пневмококковой инфекции доказала свои безопасность и эффективность у здоровых детей и у детей с хронической патологией, в том числе с патологией сердечно-сосудистой системы, сопровождающейся ХСН. Актуальной является разработка рекомендаций по вакцинации данной категории пациентов в более ранние сроки, в том числе до оперативного лечения.
Поступила: 14.01.2022
Принята к публикации: 30.03.2022






