ВВЕДЕНИЕ
Инфекция мочевыводящих путей (ИМВП) остается серьезной проблемой в педиатрии и имеет большую социальную значимость[1, 2]. У детей грудного и раннего возраста бактериальное воспаление почек и мочевыводящих путей занимает первое место по частоте встречаемости, опережая респираторные вирусные инфекции[2].
Основным компонентом лечения ИМВП является антибиотикотерапия, которая большинству пациентов назначается эмпирически в связи с невозможностью определить возбудителя в дебюте воспалительного процесса[3]. Очевидно, что для успешного выбора препарата необходимо знание как структуры возбудителей, так и профиля их антибиотикочувствительности.
В результате ранее проведенных многочисленных исследований установлено, что наиболее частые возбудители ИМВП — представители семейства Enterobacteriaceae, другие возбудители встречаются гораздо реже[1, 3, 4]. В то же время состав уропатогенов в отдельных странах и даже городах может не только значительно различаться, но и меняться с течением времени[4].
В России наиболее крупной и авторитетной работой в области эпидемиологии уропатогенов является исследование АРМИД-1, опубликованное в 2002 году и показавшее микробный пейзаж внебольничной ИМВП в стране в 2000–2001 гг.[4]. Следует, однако, подчеркнуть, что знания актуального состава уропатогенов недостаточно для подбора оптимальной эмпирической антибиотикотерапии. Не меньшее значение имеет современный профиль их антибиотикочувствительности, который также не только меняется с течением времени, но может существенно различаться от региона к региону[4].
Цель нашего исследования: изучить особенности видового состава возбудителей на амбулаторном этапе у детей грудного и раннего возраста с ИМВП, оценить спектр их антибиотикочувствительности и дальнейшие перспективы лечения бактериальной инфекции мочевой системы.
МАТЕРИАЛЫ И МЕТОДЫ
В рамках проспективного исследования нами проанализированы клинические данные и результаты бактериологического исследования из амбулаторных карт 106 детей с диагнозом ИМВП в возрасте от месяца до 3 лет, проходивших лечение в КГБУЗ «Владивостокская детская поликлиника № 2» с 2012 по 2017 г. В исследование включены только дети, у которых заболевание было диагностировано впервые. Критериями исключения являлись возраст пациента менее 29 дней жизни и старше 2 лет 11 месяцев и 29 дней, отсутствие информированного согласия законного представителя ребенка или его отказ от включения пациента в исследования, наличие сопутствующей острой воспалительной патологии или обострение хронических заболеваний на момент исследования и прием каких-либо антибактериальных препаратов в период от 3 месяцев до установки диагноза ИМВП.
Все родители подписали добровольное информированное согласие на обследование.
Материалом для исследования служила средняя порция мочи, полученная после туалета наружных половых органов, в количестве 3–5 мл, взятая в стерильный контейнер, что соответствует современным требованиям неинвазивной диагностики. Забор материала проводили до назначения антибактериальной терапии.
Чувствительность уропатогенов к антибактериальным препаратам определялась диффузионно-дисковым методом, согласно критериям Европейского комитета по определению чувствительности к антибиотикам[5]. В соответствии с клиническими рекомендациями Союза педиатров России и Европейской ассоциации урологов, значимым титром возбудителей при ИМВП считался 105 и более КОЕ/мл[3, 6].
Полученные данные обрабатывались методами описательной статистики с вычислением средних величин (M) и их стандартных отклонений (s) с оценкой достоверности разности по критерию Пирсона (χ2). Статистическая обработка материала выполнена с помощью специализированных пакетов прикладных программ Excel-2010 и Statstica 10.
РЕЗУЛЬТАТЫ
В результате исследования установлено, что бактериальная инфекция почек чаще регистрируется у девочек, нежели у мальчиков: 61 (57,55 ± 4,80%) против 45 (42,45 ± 4,80%). Клинические проявления ИМВП наблюдались у 60 детей: повышение температуры тела до фебрильных цифр — у 18 (30,00 ± 5,92%), отказ от еды — у 15 (25,00 ± 5,59%), беспокойство или нарушения мочеиспускания в виде редких или частых микций — у 12 (20,00 ± 5,16%), бледность кожных покровов — у 12 (20,00 ± 5,16%), неприятный запах мочи — у 3 (5,00 ± 1,81%). У 46 детей (43,40 ± 4,81%) ИМВП диагностировали при плановых обследованиях. На момент исследования лейкоцитурия превышала 10–15 в поле зрения у всех наблюдаемых детей.
У 83 (78,30 ± 4,00%) пациентов провоцирующие факторы развития заболевания не обнаружены. У 23 (21,70%) участников установлены следующие факторы: ОРВИ — у 17 (73,91 ± 9,16%), вульвовагинит — у 4 (17,39 ± 5,90%), кишечная инфекция — у 2 (8,70 ± 1,36%).
В исследовании проанализированы положительные результаты бактериологических посевов мочи, полученной у 82 детей раннего возраста с ИМВП (77,36 ± 4,06%). У 24 (22,64 ± 4,06%) больных результат посева мочи на стерильность был отрицательным.
Всего из мочи пациентов выделены 8 различных видов микроорганизмов. Основными возбудителями ИМВП у детей грудного и раннего возраста оказались бактерии семейства Enterobacteriaceae. Этиологическая структура возбудителей впервые выявленной внебольничной ИМВП представлена в таблице 1.
Таблица 1
Этиологическая структура возбудителей инфекции мочевыводящих путей у детей грудного и раннего возраста в условиях поликлиники, n (M ± s%)
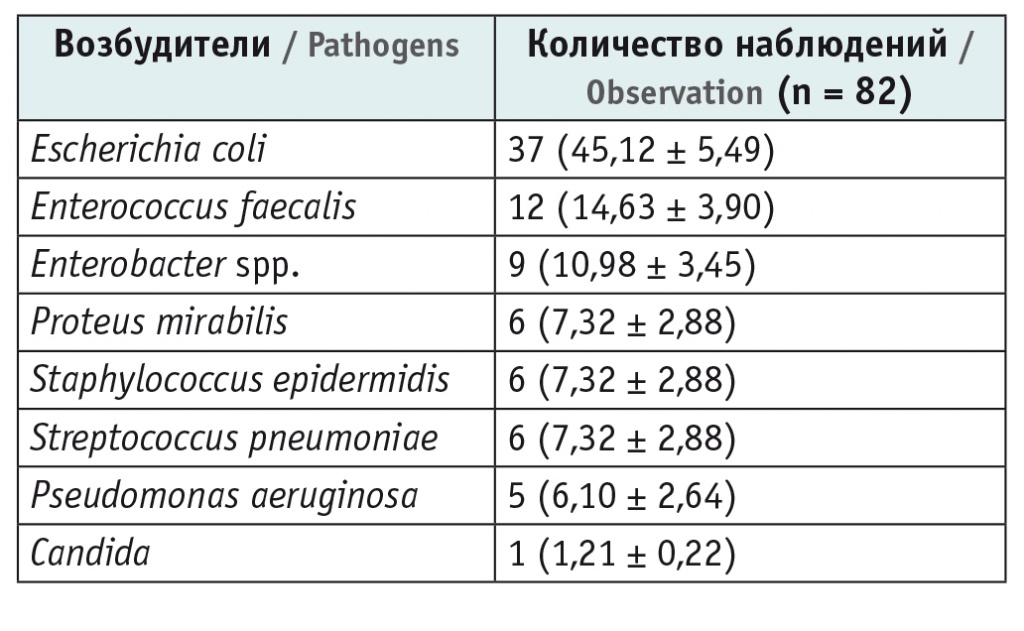
Интересным с практической точки зрения является тот факт, что ИМВП у детей обнаружена во время профилактических осмотров. А манифестные формы заболевания сопровождались неспецифическими клиническими проявлениями (отказом от еды, бледностью и т. д.). Мы проанализировали этиологическую структуру ИМВП в зависимости от клинического течения заболевания. Всех обследованных мы разделили на две группы, в первую группу включили детей, у которых заболевание протекало в виде манифестных форм, во вторую — детей с бессимптомным течением ИМВП. Далее мы проанализировали и сравнили структуру уропатогенов в обеих выборках.
Оказалось, что в обеих когортах ведущую роль в развитии заболевания играет Escherichia сoli. На втором месте по значимости у пациентов первой группы находится Enterocосcus faecalis, а у больных второй группы — Staphylococcus epidermidis и Streptococcus pneumoniae.
Большой интерес представляют данные по чувствительности к антибиотикам в условиях поликлиники у наиболее часто встречающихся возбудителей семейства Enterobacteriaceae. Данные по чувствительности E. coli к основным группам антибиотиков представлены в таблице 2.
Таблица 2
Чувствительность Escherichia coli к основным группам антибиотиков
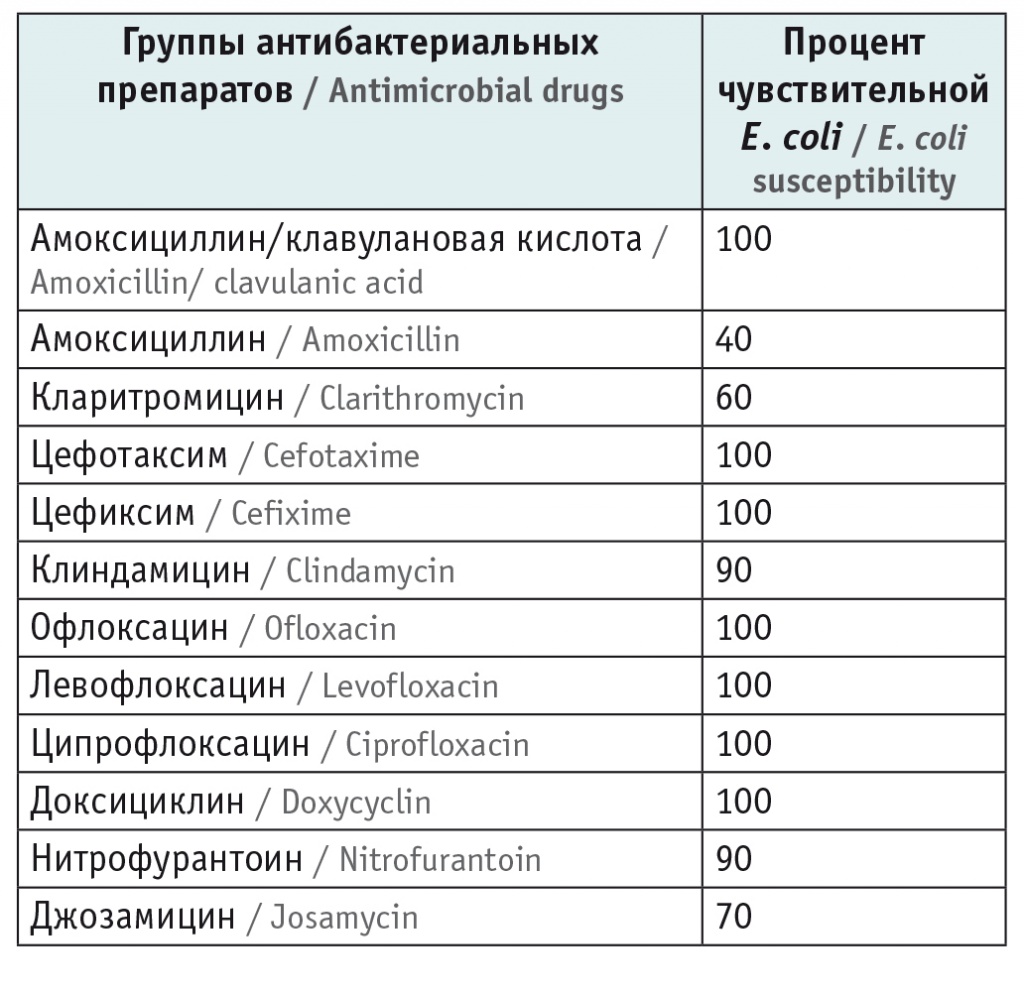
Как видно из таблицы 2, для детей грудного и раннего возраста характерна очень высокая частота резистентных штаммов E. coli к амоксициллину, а также к антибиотикам группы макролидов. Этот уропатоген очень чувствителен к амоксициллину/клавулановой кислоте, цефалоспоринам II и III поколения, нитрофурантоину и фторхинолонам.
При анализе антибиотикочувствительности выявлено, что E. faecalis сохраняет высокую чувствительность к амоксициллину/клавулановой кислоте, цефалоспоринам II и III поколения и нитрофурантоину, умеренную — к фторхинолонам, низкую — к амоксициллину (25%) и макролидам (56%).
Enterobacter spp. чувствителен к амоксициллину/клавулановой кислоте, цефалоспоринам II и III поколения и фторхинолонам, умеренно чувствителен к фурадонину, выявлена низкая чувствительность к препаратам группы макролидов: кларитромицину и джозамицину. Нечувствителен к амоксициллину.
Proteus mirabilis также чувствителен к амоксициллину/клавулановой кислоте и цефалоспоринам II и III поколения, макролидам. Резистентен к нитрофурантоину, амоксициллину и фторхинолонам.
S. epidermidis резистентен к фурадонину и офлоксацину, но сохраняет хорошую чувствительность к цефалоспоринам, макролидам и амоксициллину/клавулановой кислоте.
S. pneumoniae устойчив к офлоксацину, ципрофлоксацину, имеет умеренную чувствительность к кларитромицину и джозамицину, высокую — к остальным группам антибиотиков.
Для Pseudomonas aeruginosa характерна низкая чувствительность к нитрофурантоину, амоксициллину, макролидам, умеренная — к амоксициллину/клавулановой кислоте и фторхинолонам, хорошая — к цефалоспоринам.
ОБСУЖДЕНИЕ
Исследование показало, что микробный пейзаж мочи у детей грудного и раннего возраста с ИМВП в условиях поликлиники существенно не отличается от такового в других регионах страны и России в целом[4, 6, 7]. Наши результаты совпадают с данными АРМИД-1 2000–2001 гг., где основным этиологическим агентом внебольничной бактериальной инфекции почек и мочевыводящих путей также была E. coli, распространенность которой варьировала от 41,3% до 83,3% в зависимости от региона[4].
В последние годы отмечается значительное снижение роли кишечной палочки в этиологии внебольничной ИМВП с возрастанием значимости других патогенов энтеробактериальной флоры. Появляются устойчивые представители семейства Enterobacteriaceae, продуцирующие β-лактамазы широкого спектра действия, а также выделяющие полирезистентные штаммы уропатогенов[4, 7]. В нашем исследовании, проведенном ранее, также наблюдался феномен вытеснения кишечной палочки как этиологически значимого агента. При изучении структуры возбудителей ИМВП у детей отмечено уменьшение этиологической значимости кишечной палочки в условиях амбулаторного приема. Довольно существенны доли Enterobacter spp. (до 24%), P. mirabils (до 21%), E. faecalis (до 15%), Enterobacter аerogenes (13%), в единичных случаях высевались Klebsiella pneumoniae и Citrobacter freundi[8].
В нашем исследовании вторым по значимости уропатогеном у детей грудного и раннего возраста является E. faecalis — 14,63 ± 3,90%. У пациентов с манифестными формами ИМВП этот уропатоген также занимает второе место, а у пациентов с бессимптомным течением — четвертое место. Наши сведения совпадают с данными АРМИД-1, где Enterocосcus spp. был вторым среди всего этиологического спектра возбудителей, а в Казани и Иркутске он занимает первое место — 22,9% и 13,5% соответственно[4].
По данным ряда авторов, в последние годы при исследовании микробной флоры мочи у пациентов четко прослеживается увеличение доли высева Е. faecalis — с 3,6% до 14,2%[4, 9, 10]. Считается, что подобная закономерность связана с высокими вирулентными свойствами фекального энтерококка, и, как следствие, ИМВП энтерококковой этиологии имеет характерные черты: чаще регистрируется у детей раннего возраста и сопровождается интоксикационным синдромом и лихорадкой[9]. В нашем исследовании инфекция, вызванная Е. faecalis, у 8 (66,67 ± 13,57%) детей протекала в манифестной форме.
В проведенном нами исследовании P. aeruginosa встречалась у 5 (6,10 ± 2,64%) детей. Инфекция, как правило, протекала латентно (80%). Поскольку P. aeruginosa — возбудитель, более характерный для нозокомиальных инфекций и синегнойные поражения мочевыводящих путей чаще развиваются в виде катетер-ассоциированных инфекций[11], мы оценили факторы риска, способствующие развитию этой флоры. При анализе перинатального анамнеза выявлено, что у матерей имелись хронические бактериальные очаги инфекции — хронический пиелонефрит, хронические воспалительные заболевания органов малого таза, хронические бактериальные инфекции носоглотки. Известно, что 4 (80,00 ± 17,86%) из них проходили лечение во время беременности в связи с обострением герпес-вирусных инфекций. Согласно опубликованным данным, наличие у матерей смешанных бактериально-вирусных ассоциаций нарушает формирование клеточного и гуморального звеньев иммунитета у детей грудного и раннего возраста и способствует контаминации резистентной микрофлоры[11]. Поэтому, мы предполагаем, что выявление в моче синегнойной палочки возможно у детей на фоне иммуносупрессии.
Обращает на себя внимание, что в этиологической структуре возбудителей у одного пациента выявлены дрожжеподобные грибы рода Candida. Наличие в микробном спектре данного уропатогена больше характерно для недоношенных детей, детей с иммунодефицитом, он обнаруживается в 33% случаев[3, 6, 9]. Проанализировав амбулаторную карту ребенка, мы выявили, что ИМВП развилась на фоне врожденного порока органов мочевой системы — единственной почки — в возрасте 2 месяцев. Возможно, ранняя манифестация ИМВП и нехарактерный для данного возраста бактериальный спектр мочи связаны с наличием внутриутробной бактериальной инфекции у ребенка и/или функционального иммунодефицита, что требует дополнительного обследования.
Для достижения максимального эффекта лечения ИМВП у детей при выборе антибактериального препарата необходимо учитывать чувствительность уропатогенов в своем регионе[3, 6, 12]. В клинических рекомендациях 2018 года в качестве препаратов выбора при лечении ИМВП у детей названы амоксициллин/клавулановая кислота, цефалоспорины II и III поколения, ко-тримоксазол, фуразидин[6]. Рекомендации следует рассматривать через призму региональных данных с учетом микробного пейзажа возбудителей почечной инфекции и антибиотикочувствительности уропатогенов. При уровне резистентности к какому-либо антибиотику более 20% требуется ограничение его применения как средства эмпирической терапии[5].
Проанализировав антибиотикочувствительность уропатогенов у детей с впервые выявленной ИМВП, мы отметили, что в качестве препарата эмпирической терапии у детей грудного и раннего возраста возможно использовать комбинацию амоксициллина с клавуланатом. Антибиотик показывает высокую активность в отношении грамотрицательных бактерий семейства Enterobacteriaceae, а также грамположительной флоры. Немаловажно, что препарат в виде суспензии можно использовать у детей грудного и раннего возраста, у него высокая активность в отношении основных возбудителей ИМВП и низкая токсичность.
В нашем исследовании показана высокая чувствительность основных возбудителей ИМВП к цефалоспоринам II и III поколения. При анализе чувствительности E. faecalis к цефалоспоринам не обнаружена антибиотикорезистентность, что расходится с результатами ряда авторов, которые указывают на низкую эффективность этих препаратов при лечении ИМВП[13, 14]. Различия в данных можно объяснить как контингентом обследуемых (в нашем исследовании участвовали дети с впервые выявленной внебольничной ИМВП), так и биологическими особенностями выделенных штаммов.
Выявлена низкая чувствительность микроорганизмов к амоксициллину. Например, чувствительность E. сoli составила лишь 40%, а E. faecalis — 25%, что совпадает с опубликованными ранее данными АРМИД-1[4], так как антибиотикорезистентность препаратов связана с разрушением структуры антибиотика β-лактамазами грамотрицательных бактерий. Некоторые уропатогены обладают природной резистентностью к амоксициллинам, например Enterobacter spp.
К макролидам чувствительность основных возбудителей ИМВП также низка. Согласно клиническим рекомендациям, данная группа антибактериальных препаратов не входит в перечень лекарственных средств, применяемых для лечения ИМВП у детей[6].
E. coli, E. faecalis, Enterobacter spp. сохраняют чувствительность к препаратам группы фторхинолонов, что совпадает с данными других исследований[6, 14]. Но препараты этого антибактериального ряда противопоказаны детям до 14 лет и назначаются по жизненным показаниям в условиях стационара[6].
ЗАКЛЮЧЕНИЕ
Следует отметить, что в последние годы микробный спектр возбудителей инфекции мочевыводящих путей (ИМВП) стал более разнообразным, увеличилась доля микроорганизмов, ранее не характерных для данной когорты пациентов, таких как Pseudomonas aeruginosa и Candida. Все уропатогены, обнаруженные в бактериологических анализах мочи, сохраняют высокую чувствительность к амоксициллину/клавулановой кислоте, цефалоспоринам II и III поколения. Резистентность штаммов Enterobacteriaceae к ампициллину остается высокой. Полученные данные, касающиеся состава и профиля чувствительности уропатогенов при первичной ИМВП у детей грудного и раннего возраста, целесообразно учитывать при выборе стартовой эмпирической антибиотикотерапии в условиях поликлиник Приморского края.
Поступила: 04.12.2019
Принята к публикации: 23.12.2019








