Дети не стали болеть больше или сложнее, просто мы начинаем выявлять новые патологии,
которых раньше не знали, например орфанные и генетически детерминированные заболевания.
И. Е. Колтунов[1]
Возросшее в последние годы внимание к редким и генетически детерминированным заболеваниям обусловлено прежде всего расширением возможностей для их выявления и появлением эффективных способов лечения. Благодаря внедрению высокотехнологических методов диагностики многих наследственных болезней, в частности современных методов аналитической биохимии, энзимодиагностики, молекулярно-генетических методов, стали возможны ранняя верификация редкой патологии и раннее включение высокоэффективных методов терапии. Это особенно актуально для педиатрии и клинической генетики детского возраста, так как более 75% редких наследственных болезней манифестируют в раннем возрасте, причем 65% из них имеют тяжелые инвалидизирующие последствия, а 35% приводят к смерти на первом году жизни[2].
В связи с широким внедрением в практическое здравоохранение генетических методов обследования появилась возможность диагностировать редкие синдромы и у пациентов с врожденными пороками сердца (ВПС). С генетической точки зрения последние представляют собой гетерогенную группу, встречаясь либо в изолированном виде, либо в составе других пороков развития, а также моногенных или хромосомных синдромов.
Формирование изолированного ВПС может быть результатом: а) экзо- и эндогенных средовых влияний; б) генетических поломок; в) сочетанного влияния генетических и средовых факторов. Сочетание возможного воздействия генетических и средовых факторов определяется как мультифакторная природа патологии. ВПС как следствия тератогенных эффектов возникают в результате воздействия вредных факторов на плод в критический период развития (8–12 недель беременности). Генетическая природа ВПС определяется у 14% детей, хромосомные синдромы при ВПС диагностируются у 36% больных[3].
Нозологическую принадлежность расстройств бывает трудно распознать в раннем возрасте. Поэтому наличие множественных пороков развития, внутриутробной гипотрофии, характерных стигм дизэмбриогенеза является основанием для осмотра генетиком с последующим обследованием.
Своевременная диагностика генетических синдромов помогает родителям узнать о прогнозе развития и жизни ребенка, принять адекватное решение о возможности воспитания малыша в семье, получить рекомендации по последующему деторождению. Врачи получают информацию о целесообразности и сроках оперативного вмешательства, возможных осложнениях, определяют тактику дальнейшего ведения пациента[3].
Синдром Вильямса (Уильямса) — предположительно аутосомно-доминантное заболевание, вызываемое мутацией в гене эластина, картированном на хромосоме 7g11.23. Частота заболевания составляет 1 : 10 000–20 000 новорожденных. Синдром описан в 1961 г. кардиологом из Новой Зеландии Дж. Уильямсом, который из своих пациентов выделил детей со сходными дефектами сердечно-сосудистой системы, с характерной внешностью и умственной отсталостью. Эти пациенты имеют особое строение лица (в специальной литературе названное «лицом эльфа»): широкий лоб, разлет бровей по средней линии, опущенные вниз полные щеки, большой рот с полными губами, плоское переносье, своеобразная форма носа с плоским тупым концом, маленький заостренный подбородок, глаза чаще голубые со своеобразным разрезом и припухлостью век. Характерный признак — особенности голоса: охриплость, грубоватость тембра, скрипучесть.
Часто отмечаются мышечная гипотония и связанные с ней изменения скелета: опущенные плечи, впалая грудь, круглая спина, плоскостопие, косолапость, часто паховая и пупочная грыжи. Для детей старшего возраста характерны длинные редкие зубы[4, 5].
В результате генетической поломки нарушается нормальный синтез эластина. С целью компенсации данного процесса начинается гиперпродукция последнего, происходит усиленная пролиферация гладкомышечных клеток внутрь просвета сосудов. Поражение сердечно-сосудистой системы при синдроме Вильямса наблюдается в 53–100% случаев и связано именно с эластиновой артериопатией: диагностируются ВПС (наиболее часто — надклапанный стеноз аорты и стеноз легочной артерии); с 2–5 лет обнаруживается гипертрофическая кардиомиопатия, часто развивается артериальная гипертензия[6].
Для данного синдрома характерна умственная отсталость разной степени выраженности; разнообразные психические нарушения усугубляют нарушения интеллекта. В раннем детском возрасте часто наблюдается гиперкальциемия, приводящая к гипотонии, запорам, анорексии, рвоте, полиурии, почечной недостаточности. С возрастом у части больных прогрессируют патология сердца и артериальная гипертензия, появляется сахарный диабет[4, 7].
Дифференциальный диагноз проводят с идиопатической инфантильной гиперкальциемией без лицевых и сердечных аномалий и с надклапанным аортальным стенозом[4].
Специфической терапии в настоящее время не существует, пациенты получают только симптоматическое лечение. С ними также проводится коррекционновоспитательная работа. Прогноз относительно благоприятный, возможна частичная социальная адаптация. Чаще всего синдром возникает спорадически, поэтому риск повторного рождения в семье ребенка с таким же заболеванием оценивается как низкий[7].
В доступной литературе[5, 7, 8] данный синдром диагностирован в возрасте старше года.
Цель публикации: продемонстрировать клиническое наблюдение за ребенком с синдромом Вильямса (генетически подтвержденным в 1,5 месяца) в сочетании с грубой неврологической патологией (последствиями раннего органического поражения головного мозга).
Ребенок находился на лечении в отделении детей раннего возраста (ОДРВ), неврологическом и пульмонологическом отделениях Детской городской клинической больницы г. Оренбурга (ГАУЗ «ДГКБ») в 2013–2015 гг. и по настоящее время наблюдается в детской поликлинике № 3, являющейся подразделением этой же больницы.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Анамнез. Мальчик К. родился 23 февраля 2013 года от первой беременности (беременность протекала на фоне кольпита, в 24 недели при УЗИ плода выявлена гипоплазия носа), первых срочных родов в 42 недели с массой тела 3070 г, длиной — 53 см, оценкой по шкале Апгар 4–6 баллов.
С рождения состояние расценивалось как тяжелое за счет дыхательной недостаточности (ДН) и неврологической симптоматики. Был выставлен диагноз «двусторонняя аспирационная пневмония, церебральная ишемия III степени, судорожный синдром, задержка внутриутробного развития по гипотрофическому типу», в связи с чем ребенок лечился в Оренбургском клиническом перинатальном центре до месячного возраста. Получал антибактериальные препараты (цефазолин, цефтазидим, амикацин, меропенем, эритромицин), иммунокорригирующую (иммуноглобулин человека нормальный внутривенно, интерферон альфа-2b ректально), инфузионную (глюкозо-солевые растворы с электролитами), симптоматическую терапию (диазепам, тиопентал, фенобарбитал с переходом на вальпроевую кислоту, полипептиды коры головного мозга скота, ацетазоламид, γ-аминоβфенилмасляной кислоты гидрохлорид, ингаляции с будесонидом), ИВЛ (189 часов). По внешним признакам был заподозрен синдром Вильямса. Кровь на молекулярно-генетическое исследование направлена в Москву (в медицинский центр «ФертиЛаб»).
В возрасте 1 месяца мальчик переведен для дальнейшего лечения в ОДРВ детского стационара Оренбурга в тяжелом состоянии за счет сердечной недостаточности (СН) и неврологической симптоматики. При повторной Эхо-КС впервые диагностирован ВПС: коарктация аорты, стеноз ветвей легочной артерии. В возрасте 1,5 месяца (05.04.2013) получен результат молекулярно-генетического исследования методом «микросателлитный анализ локусов критического района 7-й хромосомы D7S613, D7S1870, D7SELN1, D7SELNCA» — выявлена делеция исследуемых локусов.
В возрасте 3,5 месяца ребенок был прооперирован в Федеральном центре сердечно-сосудистой хирургии (ФЦ ССХ, г. Челябинск): произведена резекция части аорты, наложен анастомоз «конец в конец», выполнена пластика ствола легочной артерии. Через 9 дней после операции доставлен авиатранспортом в ОДРВ детского стационара Оренбурга в крайне тяжелом состоянии за счет СН и ДН 2-й степени, судорожного синдрома. На фоне развившегося раннего вторичного эндомиоперикардита в дальнейшем произошла рекоарктация аорты, возникла выраженная стабильная артериальная гипертензия.
На первом году жизни ребенок неоднократно получал лечение в ОДРВ ГАУЗ «ДГКБ» и других стационарах города с диагнозом: синдром Вильямса, генетически подтвержденный; корригированный врожденный порок сердца (резекция коарктации аорты с анастомозом «конец в конец», пластика ствола легочной артерии). Рекоарктация аорты на фоне раннего инфекционного эндомиоперикардита. Вторично выраженная стабильная артериальная гипертензия с поражением органов-мишеней. Недостаточность кровообращения IIБ стадии. Раннее органическое поражение головного мозга. Спастический тетрапарез с выраженными статико-динамическими нарушениями. Бульбарный, псевдобульбарный синдром. Симптоматическая эпилепсия. Синдром ликвородинамических нарушений. Гипотрофия пре- и постнатальная 2-й степени, период стабилизации. Атрофия зрительных нервов. Вторичная стойкая контрактура разгибателей нижних конечностей.
При госпитализации в ОДРВ ГАУЗ «ДГКБ» в возрасте 1 года (2014 г.): масса тела — 6357 г, рост — 68 см, кормление через зонд. По данным осмотра, бледен, плоская широкая переносица, эпикант, большой рот, полные губы, косоглазие, деформация ушей, цианоз носогубного треугольника, отеков не было, послеоперационный рубец по средней линии. В легких дыхание везикулярное, хрипов не было, частота дыхательных движений — 48–52 в минуту. Тоны сердца средней громкости, грубый систолический шум во II межреберье справа от грудины с иррадиацией на спину, ЧСС — 110–120 в минуту, АД — 120/60–130/70 мм рт. ст. Нижний край печени +2,5 см ниже края реберной дуги. Ребенок не сидел, голову не держал, за игрушками не следил.
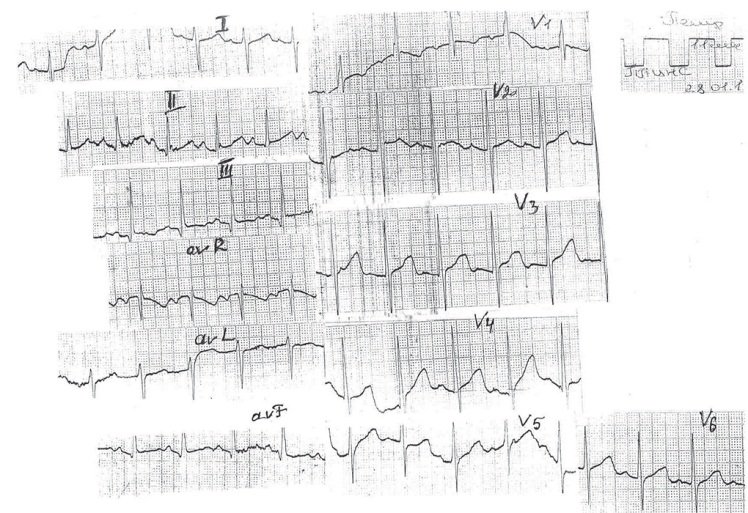
На ЭКГ: легкая синусовая тахиаритмия — 136–150 в минуту, повышение электрической активности миокарда обоих желудочков, правого предсердия (рис. 1).
Рис. 1. Электрокардиограмма больного К. в возрасте 1 года (2014 г.). Фото Лаптевой Н.М.
По данным Эхо-КС, состояние после коррекции ВПС: резекция части аорты, анастомоз «конец в конец», пластика ствола легочной артерии. Градиент давления в нисходящем отделе аорты — 85 мм рт. ст., градиент давления на легочной артерии — 20 мм рт. ст., увеличены правые отделы сердца, сократительная способность миокарда — 76%, уплотнены листки перикарда, расчетное давление в правом желудочке — 38–44 мм рт. ст.
На рентгенограмме грудной клетки: усиление и деформация сосудистого рисунка, в нижних отделах повышенная воздушность легочной ткани, синусы свободные, талия сердца сглажена, кардиоторакальный индекс (КТИ) — 60%.
Ребенок получал цефтриаксон, гидрохлоротиазид + триамтерен, фуросемид, каптоприл, вальпроевую кислоту, карбамазепин, калия и магния аспарагинат. В возрасте 1 года оформлена инвалидность.
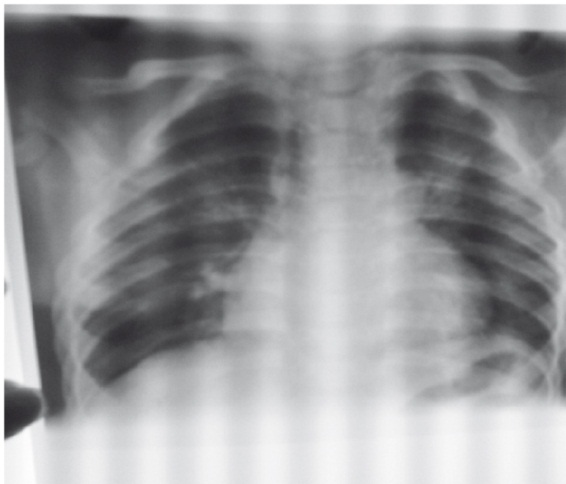
На втором году жизни проводилась коррекция противосудорожной терапии в неврологическом отделении ГАУЗ «ДГКБ». Ребенок перенес ОРВИ (лечение в инфекционной больнице), внебольничную двустороннюю очаговую пневмонию с токсикозом 2-й степени, ДН 2-й степени (лечение в пульмонологическом отделении ГАУЗ «ДГКБ»). На рентгенограмме органов грудной клетки сохранялась сглаженность талии сердца, КТИ — 56% (рис. 2).
Рис. 2. Рентгенограмма грудной клетки больного К. в возрасте 1 года 10 месяцев (2014 г.). Фото Лаптевой Н.М.
К концу второго года жизни ребенок переведен с зондового кормления на прием протертой жидкой пищи малыми порциями (каши, пюре).
При осмотре в 3,5 года: состояние стабильно тяжелое за счет артериальной гипертензии, неврологической симптоматики. Сохранялось отставание в весе (8,5 кг) и росте (82 см). Имелась выраженная задержка нервно-психического и моторного развития. Ребенок не сидел, за игрушками не следил, эмоции отсутствовали, произносил отдельные звуки. Наблюдалось вынужденное положение (лежал), движения в суставах нижних конечностей отсутствовали изза выраженной контрактуры. Отмечалось повышение АД до 140/80–150/80 мм рт. ст. На ЭКГ отклонение электрической оси сердца вправо, косвенные признаки повышения электрической активности левого желудочка. Эхо-КС: расчетное давление в правом желудочке — 35 мм рт. ст., незначительное расширение полости только правого желудочка, градиент давления на перешейке аорты — 76–78 мм рт. ст., выявлена гипертрофия левого желудочка.
На момент осмотра в 4 года 11 месяцев (январь 2018 г.) у пациента сохраняются задержка физического развития (вес — 10 кг, рост — 90 см), повышенное АД (до 140/80 мм рт. ст.), тяжелые нарушения неврологического статуса: голову не держит, вынужденное положение (постоянно лежит), лицо асимметричное, выраженная мышечная дистония, преобладание грубого гипертонуса (больше в ногах), крайне высокие проприоцептивные рефлексы, положительный синдром Бабинского, положительный хоботковый рефлекс, грубая задержка речевого и нервно-психического развития (произносит отдельные звуки), периодически отмечаются проявления судорожного синдрома, наблюдаются постоянные червеобразные движения в конечностях и лице. Констатирован также анкилоз крупных суставов рук и ног. На ЭКГ появилась легкая брадикардия — 94 в минуту, имеются косвенные признаки нагрузки на миокард левого желудочка. Эхо-КС: градиент давления на перешейке аорты возрос до 82 мм рт. ст., появилась митральная регургитация.
Ребенок постоянно получает каптоприл, гидрохлоротиазид + триамтерен (с 4 лет — замена на карведилол), комплекс противосудорожных препаратов; периодически — курсы толперизона, ноотропов, нейропептидов, ЛФК. Ежегодно осматривается кардиохирургом ФЦ ССХ г. Челябинска, в 2016 г. было рекомендовано проведение КТ сердца для рассмотрения вопроса об оперативном лечении (не сделано). На 2018 г. запланирована очная консультация кардиохирурга с обследованием в ФЦ ССХ г. Челябинска.
В течение последних 3 лет ребенок 2–3 раза в год переносит респираторные заболевания, лечится амбулаторно.
Родители генетически обследованы, здоровы (со слов участкового педиатра и кардиолога поликлиники). В семье воспитывается младший ребенок — здоровая девочка, родившаяся через полтора года после К.
Особенностями представленного клинического наблюдения являются ранняя диагностика заболевания (генетическое подтверждение в 1,5 месяца), сочетание синдрома Вильямса с грубой неврологической патологией (последствиями раннего органического поражения головного мозга), наступившая после развития вторичного эндомиоперикардита рекоарктация аорты с выраженной вторичной артериальной гипертензией.
Выраженная неврологическая симптоматика — спастический тетрапарез с вторичной стойкой контрактурой разгибателей нижних конечностей, грубая задержка речевого и нервно-психического развития с отсутствием социализации, судорожный синдром — не характерна для пациентов с синдромом Вильямса. Учитывая в основном спорадический характер появления этого заболевания, после проведенного генетического обследования родителей было принято решение о возможности последующего деторождения в семье.
ЗАКЛЮЧЕНИЕ
Ранняя диагностика генетического синдрома важна для родителей в плане получения информации о заболевании, его прогнозе для жизни ребенка, а также для принятия адекватного решения о возможности воспитания малыша в семье. Своевременное выявление генетической патологии помогает врачам разных специальностей определить тактику дальнейшего ведения ребенка, оценить возможность и целесообразность проведения хирургической коррекции, сроки оперативного вмешательства, риски послеоперационных осложнений и объем комплексной терапии, включая психолого-педагогическую помощь для социализации в обществе.








