В последние годы наблюдается рост частоты заболеваний органов мочевой системы (ОМС) у детей, в структуре которых доля микробновоспалительных поражений почек и мочевых путей достигает 80%. Поэтому данные поражения являются одними из наиболее распространенных инфекционных заболеваний, с которыми сталкиваются педиатры[1–3].
Пиелонефрит — это неспецифическое инфекционно-воспалительное заболевание почек с преимущественным поражением чашечнолоханочной системы, канальцев и интерстиция. Согласно классификации ВОЗ, пиелонефрит относится к группе тубулоинтерстициальных нефритов и фактически представляет собой тубулоинтерстициальный нефрит инфекционного генеза.
На сегодняшний день в России педиатры и нефрологи отмечают увеличение частоты пиелонефрита у детей; по данным разных авторов, она составляет от 4,8 до 35,1 на 1000[4–7]. Ранняя диагностика и лечение пиелонефрита крайне важны[8, 9].
Ввиду неспецифичности клинических симптомов пиелонефрита, особенно у детей раннего возраста, при постановке диагноза большое значение имеют лабораторные и инструментальные методы исследования. При обследовании детей предпочтение следует отдавать малоинвазивным методам с высокой чувствительностью. Таким образом, важной задачей в детской нефрологии являются разработка и поиск новых биомаркеров в моче для верификации бактериального воспаления в почечной ткани, которое в дальнейшем может приводить к развитию тубулоинтерстициального фиброза.
К наиболее интересным и наименее изученным биомаркерам относится молекула повреждения почек 1 (англ. kidney injury molecule 1, KIM-1) — поверхностный белок из суперсемейства иммуноглобулинов, содержание которого увеличивается на поверхности эпителиальных клеток при повреждении почек. Это вещество, относящееся к сложным белкам (полисахаридный комплекс с иммуноглобулином), не содержится в почках здоровых людей и животных, но в больших количествах присутствует в почках, пораженных различными патологическими процессами. KIM-1 сильнее прочих белков активируется при повреждении почек, локализуется преимущественно в апикальной мембране эпителия проксимальных канальцев[10, 11].
Установлено, что KIM-1 способствует резкой активизации фагоцитоза омертвевших клеток и значительно ускоряет процесс восстановления почечной ткани. Так, группой ученых из США под руководством T. Ichimura (2008) изучался механизм нарушений в паренхиме почек. В ходе сложного экспериментального исследования было определено, что после повреждения ткани почек в клетках эпителия начинает активно накапливаться KIM-1. Данное вещество воздействует на сохранившие жизнеспособность эпителиальные клетки и превращает их в фагоциты, способные поглощать погибшие клетки и их частицы. Таким образом, образующееся при повреждении почек вещество KIM-1 значительно усиливает фагоцитоз омертвевших клеток, что повышает интенсивность процесса восстановления структуры и функции почечной ткани[12].
В исследовании группы ученых под руководством A. Wasilewska (2011) обнаружено, что средние значения отношения KIM-1 к креатинину сыворотки крови у детей с тяжелым врожденным гидронефрозом значительно выше, чем у лиц с гидронефрозом, не требующим оперативного лечения (p < 0,05). Уровень KIM-1 в моче (uKIM-1) у здоровых детей был статистически значимо (p < 0,01) ниже, чем у пациентов с гидронефрозом, которым не показано оперативное лечение[13]. Однако информация относительно содержания KIM-1 в моче и диагностической значимости данного маркера при остром тубулоинтерстициальном нефрите инфекционного генеза в настоящее время отсутствует.
Цель исследования: изучить клиническую и диагностическую значимость определения уровня молекулы повреждения почек 1 в моче у детей с острым пиелонефритом.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 73 ребенка с острым пиелонефритом, госпитализированных в нефрологическое отделение Детской городской клинической больницы № 9 имени Г. Н. Сперанского Департамента здравоохранения Москвы: 41 ребенок без аномалий органов мочевой системы (ОМС) (первая группа) и 32 ребенка с острым пиелонефритом на фоне аномалий ОМС (вторая группа). Дети находились в возрасте от 1 года до 16 лет (средний возраст — 5,3 ± 2,18 года), в их числе было 56 девочек и 17 мальчиков (76,71% и 23,29% соответственно).
Контрольную группу составили 25 детей в возрасте от 1 года до 15 лет, в том числе 16 девочек и 9 мальчиков, не имевших заболеваний почек на момент обследования и в анамнезе. Дети не болели интеркуррентными заболеваниями и не прививались в течение последнего месяца.
Всем больным проводили обследование с использованием клинических, инструментальных и лабораторных методов. Наряду с общепринятыми лабораторными методами (общие анализы крови и мочи; бактериологическое исследование мочи; определение содержания мочевины и креатинина в крови, общего белка крови, прокальцитонина, креатинина в моче, концентрационной способности почек по пробе Зимницкого) применяли специальный метод исследования — определение экскреции KIM-1 с мочой. Уровень uKIM-1 измеряли с помощью иммуноферментного анализа (набор Human TIM-1/KIM1-/HAVCR Quantikine ELISA Kit, США) в соответствии с инструкцией производителя. Исследование проводилось на автоматическом микропланшетном фотометре. Показатель uKIM-1 выражался в нанограммах на миллилитр, предел обнаружения — 0,003 нг/ мл. Для стандартизации результатов определяли содержание креатинина в каждой порции мочи и пересчитывали уровень uKIM-1 на 1 мг креатинина (uКIМ1/Cr).
Инструментальное исследование включало УЗИ почек и мочевого пузыря. Микционную цистографию проводили через 3 и более месяцев после дебюта острого пиелонефрита. Статическую нефросцинтиграфию выполняли через 6 месяцев после дебюта заболевания с использованием радиофармпрепарата 99mТс-Teхнемек (DMSA) активностью 100–150 МБк в зависимости от возраста и веса ребенка. Исследование осуществляли в отделении радионуклидной диагностики Российского научного центра рентгенорадиологии Минздрава России (заведующий отделением — профессор Фомин Д. К.).
Статистическая обработка полученных результатов проводилась c использованием программы Statistica 6.0 for Windows с расчетом таблиц сопряженности качественных признаков, определением критерия хи-квадрат (χ²) Пирсона и корреляционным анализом. Для сравнения количественных данных использовали U-тест Манна — Уитни или t-критерий Стьюдента. Различия показателей считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
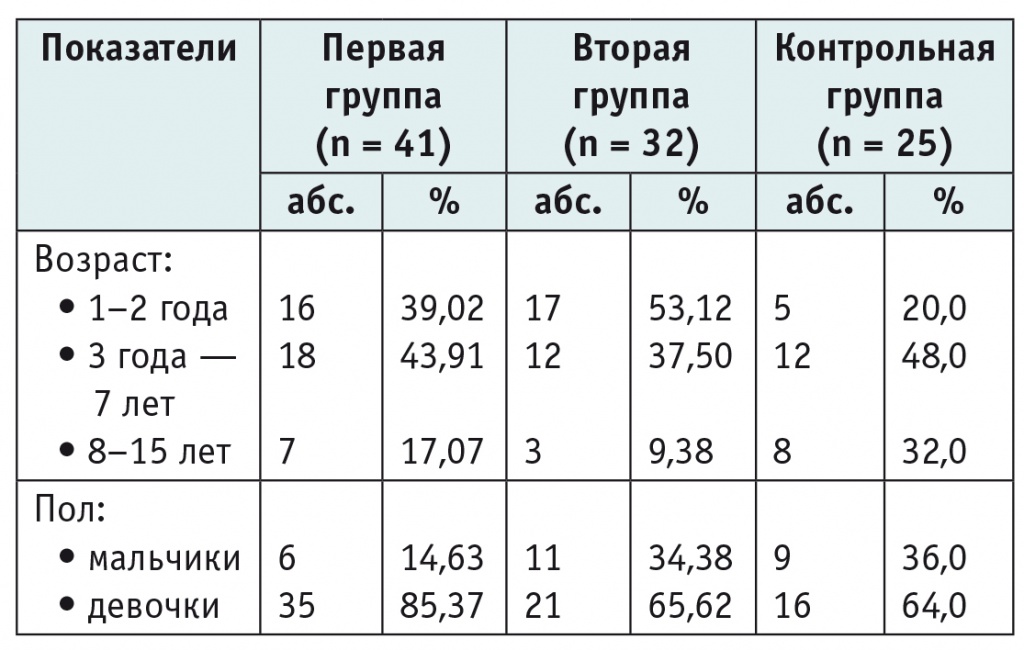
По данным комплексного клинико-лабораторного и инструментального обследования среди детей с дебютом пиелонефрита были выделены две группы. В первую группу вошли дети с острым пиелонефритом, у которых не было выявлено аномалий ОМС (n = 41), вторую группу составили дети с острым пиелонефритом на фоне различных впервые выявленных аномалий ОМС (n = 32). В обеих группах преобладали дети в возрасте до 7 лет и девочки (табл. 1). Контрольная группа по возрасту и полу не имела статистически значимых отличий от основных групп.
Таблица 1
Распределение детей основных и контрольной групп по возрасту и полу
У всех детей с дебютом пиелонефрита в возрасте от 1 года до 2 лет наблюдались фебрильная лихорадка, симптомы интоксикации; пастозность лица отмечена у 84,8% детей, диспепсические явления выявлены у 30,3%. Среди детей 3–7 лет отмечались наибольшая частота (40,0%) нарушений мочеиспускания и появление недержания мочи. Для данной группы был характерен также болевой абдоминальный синдром (36,7%). В старшей возрастной группе болезненность живота при пальпации и положительный симптом Пастернацкого регистрировались у 80,0% и 70,0% детей соответственно.
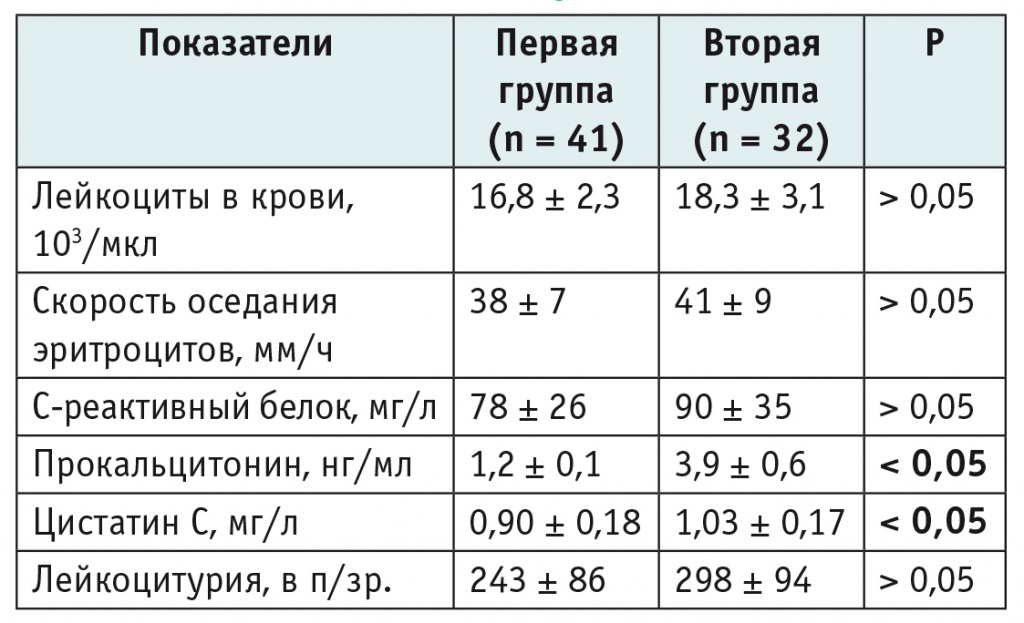
При лабораторном обследовании у всех детей первой и второй групп выявлялись массивная лейкоцитурия, бактериурия, лейкоцитоз со сдвигом лейкоцитарной формулы влево, ускорение СОЭ, повышение концентрации С-реактивного белка (табл. 2). Однако у детей из второй группы наблюдения отмечены статистически значимо (р < 0,05) более высокие уровни прокальцитонина и цистатина С в крови.
Таблица 2
Лабораторные показатели у детей с острым пиелонефритом при поступлении, М ± σ
При проведении микробиологического исследования мочи у 25 (61,0%) детей первой группы отмечался высев грамотрицательной флоры (кишечная палочка, клебсиелла, энтеробактер). Среди детей второй группы данная флора высевалась чаще — у 21 ребенка (65,6%).
В общих анализах мочи у детей первой группы обнаружены незначительная протеинурия (0,099–0,5 г/л) у 36 (87,8%) детей и умеренная протеинурия (1–3 г/л) у 5 (12,2%); микрогематурия выявлена у 15 детей (36,6%), цилиндрурия (гиалиновые и зернистые) — у 39 (95,1%). Во второй группе наблюдения статистически значимых отличий по данным показателям не установлено. Незначительная протеинурия (0,099–0,5 г/л) отмечена у 26 (81,2%) детей, умеренная протеинурия (1–3 г/л) — у 6 (18,8%); микрогематурия и цилиндрурия (гиалиновые и зернистые) обнаружены у 14 (43,8%) и 100% детей соответственно.
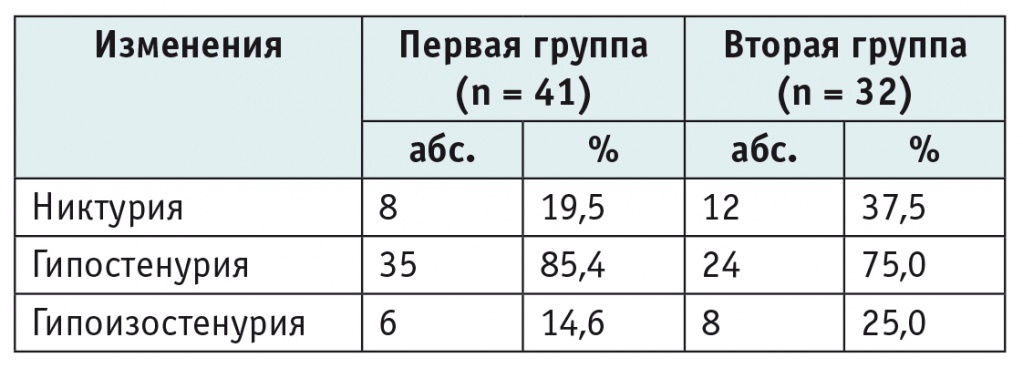
Снижение концентрационной функции почек регистрировалось у всех детей с дебютом пиелонефрита. Однако у больных второй группы установлена тенденция к более частому развитию никтурии и гипоизостенурии (табл. 3).
Таблица 3
Состояние концентрационной функции почек у детей с острым пиелонефритом
Для оценки гломерулярной функции почек была определена скорость клубочковой фильтрации по Шварцу у детей в группах сравнения (табл. 4). У пациентов с дебютом вторичного пиелонефрита несколько чаще диагностировались гиперфильтрация и умеренное снижение скорости клубочковой фильтрации.
Таблица 4
Состояние гломерулярной функции почек у детей с острым пиелонефритом
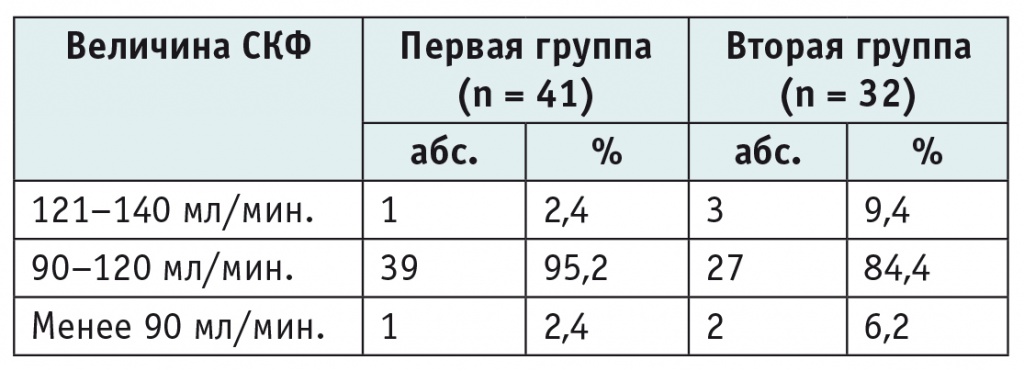
Примечание. СКФ — скорость клубочковой фильтрации (по формуле Шварца).
Всем детям групп наблюдения через 3 и более месяцев после дебюта острого пиелонефрита была проведена микционная цистография. По ее результатам в первой группе пузырно-мочеточниковых рефлюксов (ПМР) и пороков развития уретры и мочевого пузыря не выявлено. Во второй группе одно или двухсторонний ПМР 1–2-й степени диагностирован у 25 (78,1%) детей, ПМР 3–4-й степени — у 6 (18,8%) детей и ПМР 5-й степени — у одного ребенка (3,1%). У одного ребенка второй группы обнаружены рентгенологические признаки клапана задней уретры.
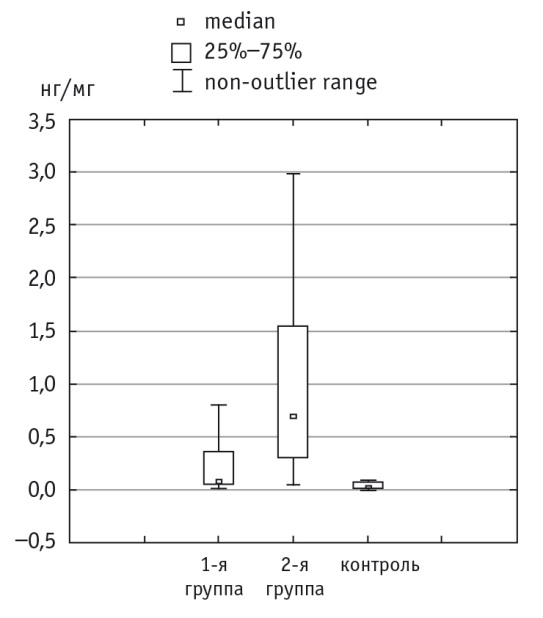
Показатель uКIМ1/Cr у больных первой группы при активно текущем микробно-воспалительном процессе в почечной ткани составил 0,21 ± 0,12 нг/мг (М ± σ). Во второй группе он был статистически значимо выше — 0,96 ± 0,16 нг/мг (p < 0,05) (рис. 1). В контрольной группе детей величина uКIМ1/Cr была равна 0,07 ± 0,001 нг/мг и статистически значимо (p < 0,05) отличалась от таковой у пациентов первой и второй групп наблюдения.
Рис. 1. Уровень uКIМ-1/Cr у детей с острым пиелонефритом при поступлении, нг/мг.
Примечание. Различие между основными группами и отличия основных групп от контроля статистически значимы: p < 0,05
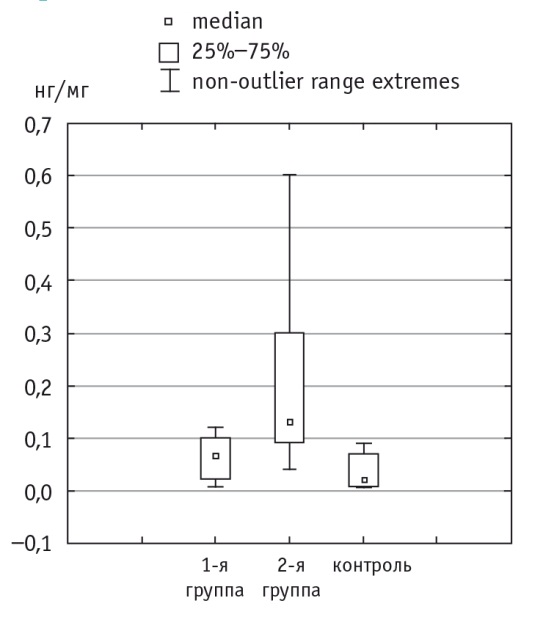
В первой и второй группах на фоне проведения антибактериальной терапии отмечено статистически значимое (р < 0,05) снижение уровня uКIМ1/Cr: до 0,11 ± 0,02 нг/мг и 0,19 ± 0,06 нг/мг соответственно. При этом, в отличие от первой группы, во второй группе его значения все еще превышали таковые у детей без заболеваний почек (р < 0,05). После антибактериальной терапии между двумя группами наблюдения сохранились статистически значимые (р < 0,05) различия по уровню uКIМ1/Cr (рис. 2).
Рис. 2. Уровень uКIМ-1/Сr у детей с острым пиелонефритом на 10–14-й день антибактериальной терапии, нг/мг.
Примечание. Различие между основными группами и отличис второй группы от контроля статистически значимы: p < 0,05
При динамическом наблюдении в течение 9–15 месяцев после дебюта пиелонефрита рецидивы заболевания в первой группе отмечались у 3 (7,3%) пациентов, во второй группе статистически значимо чаще — у 9 детей (28,1%, р < 0,05). Величина uКIМ1/Cr у детей из второй группы с рецидивами пиелонефрита при поступлении в стационар превышала 0,85 нг/мг, рецидивы в данной группе наблюдения отмечены среди детей с выявленным ПМР 2–5-й степени.
У детей с дебютом пиелонефрита установлена прямая корреляционная связь величины uКIМ1/Сr с протеинурией (r = 0,65; р < 0,05) и гематурией (r = 0,59), выявленной до начала проведения антибактериальной терапии.
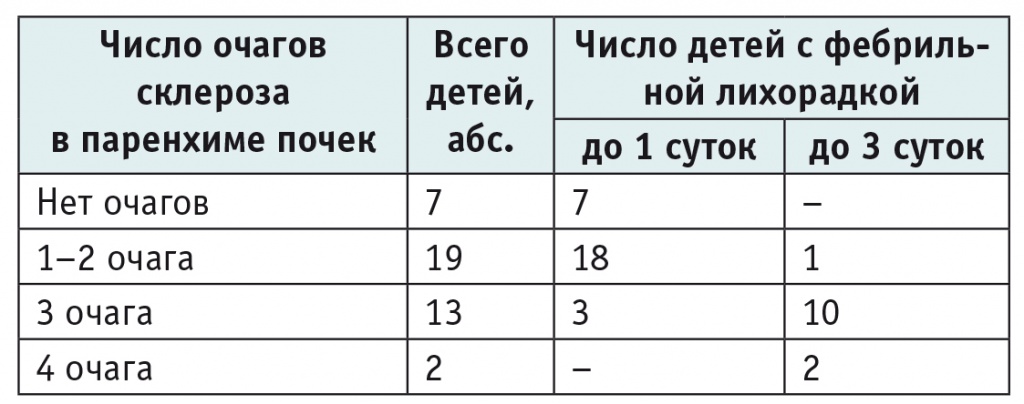
В первой группе у 34 (82,9%) пациентов на статической нефросцинтиграфии, проведенной через 6 месяцев после атаки пиелонефрита, обнаружены очаговые изменения в паренхиме почек. Из них у 19 больных отмечены 1–2 очага, у 13 пациентов — 3 очага, у 2 детей диагностированы 4 очага склероза. Нарушений накопительновыделительной функции почек в данной группе не зафиксировано. Группу больных острым пиелонефритом с длительностью фебрильной лихорадки от начала антибактериальной терапии до 3 суток (13 пациентов) составили только дети, у которых сформировались от 2 до 4 очаговых изменений в паренхиме почек по данным статической нефросцинтиграфии (табл. 5).
Таблица 5
Длительность фебрильной лихорадки у детей первой группы в зависимости от степени изменений в паренхиме почек по данным статической нефросцинтиграфии, проведенной через 6 месяцев после дебюта заболевания
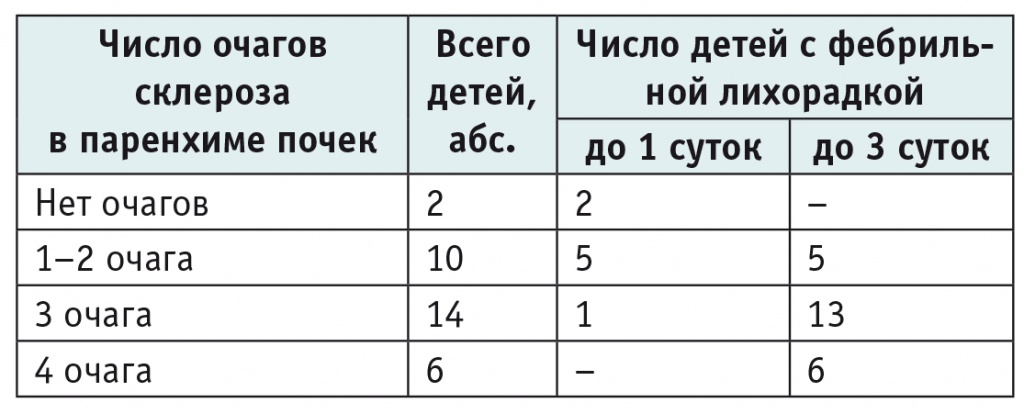
Во второй группе по результатам статической нефросцинтиграфии у 30 (93,8%) пациентов обнаружены очаги склероза. Из них у 10 больных отмечены 1–2 очага, у 14 пациентов — 3 очага, у 6 детей диагностированы 4 очага склероза. У 8 (25,0%) детей выявлено умеренное снижение накопительновыделительной функции почек. В группу детей с длительностью фебрильной лихорадки до 3 суток (24 ребенка) вошли, в частности, все пациенты с формированием 4 очаговых изменений в паренхиме почек (6 детей) и все пациенты (8 детей) с умеренным снижением накопительно-выделительной функции почек по данным статической нефросцинтиграфии (табл. 6).
Таблица 6
Длительность фебрильной лихорадки у детей второй группы в зависимости от степени изменений в паренхиме почек по данным статической нефросцинтиграфии, проведенной через 6 месяцев после дебюта заболевания
Установлена сильная прямая корреляционная связь (r = 0,83; р < 0,05) между повышением uКIМ1/Cr в острый период пиелонефрита у пациентов обеих групп и формированием в дальнейшем 3 и более очагов повреждения паренхимы почек по результатам статической нефросцинтиграфии.
Проведена оценка уровня uКIМ1/Сr у детей с дебютом вторичного пиелонефрита в зависимости от степени ПМР по данным микционной цистографии. При ПМР 1–2-й степени (25 детей) уровень uКIМ1/Сr составил 0,45 ± 0,08 нг/мг, при ПМР 3–4-й степени (6 детей) он увеличился до 1,05 ± 0,42 нг/мг (р < 0,05) и при ПМР 5-й степени (1 ребенок) — до 1,14 нг/мг. У одного пациента с клапаном задней уретры этот показатель был равен 0,57 нг/мг. При стихании микробно-воспалительного процесса в паренхиме почек статистически значимых различий по уровню КIМ1/Сr не выявлено.
При обнаружении ПМР у всех детей исследовали соотношение альбумин/креатинин в утренней моче. В группе детей с ПМР 1–2-й степени данное соотношение не превышало 7 мг/г, среди пациентов с ПМР 3–4-й степени оно отмечалось в диапазоне 5–37 мг/г, у пациента с ПМР 5-й степени составило 28 мг/г.
ОБСУЖДЕНИЕ
В исследовании определено, что в дебюте пиелонефрита уровень uКIМ1/Cr выше в группе детей с нарушениями уродинамики в виде ПМР. На 10–14-й день антибактериальной терапии значения uКIМ1/Cr в первой группе и группе контроля статистически значимых различий не имели. Во второй группе данный показатель снизился, однако остался статистически значимо выше, чем в первой и контрольной группах. Вероятно, это можно объяснить дополнительным повреждающим фактором у пациентов второй группы в виде нарушения уродинамики и усугубления степени гипоксии канальцев почки, что в дальнейшем способствовало формированию более выраженных очагов нефросклероза в паренхиме почек.
В остром периоде заболевания выявлено статистически значимое повышение уровня цистатина С у пациентов с острым пиелонефритом на фоне аномалий ОМС. Это может свидетельствовать о более значимых изменениях в паренхиме почек и о длительном существовании нарушений уродинамики до дебюта пиелонефрита у данных пациентов. Установлены прямая корреляционная связь между величиной uКIМ1/Сr и протеинурией у детей с дебютом пиелонефрита, а также прямая зависимость между повышением уровня uКIМ1/Cr в острый период пиелонефрита у пациентов обеих групп и формированием в дальнейшем 3 и более очагов повреждения паренхимы почек по результатам статической нефросцинтиграфии.
Полученные данные указывают на необходимость дальнейшего изучения значимости uKIM-1 как одного из диагностических маркеров повреждения почечной паренхимы. В связи с этим важно определить диагностическое значение этого показателя при обострении хронических микробно-воспалительных заболеваний мочевой системы, латентном течении воспалительного процесса, развитии пиелонефрита на фоне врожденных аномалий развития мочевой системы.
ЗАКЛЮЧЕНИЕ
Показано, что определение экскреции молекулы повреждения почек 1 с мочой является доступным и неинвазивным методом раннего выявления гипоксического, токсического или микробного поражения почечной паренхимы, повышающим качество дифференциальной диагностики и выбора тактики ведения больных с микробно-воспалительными заболеваниями мочевой системы. Однако для подтверждения полученных результатов необходимы дальнейшие исследования с большими группами пациентов, проводимые в динамике.








