ВВЕДЕНИЕ
Острые респираторные заболевания занимают первое место как в общей структуре детской заболеваемости, так и среди всех инфекционных болезней. Возбудителями острых заболеваний респираторного тракта преимущественно становятся вирусы (> 200 групп, 6 семейств, 10 родов). Респираторный эпителий является не только входными воротами для возбудителей инфекций — именно там запускается каскад воспаления и формируется активный противовирусный ответ[1].
Местные факторы защиты слизистой оболочки респираторного тракта помогают предотвратить инфицирование и развитие клинически выраженного воспаления. Один из главных защитных механизмов респираторного тракта — система мукоцилиарного клиренса: реснички на поверхности эпителиальных клеток совершают синхронные биения в перицилиарном слое секрета, продвигая слизь к выходу из респираторного тракта[2]. По данным разных авторов, частота биения ресничек у детей достигает 10–15 Гц[3, 4].
Помимо реснитчатых клеток, в эпителиальном пласте имеются и бокаловидные клетки, продуцирующие слизь. Эффективность мукоцилиарного клиренса зависит как от координированной работы ресничек, так и от продукции адекватной по количеству и вязкости слизи[5].
Каскад воспаления в ответ на инфицирование приводит к повреждению респираторного эпителия. Происходят гибель и слущивание реснитчатых клеток, повреждение и потеря ресничек, снижение частоты биений и синхронности работы ресничек. При острой респираторной вирусной инфекции (ОРВИ) отмечается значительное и длительное (до 32 дней) нарушение функции мукоцилиарного клиренса. Кроме того, за счет повышения проницаемости сосудов развивается отек слизистой оболочки[1].
На фоне воспаления увеличивается количество бокаловидных клеток, усиливается работа бронхиальных желез, что приводит к гиперпродукции слизи. Меняются и реологические свойства слизи в сторону повышения ее вязкости, что вносит дополнительный вклад в нарушение мукоцилиарного клиренса[6]. Мукоцилиарная недостаточность создает благоприятные условия для колонизации слизистой оболочки патогенными микроорганизмами.
В секрете слизистой оболочки респираторного тракта содержатся такие местные факторы защиты, как лизоцим, α- и β-дефензины, кателицидин, лактоферрин, ингибиторы протеаз, пептидазы, муцины, а также секреторный иммуноглобулин А (sIgA)[5, 7, 8]. sIgA является основным классом иммуноглобулинов секретов слизистых оболочек и играет ключевую роль в их защите от проникновения патогенов (мукозальный иммунитет)[5, 9].
sIgA вырабатывается плазматическими клетками в слизистой оболочке. Сывороточный IgA существует преимущественно в форме мономера, в то время как секреторный IgА представлен полимерными молекулами, в основном в форме димера[5, 10]. Такой димер sIgA представляет собой два соединенных мономера IgA и дополнительный полипептид, который называется секреторным компонентом. Образованный плазматическими клетками sIgA связывается с рецептором pIgR на базолатеральной поверхности эпителия, затем происходят эндоцитоз комплекса «рецептор —sIgA» и его транспорт в везикулах через эпителий на поверхность слизистой оболочки[10, 11].
Концентрация sIgA на поверхности слизистых зависит от наличия и функциональной активности эпителиального рецептора pIgR, который участвует в транспорте sIgA на поверхность слизистых[12]. Экспрессия pIgR может изменяться под действием провоспалительных цитокинов, поэтому воспаление слизистой оболочки иногда сопровождается локальным повышением секреции IgA[13]. На синтез иммуноглобулинов могут воздействовать многие факторы, такие как стресс, неполноценное питание, нарушение сна, а также инфекционные и неинфекционные заболевания[14]. На синтез IgA способны влиять и микробиота слизистой оболочки, и пробиотики[14, 15]. Так, например, показано, что Lactobacillus paragasseri sp. nov. (LG2055) стимулирует синтез и сывороточного IgA, и sIgA в слюне и предотвращает вирусные инфекции[14].
Молекулярная стабильность и выраженные противовоспалительные свойства sIgA обеспечивают защиту слизистых оболочек от микроорганизмов[16]. sIgA связывается с микроорганизмами, блокируя их адгезию на слизистых оболочках[5, 17], а также препятствует репликации вирусов в эпителии, нейтрализуя их путем слияния эндосом, транспортирующих sIgA от базальной части эпителия к апикальной, и эндосом с вирусом из апикальной части эпителия[13]. Внутриклеточная нейтрализация с помощью IgA показана при таких респираторных вирусах, как грипп и парагрипп[9].
Уровень sIgA может служить показателем местного мукозального иммунитета. В связи со сложностью и/или инвазивностью сбора назального и бронхиального секрета чаще всего в исследованиях определяют концентрацию sIgA в слюне[18–20].
Еще одним защитным механизмом респираторного тракта является кашель. У детей раннего возраста вследствие анатомо-физиологических особенностей (узость дыхательных путей, относительно густой бронхиальный секрет, затруднение его эвакуации из респираторного тракта, недоразвитие мышечной оболочки бронхов, слабый кашлевой рефлекс) кашель на фоне респираторных инфекций часто бывает неэффективным[21, 22].
Действие мукоактивных препаратов направлено на изменение реологических свойств слизи и стимуляцию выведения вязкого секрета из дыхательных путей. Представителем мукоактивных препаратов, относящихся к группе мукорегуляторов, является карбоцистеин. Карбоцистеин изменяет состав продуцируемого секрета за счет активации фермента бокаловидных клеток слизистой оболочки бронхов — сиаловой трансферазы. Регуляция соотношения кислых и нейтральных сиаломуцинов бронхиального секрета нормализует вязкость слизи и облегчает ее выведение.
Карбоцистеин снижает количество и активность бокаловидных клеток, регулируя выработку слизи. Изменения качественного состава слизи происходят без увеличения ее объема, что имеет большое значение в педиатрической практике[23].
Цель исследования: оценить влияние карбоцистеина на течение кашля и уровень sIgA в слюне у детей с ОРВИ и наличие корреляции между уровнем sIgA в слюне и суммарным индексом кашля.
МАТЕРИАЛЫ И МЕТОДЫ
В 2021–2022 гг. было проведено многоцентровое наблюдательное исследование по оценке уровня sIgA в слюне у детей с ОРВИ на фоне терапии карбоцистеином. Центрами исследования стали Университетская детская клиническая больница ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (г. Москва — профессор Геппе Н.А.), поликлиника № 1 Городской клинической больницы № 2 им. Е.Г. Лазарева (г. Тула — к. м. н. Кожевникова Т.Н.), Городская детская клиническая больница № 17 (г. Уфа — профессор Файзуллина Р.М.), Детская городская клиническая больница № 1 (г. Тверь — к. м. н. Ермакова И.Н.).
В исследование включены 156 детей старше 2 лет (средний возраст — 4,4 ± 1,2 года) с ОРВИ, сопровождавшейся кашлем. Длительность ОРВИ на момент включения в исследование не превышала 48 ч. Все пациенты имели показания к назначению муколитической терапии и получали карбоцистеин (Флюдитек) в возрастной дозировке в соответствии с утвержденной инструкцией по применению.
В ходе исследования определяли:
-
суммарный индекс кашля и его изменение на фоне терапии карбоцистеином;
-
число пациентов, выздоровевших к 7–10-му дню от начала заболевания;
-
уровень sIgA в слюне и его изменение на фоне приема карбоцистеина;
-
корреляцию между изменением уровня sIgA слюны и суммарным индексом кашля на фоне терапии карбоцистеином.
Суммарный индекс кашля оценивали дважды: при включении пациента в исследование (1–2-й день от начала заболевания) и через 7–10 дней от начала ОРВИ. Суммарный индекс кашля — сумма дневного и ночного индексов кашля. Он отражает оценку выраженности кашля пациентом и/или его родителями в баллах от 0 до 5.
Дневной индекс кашля:
0 баллов — кашель отсутствует;
1 балл — единичные эпизоды кашля;
2 балла — кратковременные эпизоды кашля более 2 раз;
3 балла — частый кашель, не влияющий на дневную активность;
4 балла — частый кашель, снижающий дневную активность;
5 баллов — тяжелый кашель, при котором невозможна обычная активность.
Ночной индекс кашля:
0 баллов — кашель отсутствует;
1 балл — кашель, не прерывающий сон, или однократное пробуждение из-за кашля;
2 балла — кашель, приводящий к прерыванию сна не более 2 раз;
3 балла — кашель, приводящий к прерыванию сна более 2 раз;
4 балла — частый кашель почти всю ночь;
5 баллов — кашель в течение большей части ночи, мешающий сну.
Уровень sIgA в слюне оценивали дважды: при включении пациента в исследование (1–2-й день от начала заболевания) и через 7–10 дней. За 30 минут до сбора слюны ребенок не пил и не принимал пищу. Стерильный ватный тампон помещали в ротовую полость на 2–3 минуты для пропитывания слюной. Затем тампон клали в специальную пробирку Salivette, закрывали крышкой и помещали в морозильную камеру. Концентрацию sIgA в слюне определяли методом конкурентного иммуноферментного анализа.
Исследование одобрено локальным этическим комитетом ФГАОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский Университет) и Независимым междисциплинарным комитетом по этической экспертизе клинических исследований. Законные представители всех детей подписывали добровольное информированное согласие на их участие в исследовании.
Статистическая обработка данных проводилась с использованием программ Stata 14 и BioStat Pro 7.6.5. Применялись стандартные методы описательной статистики. В случае нормального распределения данные представлены в виде среднего значения и стандартного отклонения. При отсутствии нормального распределения данные представляли в виде медианы и интерквартильного размаха — Ме (25%; 75%). Для сравнения двух групп использовали критерий Манна —Уитни. Сравнение нескольких групп проводилось с помощью теста Краскела — Уоллиса. Корреляционный анализ выполняли при помощи коэффициентов корреляции Пирсона и Спирмена. Статистическая значимость устанавливалась при значении р < 0,05.
РЕЗУЛЬТАТЫ
Частота развития ОРВИ в анамнезе у включенных в исследование пациентов составляла от 1 до 8 раз в год (3,4 ± 1,4 раза в год). Отягощенный аллергологический анамнез отмечен у 38 (24,4%) больных. На момент обследования у 25 (16%) детей имелись сопутствующие заболевания (бронхиальная астма, аллергический ринит, атопический дерматит, хронический артрит, дискинезия желчевыводящих путей и др.). При включении в исследование у 20 (12,8%) участников диагностирована легкая ОРВИ, у 113 (72,5%) — средней тяжести, у 23 (14,7%) — тяжелая.
Повышение температуры тела наблюдалось у 76 (48,7%) пациентов, средняя продолжительность — 1,6 ± 0,5 дня. Сухой кашель был у 101 (64,7%), влажный — у 55 (35,3%) детей. Суммарный индекс кашля имел следующие значения: 2 балла — 32 (20,5%), 3 балла — 83 (53,2%), 4 балла — 13 (8,3%), 5 баллов — 20 (12,8%), 6 баллов — 8 (5,2%) пациентов. Ринит отмечен у 119 (76,3%) больных.
Поскольку исследование было наблюдательным, врачи, помимо карбоцистеина, могли также назначить другую терапию, кроме муколитиков (назальные солевые растворы, деконгестанты, противовирусные, при необходимости — антибактериальные препараты и др.).
На момент второго визита (7–10-й день от начала заболевания) 132 (84,6%) ребенка выздоровели, у остальных 24 (15,4%) зафиксированы нормализация температуры тела и положительная динамика кашля. Длительность ОРВИ у выздоровевших составила от 4 до 12 дней, средняя продолжительность — 8,0 ± 1,4 дня.
Суммарный индекс кашля на втором визите уменьшился у 154 (98,7%) больных и имел следующие значения: 0 баллов — 110 (70,5%), 1 балл — 34 (21,8%), 2 балла — 9 (5,8%), 3 балла — 3 (1,9%). Средняя продолжительность кашля — 6,5 ± 1,8 дня.
Выявлено статистически значимое снижение суммарного индекса кашля к 7–10-му дню заболевания (p < 0,0001) (табл. 1, рис. 1).
Таблица 1
Динамика суммарного индекса кашля, баллы
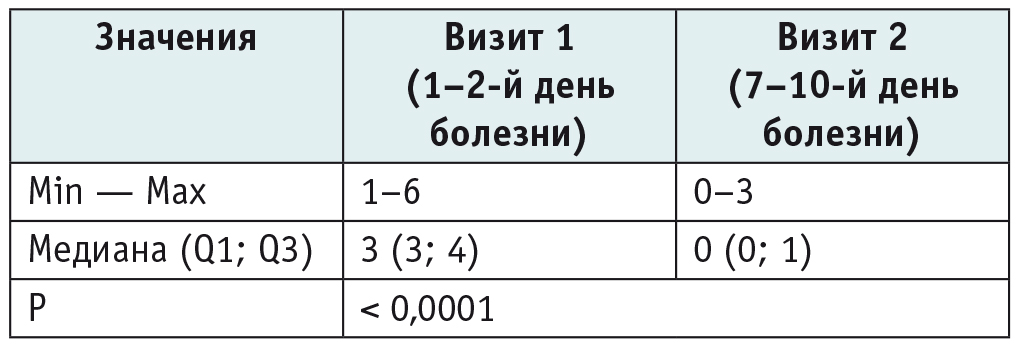
Рис. 1. Динамика суммарного индекса кашля, баллы
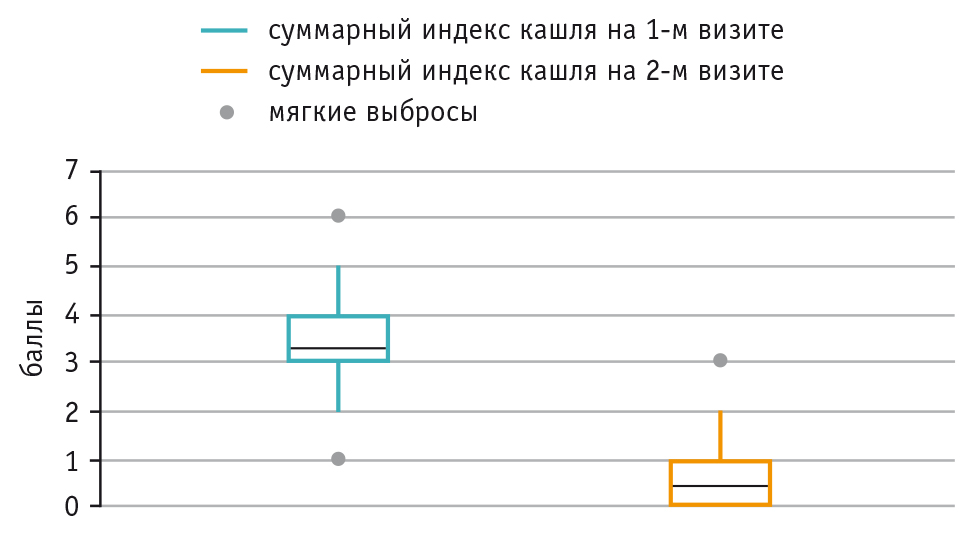
Уровень sIgA в слюне на первом визите (при включении пациентов в исследование) составил от 0,24 до 553,12 мкг/мл, медиана — 26,49 (8,94; 56,51) мкг/мл, на втором визите (7–10-й день заболевания) — от 0,12 до 408,20 мкг/мл, медиана — 30,07 (8,52; 60,40) мкг/мл. Значимые различия в концентрациях sIgA в слюне в начале заболевания и на 7–10-е сутки не выявлены (р = 0,823) (рис. 2).
Рис. 2. Динамика концентрации секреторного иммуноглобулина А (sIgA) в слюне
Прирост уровня sIgA в динамике отмечен у 68 (43,6%) детей: у 16 он составил < 20%, у 12 — от 20 до < 50%, у 12 — от 50 до < 100%, у 28 — 100% и более.
Таким образом, у 52 (76,5%) детей из этой группы прирост содержания sIgA был существенным и составил 20% и более от исходного значения. Медиана прироста — 15,59 (5,83; 31,29) мкг/мл.
Снижение концентрации sIgA в динамике произошло у 87 пациентов (55,8%): у 31 — на < 20%, у 31 — от 20 до < 50%, у 25 — от 50 до < 100%. Медиана снижения: –10,01 (–4,98; –21,02) мкг/мл.
У одного (0,6%) ребенка динамика отсутствовала.
При сравнении уровней sIgA в разных подгруппах не найдены статистически значимые различия этого показателя при легкой, среднетяжелой и тяжелой ОРВИ, а также у детей с наличием или отсутствием аллергологического анамнеза. Не выявлены и различия по суммарному индексу кашля между больными, у которых отмечен прирост содержания sIgA в динамике или его снижение/отсутствие динамики.
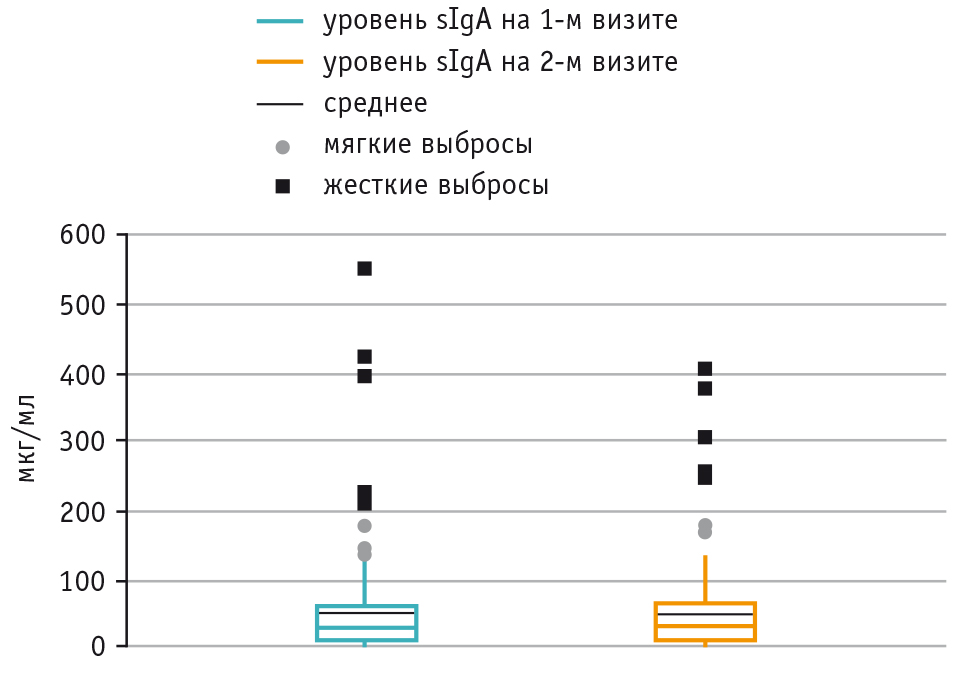
Обнаружена значимая корреляция между концентрациями sIgA в слюне на первом и втором визитах (коэффициент корреляции Спирмена — 0,7624, t = 14,6208, p < 0,001) (рис. 3).
Рис. 3. Корреляция между уровнями секреторного иммуноглобулина А (sIgA) на первом и втором визитах
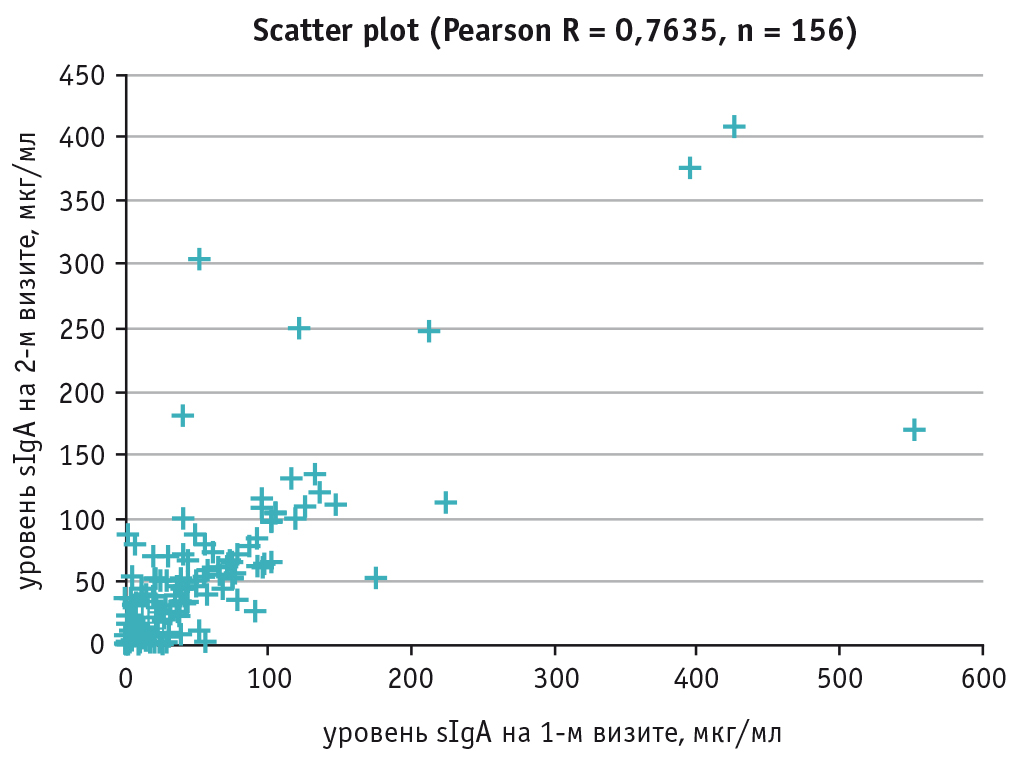
Значимая корреляция между суммарным индексом кашля и уровнем sIgA отсутствовала. Не найдена также корреляция между частотой ОРВИ в анамнезе и содержанием sIgA, между степенью тяжести ОРВИ и уровнем sIgA, между продолжительностью ОРВИ и изменением концентрации sIgA.
В данном исследовании зарегистрированы 7 эпизодов нежелательных явлений у 7 (4,5%) пациентов, в том числе ушиб, рвота, диарея, головная боль, крапивница, расцененные как не связанные с приемом карбоцистеина. Все нежелательные явления были легкими, не потребовали отмены препарата и завершились выздоровлением детей.
ОБСУЖДЕНИЕ
Карбоцистеин оказывает положительное влияние на мукоцилиарный клиренс благодаря нормализации реологических свойств бронхиального секрета и стимуляции работы ресничек эпителия, преимущественно за счет увеличения амплитуды биения ресничек. Такой эффект достигается путем повышения внутриклеточного рН и усиления транспорта ионов хлора, что способствует уменьшению внутриклеточной концентрации ионов хлора[24, 25].
Кроме основного мукорегуляторного действия, карбоцистеин обладает важными дополнительными свойствами — антиоксидантным и противовоспалительным, что снижает возможность прикрепления бактерий к слизистой оболочке и репликации вирусов. Показано, что карбоцистеин уменьшает концентрации провоспалительных цитокинов (иммуноглобулинов 1, 6, 8) в респираторном эпителии в ответ на инфицирование респираторно-синцитиальным вирусом, а также экспрессию рецептора в эпителии для риновируса. Карбоцистеин снижает адгезию на эпителии таких патогенов, как Moraxella catarrhalis, Haemophilus influenzae, Streptococcus pneumoniae[26].
По данным литературы, карбоцистеин оказывает положительное влияние на факторы местной иммунной защиты, усиливая выработку sIgA, лизоцима и сульфгидрильных групп компонентов слизи, регулирует фагоцитоз[27, 28]. При совместном использовании с антибиотиками при инфекциях верхних и нижних дыхательных путей карбоцистеин повышает их эффективность вследствие разрушения бактериальных биопленок[27].
Клиническая эффективность, безопасность и хорошая переносимость карбоцистеина подтверждены в ранее проведенных клинических исследованиях у детей с острыми респираторными заболеваниями: препарат значимо сокращал продолжительность кашля, длительность влажных хрипов в легких, выраженность бронхообструктивного синдрома, сроки госпитализации, а также способствовал уменьшению количества назального секрета, отечности слизистой носа, нормализации носового дыхания[23, 27, 29, 30]. В результате проведенного нами исследования также показано значительное уменьшение длительности кашля у детей с ОРВИ на фоне терапии карбоцистеином, что подтверждает его эффективность.
По данным клинических исследований, карбоцистеин имеет высокий профиль безопасности. В систематическом Кокрейновском обзоре, который включал 34 исследования с участием 2064 детей, подтверждена безопасность карбоцистеина при использовании у детей старше 2 лет с острыми респираторными инфекциями[31].
В ходе нашего исследования зарегистрированы всего 7 эпизодов нежелательных явлений легкой степени у 7 (4,5%) пациентов на фоне приема карбоцистеина, расцененных как не связанные с приемом препарата. Это свидетельствует о благоприятном профиле безопасности препарата у детей старше 2 лет. У детей младше 2 лет широкое применение муколитиков, в том числе карбоцистеина, на фоне острых респираторных заболеваний не рекомендуется[32].
Местные защитные факторы слизистых респираторного тракта играют существенную роль в восприимчивости к инфекциям и тяжести течения респираторных заболеваний. Одним из ключевых показателей местного иммунитета слизистых является sIgA. Для оценки местного иммунитета широко используется исследование уровня sIgA в слюне. В нашем исследовании мы определяли содержание sIgA в слюне, так как это неинвазивный и технически простой метод, подходящий для детей раннего возраста[20].
Получение назальных смывов для исследования уровня sIgA в назальном секрете вызывает неприятные ощущения у детей и требует активной кооперации, что трудно осуществить, особенно с детьми младшего возраста. Кроме того, наличие ринита (например, аллергического) будет влиять на концентрацию sIgA в назальном секрете[33]. Получение мокроты затруднено у детей младшего возраста, и кроме того, образец может содержать примесь слюны.
Уровень sIgA в слюне варьирует в норме в широких пределах, что затрудняет оценку нормальных значений (табл. 2)[18, 34–37]. Это связано как с естественными межиндивидуальными различиями, так и с применением различных методов сбора образцов слюны, их обработки, хранения и анализа.
Таблица 2
Концентрация секреторного иммуноглобулина А (sIgA) в слюне у детей разного возраста, по данным разных авторов[34, 44–49]
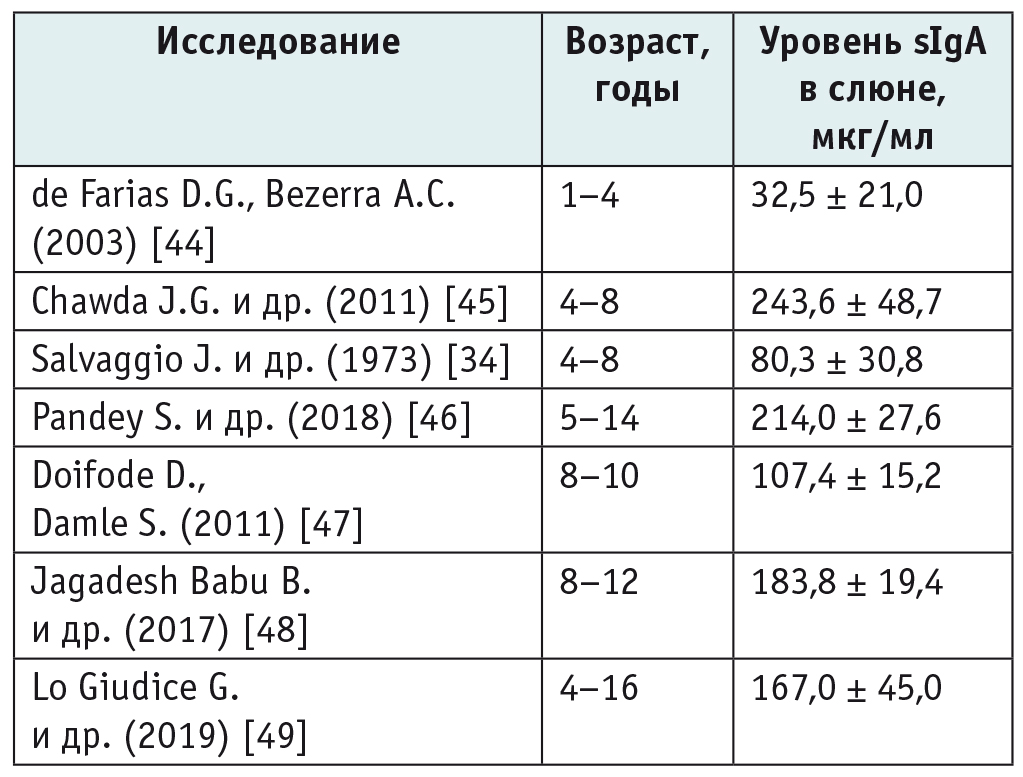
На уровень sIgA в слюне могут влиять такие факторы, как возраст (в течение первой недели жизни sIgA в слюне практически отсутствует, а у детей младше 7 лет концентрация sIgA в слюне существенно ниже, чем у детей старшего возраста и взрослых)[18, 38–42], а также скорость секреции слюны (чем она выше, тем ниже концентрация sIgA)[18, 36, 43].
Изучению местного мукозального иммунитета и его роли в патогенезе различных заболеваний уделяется сейчас пристальное внимание. В настоящее время даже обсуждается положение о том, что более важной ролью sIgA является не блокирование патогенных микроорганизмов на поверхности слизистых, а экскреция (выведение) антигенов из эпителия и подэпителиального пространства. Своевременная элиминация чужеродных антигенов из подэпителиального пространства предотвращает инфильтрацию иммунными клетками и развитие воспаления[50].
На данный момент опубликованы результаты множества исследований по оценке мукозального иммунитета в норме и при различных заболеваниях. Их результаты не всегда согласуются между собой.
Существует теория о нарушении базального уровня секреции IgA как о причине частых респираторных заболеваний. Показано снижение содержания sIgA в слюне у детей, часто болеющих респираторными заболеваниями, но не имеющих очевидных признаков иммунодефицита. Более низкие уровни sIgA у таких детей могут быть в том числе и по причине его деградации микробными протеазами[36].
Отмечена существенная обратная корреляция между уровнем sIgA в слюне в здоровом состоянии и количеством перенесенных инфекций в год у детей 6 мес — 6 лет [20]. Показано также, что повышение концентрации sIgA в слюне сопровождалось снижением частоты ОРВИ (такие данные выявлены у спортсменов в восстановительном периоде после интенсивных тренировок и соревнований)[51, 52].
В других исследованиях связь низкого базального уровня sIgA в слюне и частой заболеваемости отсутствовала. Например, в исследовании у детей 6 мес — 4 лет не найдена корреляция между уровнем sIgA в назальном секрете в здоровом состоянии и числом ОРВИ в год. Аналогично корреляции не было и для IgA в сыворотке. Однако отмечено, что дети, у которых в ответ на ОРВИ продуцировались более высокие концентрации sIgA, имели меньше эпизодов ОРВИ в год[53].
Опубликованы данные и о том, что уровень sIgA в слюне у детей, страдавших рекуррентными респираторными заболеваниями, не отличался от показателей здоровых детей, когда они не болели[35, 54]. На фоне ОРВИ у часто болеющих детей отмечалось повышение содержания sIgA до 10 раз. При этом у детей контрольной группы (без частых рекуррентных ОРВИ) на фоне ОРВИ также увеличивалось содержание sIgA, хотя и не так значительно, как у детей с частыми ОРВИ[20, 54].
На фоне острых респираторных заболеваний также отмечено увеличение концентрации sIgA и в назальном секрете, и в мокроте[55, 56]. Вероятно, уровень sIgA в гораздо большей степени зависит не от концентрации IgA в сыворотке, а от стимуляции его выработки инфекционными агентами.
Защитная функция слизистых повышается при более выраженной продукции sIgA в ответ на инфекцию. С другой стороны, есть и исследования, в которых не было существенных изменений содержания sIgA при острых или хронических респираторных заболеваниях[35, 57].
С учетом большого разброса показателей sIgA в слюне у здоровых детей, по данным литературы, и зависимости этого показателя от множества факторов представляется сложным оценить исходные уровни sIgA в слюне у пациентов, включенных в наше исследование. Поэтому более важна, на наш взгляд, оценка динамики данного показателя на фоне течения заболевания и терапии.
В литературе описана стимуляция выработки sIgA карбоцистеином. Так, например, отмечено существенное увеличение уровня sIgA в назальном секрете у детей с острыми респираторными заболеваниями на фоне приема карбоцистеина начиная с 7-го дня терапии[58]. В нашем исследовании динамика уровня sIgA в слюне на фоне ОРВИ была разнонаправленной: у 43,6% пациентов выявлен прирост показателя (причем более чем у трети этих больных он составил более 100% от исходных показателей), а у 56,4% пациентов — снижение или отсутствие динамики.
Найдена значимая корреляция между исходным уровнем sIgA и его концентрацией в динамике. Однако какой формы эта корреляция, установить в рамках проведенного статистического анализа не удалось. Возможно, например, что у пациентов с исходно низким уровнем sIgA фиксируется более выраженный прирост, а у пациентов с исходно высоким уровнем sIgA может отмечаться отсутствие прироста или снижение показателя. Требуются дальнейшие исследования, в том числе с учетом других факторов, оказывающих влияние на уровень sIgA.
ЗАКЛЮЧЕНИЕ
В ходе клинических исследований и рутинной педиатрической практики карбоцистеин зарекомендовал себя как эффективный и безопасный мукоактивный препарат, что позволяет применять его для лечения острой, рецидивирующей и хронической бронхолегочной патологии у детей. Помимо мукорегуляторного действия, карбоцистеин способен влиять и на местные защитные факторы слизистых оболочек, участвовать в регуляции процессов воспаления, что повышает его эффективность в лечении ОРВИ. Дальнейшее изучение механизмов местного мукозального иммунитета может помочь в разработке подходов к лечению и профилактике ОРВИ.
Поступила: 01.03.2023
Принята к публикации: 03.04.2023








