ВВЕДЕНИЕ
Облитерирующий бронхиолит (ОБ) — это хроническое заболевание легких, клинически проявляющееся прогрессирующей, стойкой обструкцией. По данным эпидемиологических исследований, частота встречаемости ОБ среди детского населения составляет 0,2–0,4%, однако вероятность инвалидизации и неблагоприятного прогноза позволяют отнести эту нозологическую форму к наиболее актуальным в детской пульмонологии[1, 2].
Морфологической основой хронического бронхиолита является выраженная инфильтрация эпителия бронхиол с развитием перибронхиолярного фиброза, облитерации и концентрическим сужением просвета мелких дыхательных путей[3]. Среди этиологических факторов чаще приводятся данные о значимости аденовируса, респираторно-синцитиального вируса, микоплазменной инфекции, гриппа, кори, а также их сочетаний[4–6]. Развитие воспаления нижних дыхательных путей и диссоциация между
подавлением воспаления и пролиферацией грануляционной ткани является пусковым моментом в начальном изменении эпителия бронхиол. В развитии ОБ определенную роль может играть нейтрофильное воспаление в бронхиолах с повышением концентрации цитокинов. Провоспалительные цитокины — IL-1β, IL-6, IL-8, TGF-β (transforming growth factor beta, трансформирующий фактор роста бета) — активируют миграцию фибробластов и миофибробластов, что запускает процесс образования внутрипросветной зернистой ткани, способствующей окклюзии дыхательных путей[7, 8].
ПАТОГЕНЕЗ
Среди проявлений нарушений легочной вентиляции следует отметить характерную «мозаичность» легочной ткани, обусловленную параллельно протекающими процессами гиперинфляции альвеол и гипоксической вазоконстрикции. Формирование очагов гипервоздушности обусловлено компенсаторным механизмом формирования коллатералей для обеспечения вентиляции. Следующим механизмом является перенаправленное шунтирование из гиповентилируемых участков в нормальные участки легкого, что создает картину более плотной ткани и формирует мозаичное легкое[9–11]. Гипоксическая вазоконстрикция при обширных облитерирующих процессах приводит к уплотнению здорового легкого, демонстрируя ослабление признаков «матового стекла». Таким образом, при визуальной оценке обширные поражения выглядят как более выраженная «мозаичность» легких[12, 13].
Для бронхиолита детского возраста чаще характерны констриктивные изменения с перибронхиальным фиброзом и разной степенью сужения просвета бронхиол, при этом фиброз не затрагивает альвеолы и альвеолярные ходы. В случае формирования пролиферативного варианта отмечается вовлечение в фиброз альвеолярной ткани. В этом случае с течением времени за счет неравномерного изменения просвета бронхиол развиваются бронхиолоэктазы[14]. Для цитологической картины хронического бронхиолита характерно преобладание нейтрофильного или смешанного компонентов, что усложняет подбор эффективной терапии[15].
КЛИНИЧЕСКАЯ КАРТИНА
ОБ диагностируется по клиническим критериям, описывающим такие симптомы, как тахипноэ, кашель, свистящее дыхание, непереносимость физической нагрузки и гипоксемия, сохраняющаяся не менее 6 нед после тяжелого бронхиолита или пневмонии с дыхательной недостаточностью. Диагноз часто ассоциируется с хронической обструктивной болезнью легких после тяжелого вирусного заболевания в детском возрасте[9]. В случае наличия в анамнезе тяжелой респираторной инфекции у ранее здорового пациента физикальное обследование не очень помогает в диагностике ОБ. Существуют неспецифические признаки, указывающие на бронхиолит, такие как крепитация, хрипы при аускультации грудной клетки и гиперинфляция.
ДИАГНОСТИКА
О стойких обструктивных нарушениях свидетельствуют показатели легочной вентиляции больных хроническим бронхиолитом: низкие значения объема форсированного выдоха за первую секунду (ОФВ1) и форсированной жизненной емкости легких (ФЖЕЛ), плохой ответ на применение бронходилататоров — в среднем на 5–11%[16]. С возрастом отмечается нарастание данных параметров, однако ФЖЕЛ нарастает более значительно, что приводит к сохранению низких значений соотношения ОФВ1/ФЖЕЛ и позволяет предполагать дисанаптический вариант развития легкого (несоответствие роста дыхательных путей и паренхимы легких)[17, 18]. В литературе приводятся данные о прогнозировании легочной функции при бронхиолите, которые свидетельствуют о более неблагоприятном прогнозе при низких исходных уровнях легочной вентиляции[19].
Q. Cheng и соавт. методом регрессионного анализа установили, что значимыми факторами, влияющими на формирование ОБ после перенесенной микоплазменной пневмонии, являются уровень лейкоцитоза, объем инфильтрации легочной ткани, превышающий 2/3 долей легкого, сроки и длительность приема препаратов макролидного ряда и глюкокортикостероидов[20].
На компьютерной томограмме при бронхиолите наблюдаются неоднородная непрозрачность матового стекла, задержка воздуха, утолщение бронхиальной стенки, бронхоэктазы, мозаичная перфузия и одностороннее гиперпрозрачное легкое. Синдром задержки воздуха обладает высочайшей чувствительностью и точностью в диагностике заболевания. Чувствительность синдрома задержки воздуха при компьютерной томографии составляет 91%, специфичность — 80%, точность — 86%.
Фаза выдоха дыхания важна для диагностики задержки воздуха, особенно в менее тяжелых случаях, когда можно пропустить или недооценить незначительные изменения легочной ткани по типу «матового стекла»[20, 21]. В клинической картине важно наличие стойких мелкопузырчатых хрипов, длительно сохраняющихся после перенесенной аденовирусной, микоплазменной, респираторно-синцитиальной и других респираторных инфекций[22].
ТЕРАПИЯ
Терапевтическая тактика при хроническом бронхиолите у детей неоднозначна. Основным направлением на начальном этапе является максимально возможное предотвращение облитерации бронхиол. В этом плане рассматриваются схемы использования системных глюкокортикостероидов (ГКС), пульс-терапия метилпреднизолона, рассчитанная на прием от нескольких дней до регулярных курсов в течение нескольких месяцев[19]. H. Zheng и соавт. отмечают, что непрерывные курсы ингаляционных ГКС в течение года обеспечивают более выраженный прирост вентиляционных показателей, чем прерывистый курс[23]. Высокий риск развития бактериального воспаления на фоне измененной структуры бронхиол в ряде случаев требует назначения антибактериальных препаратов[22]. Приводятся данные о следующих сочетаниях: пероральные и ингаляционные ГКС, комбинация флутиказона, азитромицина и монтелукаста, сочетание будесонида, азитромицина, монтелукаста и ацетилцистеина, комбинация системных кортикостероидов и бронходилататоров (в большинстве случаев отмечается недостаточный эффект бронхолитической терапии)[16, 23–25].
Интенсивная и стойкая воспалительная реакция является ключом к возникновению и развитию ОБ, поэтому терапевтические вмешательства для предотвращения прогрессирования заболевания заключаются в постоянном подавлении воспалительных реакций на протяжении заболевания, чтобы предотвратить стойкое снижение функции легких и уменьшить тяжесть заболевания[23].
В последние годы рассматриваются следующие основные схемы лечения ОБ (табл. 1)[26–29]:
-
BAMA (Budesonide — будесонид, Azithromycin — азитромицин, Montelukast — монтелукаст, Acetylcysteine — ацетилцистеин);
-
FAM (Fluticasone — флутиказон, Azithromycin — азитромицин, Montelukast — монтелукаст), этот вариант приводится для лечения бронхиолита после трансплантации стволовых клеток).
Таблица 1
Основные терапевтические эффекты схем BAMA и FAM
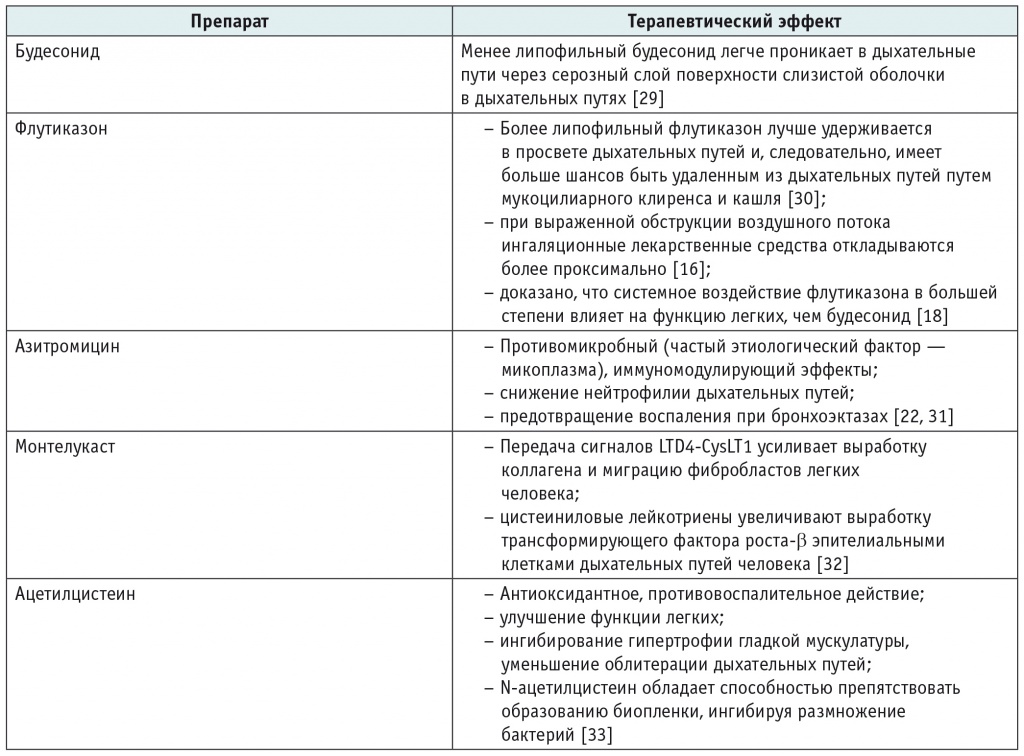
Исследование, посвященное изучению эффективности применения схемы ВАМА у детей с ОБ, имеет ряд особенностей[26]. В данной статье приводятся результаты комбинированного режима терапии, включающего, наряду с ВАМА, использование кортикостероидов парентерально и перорально. В это исследование были включены 75 пациентов с ОБ (медиана возраста 1,27 года)[26]. Учитывались следующие диагностические критерии: история острой и тяжелой инфекции нижних дыхательных путей у ранее здорового ребенка; повторяющийся или постоянный кашель, свистящее дыхание или одышка в течение 6 нед после острой инфекции со сниженной толерантностью к физической нагрузке и отсутствием реакции на бронходилататоры; признаки мозаичной перфузии, утолщение бронхиальной стенки, бронхоэктазы или ателектазы на компьютерной томограмме грудной клетки; обструктивная вентиляционная дисфункция при оценке функции легких; отсутствие других обструктивных заболеваний легких, таких как астма, туберкулез легких, бронхолегочная дисплазия, муковисцидоз, иммунодефицит и дефицит α-1-антитрипсина.
В ходе исследования отмечено улучшение клинических и инструментальных показателей, по результатам компьютерной томографии у 82,8% пациентов сократилась мозаичность легких, отмечено уменьшение воспаления стенки бронхов у пациентов с бронхоэктазами (табл. 2). В результате использования схемы ВАМА наблюдалось сокращение числа состояний, требующих приема оральных кортикостероидов. При использовании схемы ВАМА 54% пациентов получали системные кортикостероиды менее 2 нед, у трети детей после применения препаратов ВАМА больше не возникала необходимость приема метилпреднизолона.
Таблица 2
Сравнительная характеристика схем лечения
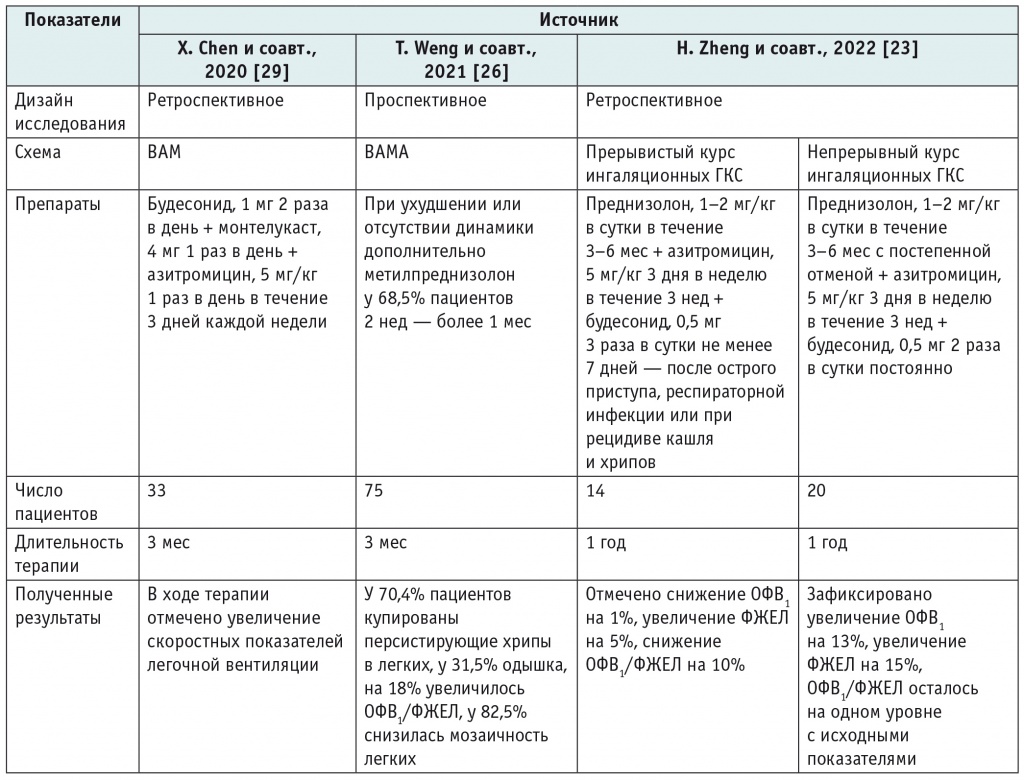
Таким образом, данные представленных исследований свидетельствуют о более существенном положительном влиянии непрерывного курса системных кортикостероидов на показатели легочной функции, а следовательно, и прогноз при ОБ. Исследователи, применявшие схемы ВАМ и ВАМА, использовали их не изолированно, а в сочетании с оральной кортикотерапией в течение от 3 мес до 1 года, выборки пациентов были небольшими, что не позволяет объективно оценить эффективность данных схем в долгосрочном прогнозе.
ЗАКЛЮЧЕНИЕ
ОБ — тяжелое хроническое заболевание легких, требующее оптимального лечения. Лучшее понимание и знание темы поможет специалистам в разработке эффективных стратегических мер по снижению заболеваемости, раннему вмешательству и улучшению прогноза ОБ у детей. Представленные результаты позволяют по-новому взглянуть на проблему ОБ у детей и рассмотреть вопрос дальнейших исследований тактики ведения пациентов с позиции влияния альтернативных препаратов на патофизиологические процессы данного заболевания.
Поступила: 02.02.2023
Принята к публикации: 04.03.2023








