Подбор адекватных доз инсулина у детей с СД 1 типа (СД1) является серьезным вызовом не только для самого пациента и его близких, но и для лечащего врача. Усложняют расчет, анализ и титрацию доз множество факторов, таких как гетерогенность образа жизни и непредсказуемость пищевого и эмоционального поведения, которые как по отдельности, так и в совокупности оказывают влияние на интра- и междневные колебания показателей гликемии.
Использование аналогов инсулина длительного действия (гларгин и детемир), в отличие от инсулина нейтрального протамина Хагедорна, позволяет достичь лучших показателей гликемического контроля при значимо более низком риске развития гипогликемий [1]. Современный аналог инсулина сверхдлительного действия деглудек (ИДег), согласно данным исследования BEGIN YOUNG, способен улучшить показатели углеводного обмена путем влияния на вариабельность гликемии (ВГ) у детей с СД1 [2]. Длительность действия ИДег при его подкожном введении достигается за счет формирования депо инсулина в стабильных мультигексамерах, которые медленно диссоциируют с высвобождением мономеров. Такая медленная диссоциация и пролонгированное поступление препарата в кровоток обеспечивают длительный «плоский» профиль, низкую вариабельность действия и, соответственно, стабильный гипогликемический эффект [1].
Описанные фармакокинетические свойства ИДег при исследовании в детской популяции сопоставимы с таковыми у взрослых пациентов [2].
Согласно Международному консенсусу по использованию систем непрерывного мониторирования гликемии (НМГ), опубликованному в 2017 году, в качестве критерия ВГ рекомендуется применять коэффициент вариации (CV) [3]. Повышение CV более 36% свидетельствует о высокой интра- и междневной ВГ и плохом гликемическом контроле [3].
Внедрение в широкую практику систем НМГ привело к пониманию того, что адекватная оценка гликемического контроля не может проводиться исключительно по уровню гликированного гемоглобина (HbA1c) и должна включать определение таких дополнительных показателей, как время нахождения параметров в целевом диапазоне (Time In Range, TIR), в диапазоне выше целевого (Time Above Range, TAR), в диапазоне ниже целевого (Time Below Range, TBR) [5].
Результаты, представленные в данной статье, иллюстрируют, что ИДег может являться хорошим вариантом базальной терапии для детей и подростков с СД1 с высокой ВГ, обеспечивающим должные показатели гликемического контроля.
Цель исследования: сравнить ВГ, уровень HbA1c, TIR, TAR и TBR у детей с СД1 с разной исходной ВГ после смены базального инсулина детемир (Идет) на ИДег.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводили на базе Городского детского эндокринологического центра Санкт-Петербурга в период с сентября 2019 по февраль 2021 года. Обследовали 30 детей с СД1 в возрасте от 5 до 17 лет (средний возраст — 10,2 ± 4,0 года), 14 мальчиков (46,7%, средний возраст — 11,2 ± 4,3 года) и 16 девочек (53,3%, средний возраст — 9,3 ± 3,7 года). Длительность заболевания — не менее 1 года.
Критерии исключения — нарушения функции печени, почек, надпочечниковая недостаточность, целиакия, нарушение функции щитовидной железы, наличие анемии, эпизода диабетического кетоацидоза или тяжелой гипогликемии в течение последнего года.
По результатам флеш-мониторирования гликемии (ФМГ) во вводном периоде пациенты были разделены на две группы в зависимости от величины CV: с низкой ВГ (CV ≤ 36%) — группа 1 и с высокой ВГ (CV > 36%) — группа 2. В группе 1 было 7 (43,7%) мальчиков и 9 (56,3%) девочек, в группе 2 — 7 (50,0%) и 7 (50,0%) соответственно. CV гликемии значимо различался и составил 33,5 ± 2,4% в группе 1 и 43,2 ± 5,4% в группе 2 (p < 0,001).
До и во время вводного периода (2 недели) пациенты получали инсулинотерапию базальным инсулином ИДет, после чего их переводили на ИДег в качестве базального инсулина и наблюдали еще 24 недели. До и после перевода проводили мониторинг системой ФМГ.
Параметры TIR, TAR, TBR, а также CV рассчитывались автоматически и оценивались, согласно Международному консенсусу по использованию систем суточного мониторирования гликемии и времени нахождения параментров в целевом диапазоне [6], по отчетам стандартного амбулаторного профиля глюкозы (АПГ) [7]. Отчеты АПГ были получены на онлайн-платформе LibreView. Расхождений между данными, полученными на онлайн-платформе и с помощью программного обеспечения производителя ФМГ, не было.
Смена препаратов инсулина проводилась амбулаторно. Дозы ИДег титровали, согласно рекомендациям исследования эффективности и безопасности использования инсулина ИДег у детей BEGIN YOUNG [2].
Статистический анализ результатов исследования осуществлен с помощью пакета программ SSPS, Microsoft Office Excel и Statistica 6.0. Распределение количественных показателей на нормальность оценивалась по критерию Колмогорова — Смирнова. Описательный анализ для выборок с нормальным распределением включал в себя размер выборок, их среднее значение (М), стандартное отклонение (SD). Оценка различий между выборками проводилась с использованием критерия Стьюдента. За пороговый уровень значимости принято значение р < 0,05.
РЕЗУЛЬТАТЫ
Группы были сопоставимы по полу и возрасту. Гендерные различия во всех исходных исследуемых показателях не отмечались.
Исходные параметры групп исследования представлены в таблице 1.
Таблица 1
Клинико-лабораторная характеристика пациентов, M ± SD
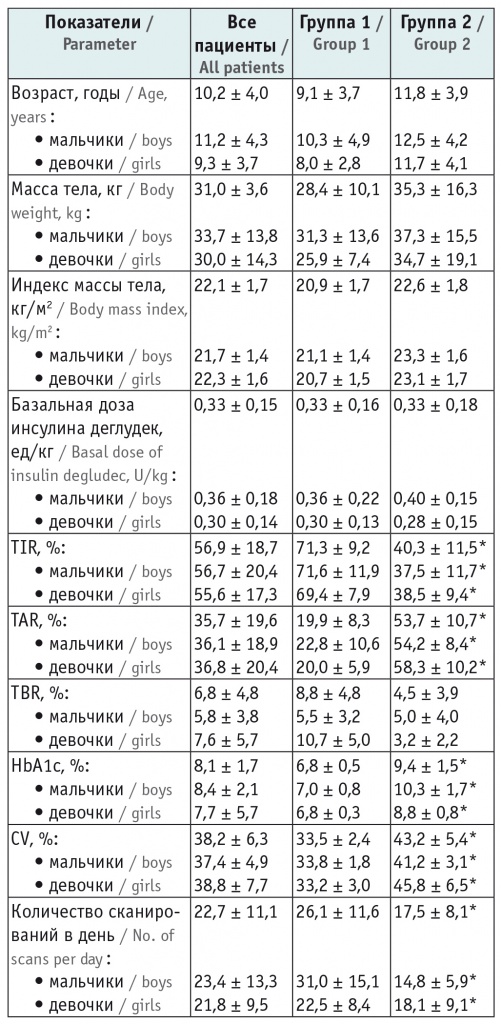
Примечания.
1. Отличия от группы 1 статистически значимы: (*) — p < 0,001.
2. Здесь и в таблице 2: CV — коэффициент вариации, HbA1c — гликированный гемоглобин, TAR — время нахождения параметров в диапазоне выше целевого, TBR — время нахождения параметров в диапазоне ниже целевого, TIR — время нахождения параметров в целевом диапазоне.
Пациенты группы 2 по сравнению с пациентами группы 1 имели значимо более низкое TIR (40,3 ± 11,5% против 71,3 ± 9,2%; p < 0,001), высокое TAR (53,7 ± 10,7% против 19,9 ± 8,3%; p < 0,001), высокий уровень HbA1c (9,4 ± 1,5% против 6,8 ± 0,5%; p < 0,001). Более благоприятные показатели гликемического контроля у пациентов группы 1 ассоциировались с большей частотой ежедневных сканирований, чем у пациентов группы 2 (26,1 ± 11,6 в день против 17,5 ± 8,1). Все выявленные различия в исследуемых группах сохранялись при условии стратификации по полу.
Статистически значимые различия в дозе базального инсулина, а также TBR между исследуемыми группами выявлены не были.
Результаты сравнения показателей гликемического контроля до и после перевода на ИДег у пациентов обеих групп представлены в таблице 2.
Таблица 2
Показатели гликемического контроля до и после перевода с инсулина детемир (ИДет) на деглудек (ИДег) у пациентов обеих групп, M ± SD
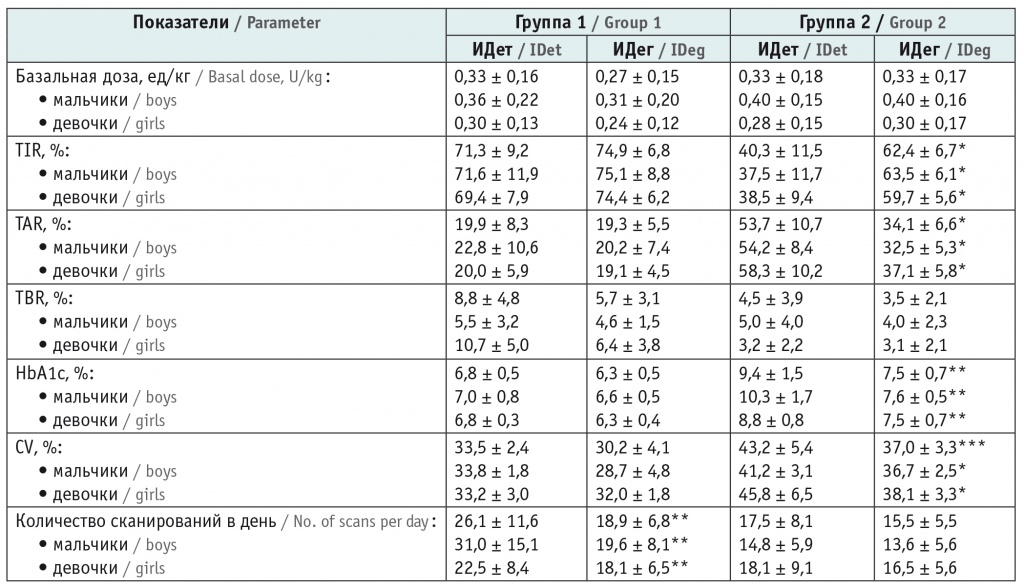
* Различия между показателями на фоне применения инсулина детемир и деглудек статистически значимы: (*) — p < 0,001; (**) — p < 0,05; (***) — p = 0,05.
Через 6 месяцев после перевода пациентов с ИДет на ИДег в обеих группах статистически значимая разница в величине базальной дозы инсулина отсутствовала.
В группе 1 показатели TIR, TAR, TBR, HbA1c, CV были удовлетворительными и не отличались от таковых до смены базального инсулина (p > 0,05). Статистически значимое снижение частоты ежедневных сканирований ФМ не сопровождалось ухудшением компенсации СД.
В группе 2 после перевода на ИДег отмечалось статистически значимое увеличение TIR (с 40,3 ± 11,5% до 62,4 ± 6,7%; р < 0,001), уменьшение TAR (с 53,7 ± 10,7% до 34,1 ± 6,6%; р < 0,001), CV (с 43,2 ± 5,4% до 37,0 ± 3,3%; р = 0,05), а также уровня HbA1c (с 9,4 ± 1,5% до 7,5 ± 0,7%; р < 0,05) на фоне неизменных TBR и частоты ежедневных сканирований.
ОБСУЖДЕНИЕ
В настоящее время существует достаточно большое количество публикаций, подтверждающих важность увеличения времени нахождения в целевом диапазоне уровня глюкозы и снижения ВГ для пациентов с СД1 [6, 8]. Доказано, что увеличение TIR сопровождается статистически значимым уменьшением уровня HbA1c и коррелирует с частотой развития специфических осложнений СД, таких как ретинопатия и микроальбуминурия [9-11].
Использование инновационных препаратов инсулина, таких как ИДег, с особыми характеристиками, обеспечивающими формирование депо препарата, последующую медленную диссоциацию и пролонгированное поступление в кровоток, по мнению ряда исследователей, позволяет добиться лучших показателей гликемического контроля даже в такой сложной группе пациентов, как дети с СД1, за счет создания длительного «плоского» профиля инсулинемии и низкой ВГ [2].
К преимуществам ИДег, продемонстрированным в нашем исследовании, можно отнести стабильность и длительность гликемического действия, что проявлялось в улучшении показателей гликемического контроля в группе с исходно высокой ВГ. Это подтверждается схожими результатами, полученными в исследовании у взрослых пациентов [12].
В свое время исследование DCCT (Diabetes Control and Complications Trial) показало, что снижение уровня HbA1c значительно уменьшает риск прогрессирования ретинопатии, но в то же время в разы повышает риск развития гипогликемии, в том числе тяжелой [13, 14]. Важно отметить, что в нашем исследовании снижение уровня HbA1c не сопровождалось риском увеличения длительности и частоты гипогликемических эпизодов, что, вероятно, обусловлено стабильными фармакокинетическими свойствами инсулина ИДег, нашедшими свое отражение в уменьшении CV.
Известно, что необходимость многократных проколов пальца для получения данных о текущем уровне глюкозы является значимым барьером на пути достижения успешной компенсации СД1. Системы НМГ и ФМ, позволяющие получать данные не только о текущем, но и о ретроспективном уровне гликемии, избавляют от частых болезненных процедур, что делает их использование в педиатрической практике более обоснованным. Анализ влияния частоты сканирований при использовании ФМГ на показатели гликемического контроля показывает, что увеличение числа ежедневных сканирований сопровождается значимым снижением уровня HbA1c, увеличением TIR и уменьшением частоты и длительности гипогликемических эпизодов [15-17].
Не вызывает сомнения, что применение систем мониторирования гликемии приводит к значительному снижению тревожности, страха гипогликемий, улучшению качества жизни путем уменьшения ВГ у подавляющего числа пациентов с СД [18, 19]. В то же время финансовые барьеры часто становятся препятствием на пути широкого использования этих эффективных инструментов гликемического контроля. Применение современных аналогов инсулина, способных привести к снижению ВГ, может помочь в достижении установленных терапевтических целей [20].
Важным результатом перевода на ИДег, полученным в нашем исследовании, можно также считать значимое уменьшение частоты ежедневных сканирований у пациентов с исходно низкой ВГ, не сопровождавшееся ухудшением компенсации СД. Данный феномен может быть объяснен снижением чувства тревоги относительно колебаний уровня в глюкозы крови после перехода на ИДег.
ЗАКЛЮЧЕНИЕ
У детей с СД 1 типа, получавших ранее в качестве базального инсулина детемир и имевших высокую вариабельность гликемии, перевод на деглудек позволяет достичь значимого улучшения показателей метаболического контроля (увеличения времени нахождения параметров в целевом диапазоне, уменьшения времени нахождения параметров в диапазоне выше целевого, коэффициента вариабельности и уровня гликированного гемоглобина) без риска гипогликемий и необходимости более частых ежедневных сканирований.
Поступила: 01.03.2021
Принята к публикации: 19.03.2021







