Нейробластома (НБ) — злокачественная опухоль симпатической нервной системы, происходящая из клеток нервного гребня. Это эмбриональная опухоль c крайне разнообразным биологическим поведением, что клинически проявляется широким диапазоном течения заболевания: от спонтанной регрессии опухоли до фульминантной опухолевой прогрессии и смерти. Показатель заболеваемости составляет 0,85–1,1 случая на 100 000 населения в возрасте до 15 лет. На НБ приходятся 7–10% всех злокачественных новообразований у детей, она является самой частой опухолью на первом году жизни, заболеваемость в этом возрасте составляет 6,1 на 100 000 детей соответствующего возраста[5]. Так как НБ встречается в основном у детей раннего возраста, многими авторами было высказано предположение о роли родительских, пренатальных и постнатальных факторов в развитии данного заболевания.
Эпидемиологические исследования, направленные на выявление этиологических аспектов, проводят уже более 20 лет, однако факторы риска (ФР) развития НБ достоверно не определены. В современных исследованиях особое внимание уделяют изучению таких ФР, как гестационный возраст, масса тела ребенка при рождении, наличие врожденных пороков развития (ВПР). Оценивают влияние родительских (возраст родителей, принимаемые ими лекарственные средства) и экзогенных факторов (окружающая среда, профессиональные вредности). В таблице 1 представлены основные исследования, посвященные изучению влияния различных факторов на риск развития НБ у детей первого года жизни и у детей в возрасте старше одного года.
Таблица 1
Влияние разных факторов на риск развития нейробластомы (НБ)
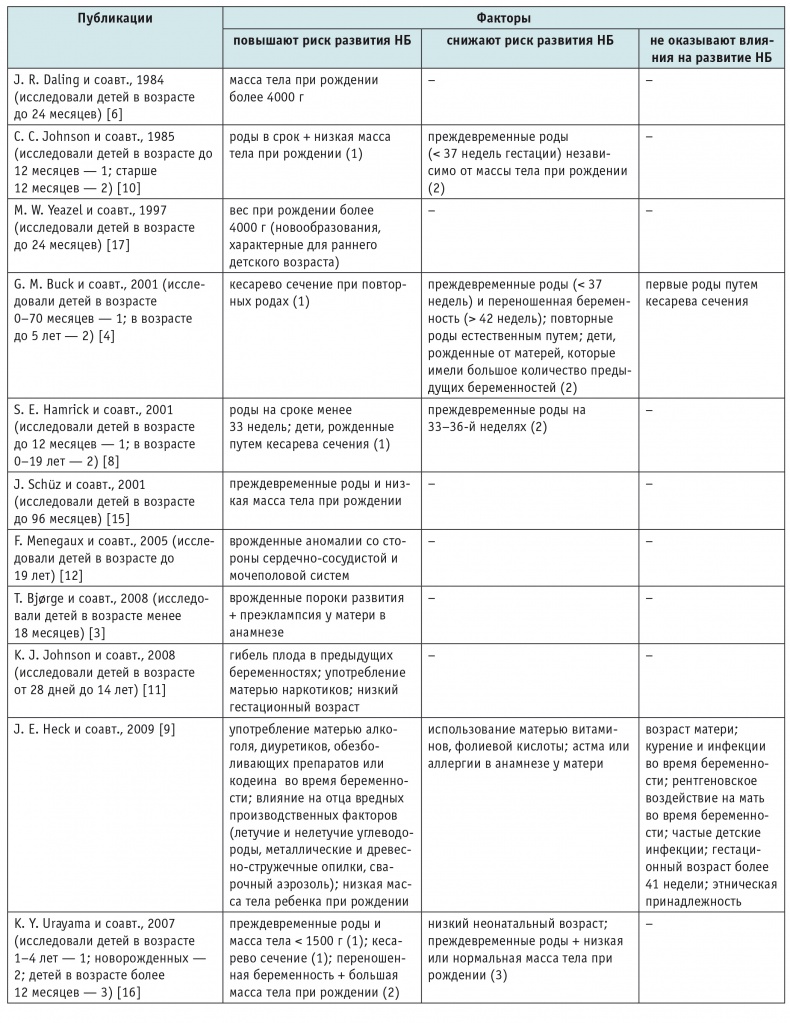
В обобщающей работе J. E. Heck и соавт. были выделены такие ФР развития НБ, как употребление матерью алкоголя, применение диуретиков, кодеина и обезболивающих препаратов во время беременности, низкая масса тела ребенка при рождении, техногенные факторы[9].
Целью исследования явилось изучение влияния пре- и постнатальных, а также родительских факторов, включая акушерский анамнез, на развитие НБ у детей первого года жизни. Кроме того, проведен всесторонний анализ данных литературы, посвященных указанному вопросу.
МАТЕРИАЛЫ И МЕТОДЫ
За период с января 2012 по февраль 2014 г. (26 месяцев) в Федеральном научно-клиническом центре детской гематологии, онкологии и иммунологии имени Дмитрия Рогачёва (далее — ФНКЦ ДГОИ им. Дмитрия Рогачёва) было зарегистрировано 189 пациентов с НБ, из них 80 (42,3%) на момент установления диагноза находились в возрасте от 0 до 11 месяцев и 29 дней. Для проведения исследования была создана база данных, в которую пациентов включали проспективно. Регистрацию проводили в течение трех суток с момента установления диагноза. Для дополнительного сбора информации была разработана анкета, позволявшая оценивать ФР в соответствии с данными медицинской литературы.
Первичное обследование пациентов включало УЗИ органов брюшной полости и периферических лимфатических узлов; КТ, МРТ органов грудной, брюшной полости/малого таза; морфологическое исследование костного мозга (костно-мозговые пункции из четырех точек); сцинтиграфию с метайодбензилгуанидином, сцинтиграфию с технецием (при подозрении на костные метастазы). Проводили биопсию/резекцию/удаление первичной опухоли и/или метастатических очагов с последующим гистологическим, иммуногистохимическим исследованиями и молекулярно-генетическим анализом (определение статуса гена MYCN, делеций 1р и 11q методом флуоресцентной гибридизации in situ).
Диагноз устанавливали на основании гистологического или лабораторно-инструментального обследования с последующим гистологическим подтверждением. Стадирование осуществляли согласно критериям международной системы стадирования НБ (International Neuroblastoma Staging System).
При анализе все данные, полученные в ходе анкетирования родителей и изучения медицинской документации, были разделены на три группы:
- 1-я группа — родительские факторы: хронические заболевания, вредные привычки, профессиональные вредности матери и отца; акушерский анамнез;
- 2-я группа — характер течения беременности и масса тела ребенка при рождении;
- 3-я группа — наличие ВПР, генетических синдромов и/или малых аномалий развития у ребенка.
Для объективизации изучения и сравнительного анализа массы тела у детей использовали критерии МКБ-10[2]:
- низкая масса тела (НМТ) — вес 1500–2499 г;
- очень низкая масса тела — вес 1000–1499 г;
- экстремально низкая масса тела — вес менее 1000 г;
- крупный плод — масса тела от 4000 до 5000 г;
- гигантский плод — масса тела свыше 5000 г.
Классификатор МКБ-10 использовали также для определения срока гестации на момент родов. В соответствии с ним, ребенок считается недоношенным при родах на сроке менее 37 полных недель (менее 259 дней); доношенным, если роды произошли на сроке от 37 до 42 полных недель (259–293 дней). Переношенным считается ребенок, родившийся при сроке беременности 42 полных недели и более (294 дня и более)[2].
Для комплексной оценки физического развития новорожденного с учетом гестационного возраста нами были использованы сигмальные и перцентильные таблицы Г. М. Дементьевой, построенные с учетом частоты распределения показателя[1]. Наличие ВПР регистрировали по результатам инструментальной диагностики. ЭКГ и Эхо-КГ были проведены 48 (60%) из 80 пациентов с установлением диагноза в возрасте от 0 до 11 месяцев и 29 дней с целью выявления врожденных пороков сердца (ВПС) или малых аномалий развития сердца (МАРС). Наличие или отсутствие пороков развития мочеполовой системы определяли путем визуализационных (УЗИ) и, при необходимости, рентгеноконтрастных исследований. С целью изучения пороков развития ЦНС пациентам проводили МРТ головного мозга с дополнительным контрастным усилением.
РЕЗУЛЬТАТЫ
В исследуемой группе диагноз в 62 (77,5%) случаях устанавливали на основании гистологического исследования первичной опухоли, у 4 (5%) пациентов была выявлена метастаза опухоли; 14 (17,5%) больным диагноз устанавливали, исходя из клинико-рентгенологических данных.
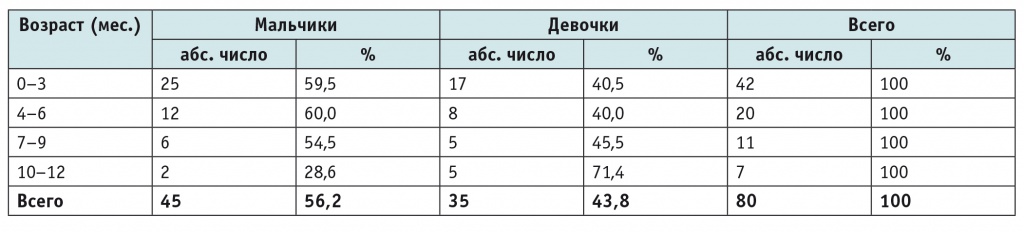
Среди детей отмечено преобладание лиц мужского пола: соотношение мальчиков и девочек составило 1,3 : 1. Наибольшее число случаев — 42 (52,5%) — было зарегистрировано в возрастной группе от 0 до 3 месяцев. Распределение пациентов на группы в зависимости от пола и возраста представлено в таблице 2.
Таблица 2
Распределение пациентов с нейробластомой в зависимости от пола и возраста
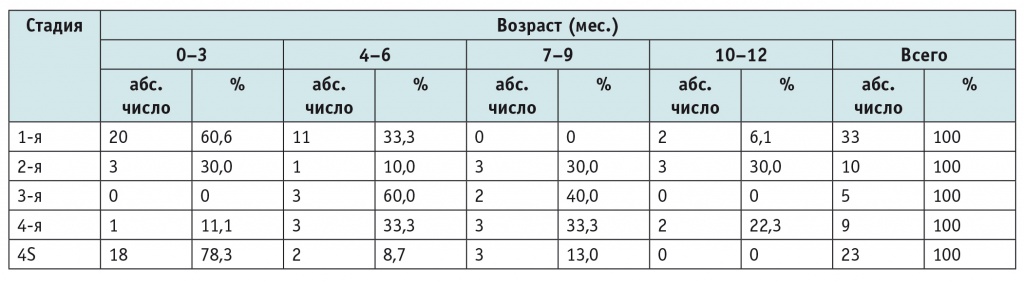
Из 80 человек, включенных в исследование, 1-я стадия заболевания диагностирована у 33 (41,2%) пациентов, 2-я — у 10 (12,5%), 3-я — у 6 (7,5%), 4-я — у 8 (10%), 4S-стадия — у 23 (28,8%) пациентов. Распределение больных по стадиям заболевания в зависимости от возраста представлено в таблице 3. Обращает на себя внимание тот факт, что стадии 1 и 4S наиболее часто встречаются в возрасте от 0 до 3 месяцев — в 20 (60,6%) и 18 (78,3%) случаях соответственно.
Таблица 3
Распределение пациентов с нейробластомой по стадиям в зависимости от возраста
Первичная опухоль была локализована в области надпочечников в 42 (52,5%) случаях, в забрюшинном пространстве в 15 (18,8%), в заднем средостении в 13 (16,2%), в малом тазу в 2 (2,5%) и в области шеи в 1 (1,2%) случае. Билатеральное поражение надпочечников встречалось у 7 (8,8%) пациентов (в возрасте 0–3 месяцев — у 6 из 7, в возрасте 7–9 месяцев — у 1 из 7 больных).
При изучении данных, полученных в ходе анкетирования родителей, в соответствии с выделенными группами проанализированы характеристики родителей, указанные выше (1-я группа данных). Ни в одном случае не было выявлено указаний на наличие профессиональных вредностей. Проведен анализ количества живорожденных детей в этих семьях. От первой беременности были рождены 39 (48,8%) детей, от второй и последующих беременностей — 41 (51,2%).
В анализ осложнений течения беременности (2-я группа данных) были включены 77 случаев беременности и 126 эпизодов осложнений беременности. По данным литературы, фактором, влияющим на возникновение НБ у ребенка, является тяжелое течение беременности с развитием преэклампсии[3]. В нашей когорте пациентов подобных осложнений не встречалось.
Среди 80 пациентов недоношенными родились 3 (3,8%) ребенка, доношенными — 71 (88,7%) ребенок и 6 (7,5%) детей родились переношенными.
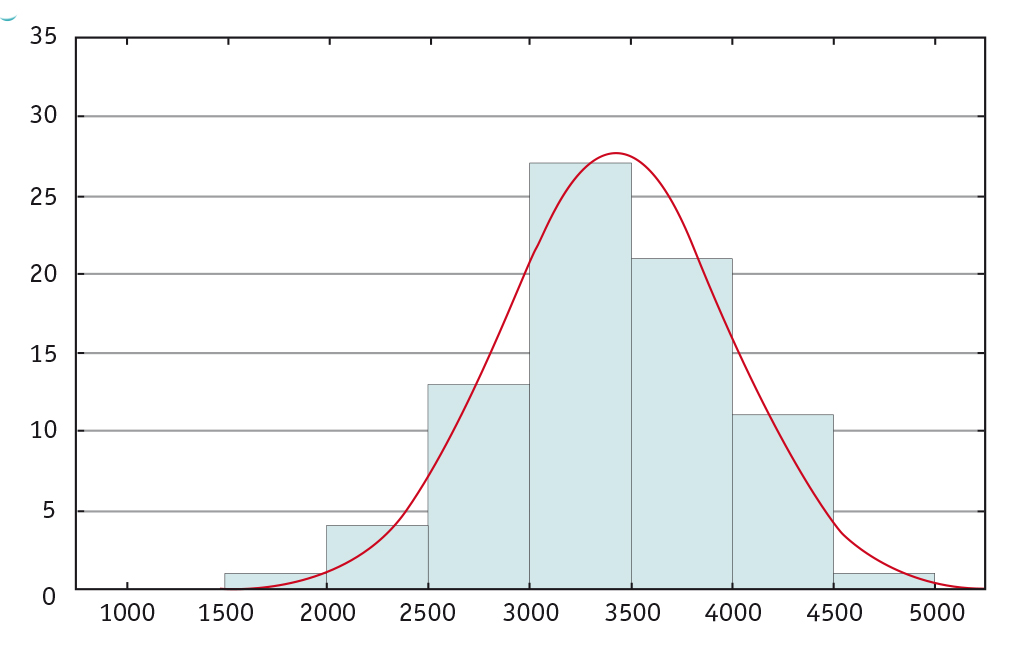
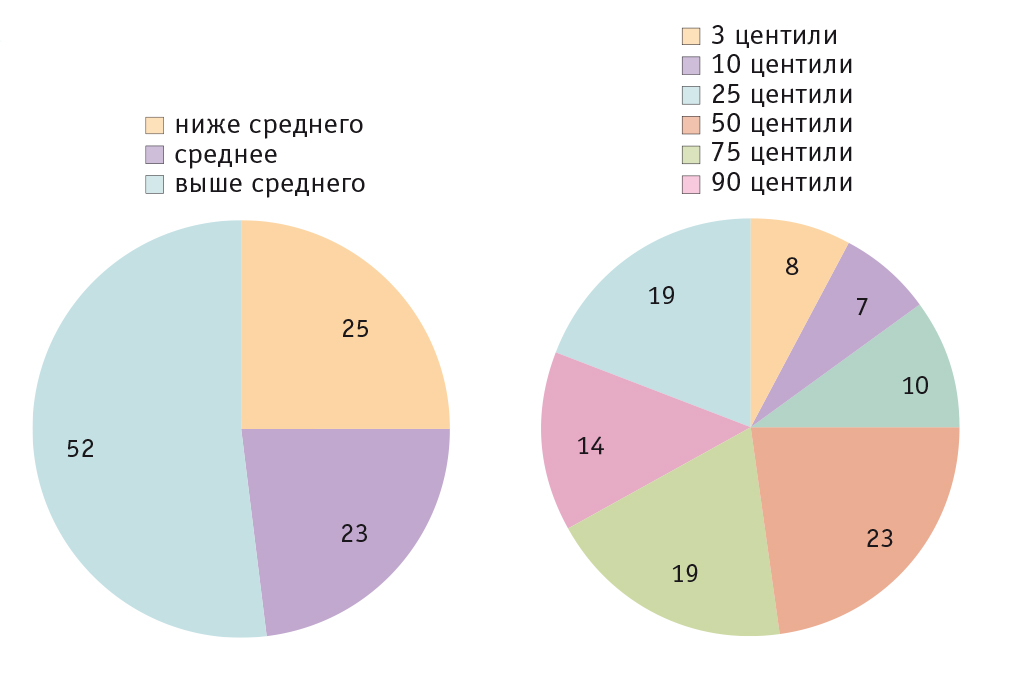
Анализ массы тела ребенка на момент рождения показал, что в 4 (5,0%) случаях пациенты имели НМТ. Нормальная масса тела при рождении зарегистрирована у 62 (77,5%) детей. В 14 (17,5%) случаях масса тела новорожденного превышала 4 кг. В исследовании не было зарегистрировано ни одного больного с очень низкой массой тела или гигантского плода (рис. 1).
Рис. 1. Распределение пациентов с нейробластомой по массе тела на момент рождения, n
При изучении массы тела новорожденных дополнительно был проведен анализ данных пациентов в соответствии с параметрами таблиц сигмального и перцентильного типа для комплексной оценки их физического развития с учетом гестационного возраста. Указанный способ стратификации признака позволяет не только выделить группу детей с массой тела при рождении более 4 кг, но и, согласно статистическим данным, определить количество пациентов с антропометрическими показателями, отличающимися на два стандартных отклонения и более от средних значений признака. Как показано на рисунке 2, у 52% пациентов значения массы тела при рождении выходили за пределы интерквартильного размаха, т. е. интервала между 25-м и 75-м перцентилями.
Рис. 2. Распределение пациентов с нейробластомой в зависимости от перцентильных значений индекса массы тела, %
В нашем исследовании были учтены ВПС, включая МАРС (3-я группа данных). Из 48 пациентов, которым были выполнены ЭКГ и Эхо-КГ в условиях ФНКЦ ДГОИ им. Дмитрия Рогачёва, ВПС выявлены у 23 (47,9%). Из них у 18 (78,3%) больных диагностировали МАРС (открытое овальное окно), у 5 (21,7%) — ВПС: у 2 из 5 детей установлен дефект межпредсердной перегородки, у 2 из 5 — дефект межжелудочковой перегородки, у 1 из 5 — комбинированный порок сердца (открытый артериальный проток и открытое овальное окно с постоянным лево-правым сбросом). У 2 (2,5%) из 80 пациентов выявлены пороки развития мочеполовой системы: в одном случае — удвоение левой почки, в другом — удвоение коллатеральной системы левой почки (полное удвоение левой почки).
Стандартное цитогенетическое исследование В-лимфоцитов периферической крови проводили у 50 (62,5%) пациентов, из которых у одного ребенка (2%) был выявлен кариотип 45Х0.
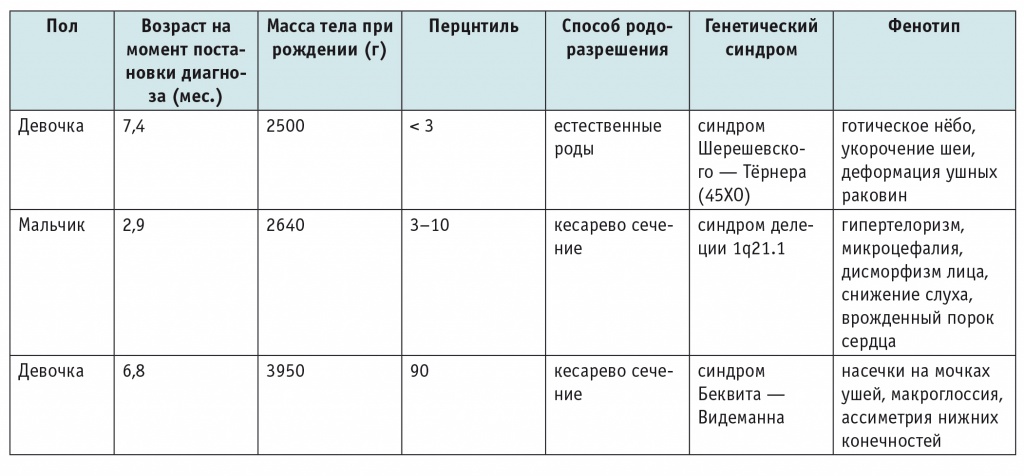
В 3 (3,8%) случаях, при подозрении на синдромальную форму патологии, выполняли микроматричный хромосомный анализ лимфоцитов периферической крови. В рамках указанного исследования у одного пациента выявлен синдром делеции 1q21.1. У другого пациента на основании клинической картины и данных молекулярно-генетического исследования с оценкой метилирования KvLQT (LIT1) установлен синдром Беквита — Видеманна. В таблице 4 представлены пациенты с НБ, у которых были выявлены генетические синдромы.
Таблица 4
Характеристика пациентов с нейробластомой и генетическими синдромами, n = 3
ОБСУЖДЕНИЕ
В нашем исследовании проанализировано влияние ряда факторов на развитие НБ у детей первого года жизни. Снижение заболеваемости НБ с возрастом позволяет предполагать, что риск ее развития у детей младенческого и раннего возраста может быть связан со способом зачатия, внутриутробными факторами и/или ранними постнатальными рисками, и подчеркивает характер воздействия некоторых веществ. N. L. Carlsen и соавт. в 1996 г. провели исследование, основанное на гипотезе, что ФР развития НБ, связанные с повышенным риском отцовских герминальных мутаций, более распространены у детей первого года жизни, в то время как у детей более старшего возраста НБ чаще всего ассоциирована с ФР, связанными с беременностью или возникающими во время гестации (инициирующими соматические мутации). По данным K. Y. Urayama и соавт., отдельные ФР у младенцев и детей более старшего возраста различны, в первую очередь, это гестационный возраст, вес при рождении, способ родоразрешения, количество беременностей у матери в анамнезе[16].
В исследовании канцер-регистра в Миннесоте изучали истории болезни пациентов, у матерей которых в анамнезе были зарегистрированы гибель плода, использование наркотиков и низкий гестационный возраст ребенка при рождении. Была продемонстрирована ассоциация данных факторов с развитием НБ[11]. В работе норвежских ученых показано, что у детей до 18 месяцев жизни, имеющих ВПР и рожденных от матерей с преэклампсией во время беременности, существует повышенный риск развития НБ пограничной значимости[3].
Children's Cancer Group (CCG) и другие исследователи анализировали связь гестационного возраста и веса при рождении с риском развития НБ, однако эти результаты были противоречивыми[4, 8, 10, 15, 17]. K. Y. Urayama и соавт. распределяли пациентов с НБ по группам на основе комбинации двух сильно коррелирующих величин — гестационного возраста и веса при рождении, — и обнаружили, что высокий риск возникновения НБ связан с большим весом ребенка при рождении[16]. Было выявлено, что большой вес при рождении связан с заметно повышенным риском развития НБ только среди новорожденных, а преждевременные роды, низкий или нормальный вес при рождении ассоциированы с низким риском развития НБ среди детей более старшего возраста[16]. Эти данные согласуются с ранее полученными результатами других исследований, которые продемонстрировали низкий риск развития НБ, связанный с преждевременными родами (менее 37 недель гестации), независимо от массы тела при рождении[10]. Те же авторы наблюдали тенденцию к повышению риска развития НБ у детей с низкой массой тела, рожденных в срок. Авторы исследования выдвинули гипотезу о внутриутробном стимуляторе (канцерогенном инициаторе или промоутере), который появляется в последнем месяце беременности, в период возможного роста чувствительности нервной системы плода к трансплацентарному воздействию, и предположили, что вес может играть роль в восприимчивости к этим факторам[10].
Исследователи CCG показали незначительную связь между риском развития НБ и преждевременным рождением ребенка на 33–36-й неделях гестации и высокий риск, связанный с родами на гестационном сроке менее 33 недель[8]. K. Y. Urayama и соавт., наоборот, указывали на повышенный риск развития НБ у детей в возрасте от 1 года до 4 лет, родившихся раньше срока[16]. Вес при рождении не был статически значимым ФР, однако приведены некоторые доказательства связи повышенного риска развития НБ с экстремально низким весом при рождении (менее 1000 г).
Немецкие исследователи сообщили о статистически значимом увеличении риска развития НБ при родах на малом сроке беременности и низкой массе тела ребенка при рождении[15]. Для лучшего понимания и представления данных все результаты цитируемых исследований включены в таблицу 1.
В нашем исследовании показано, что роды на 42-й неделе и большем сроке гестации происходили в 6 из 77 (7,8%) случаев. На 37-й неделе и ранее родоразрешение произошло в 3 (3,8%) случаях. У пациентов с НБ мы предприняли попытку провести связь между массой тела при рождении и сроком гестации, в результате чего выявили, что 15% детей, рожденных в срок, имели массу тела при рождении 4000 г и более.
При изучении данных о распределении родившихся в РФ детей по массе тела (% к общему числу родившихся живыми с массой тела 1000 г и более) показано, что дети с массой тела 4000 г и выше рождаются в среднем в 9,3% случаев (min — 7,7% в 1999 г., max — 10,2% в 2008 г.). Таким образом, сравнение с общепопуляционными данными по рождаемости в РФ продемонстрировало некоторое увеличение числа пациентов, рожденных с массой тела 4000 г и более[2].
Гипотеза о внутриутробном стимуляторе онкогенеза в течение последнего месяца беременности предполагает, что переношенные дети могут находиться в группе риска по развитию НБ. Результаты исследования, проведенного калифорнийскими учеными, подтвердили данное предположение[16]. В двух других американских исследованиях, в ходе которых изучали влияние веса при рождении на риск развития злокачественных новообразований у детей, установлен высокий риск, связанный с большим весом при рождении[6, 17]. Поскольку ни в одной из работ не анализировали гестационный возраст, трудно утверждать, что вес новорожденного связан с повышенным риском развития НБ вне зависимости от гестационного возраста.
Указывается также на высокий риск развития НБ у детей, рожденных с помощью кесарева сечения, по сравнению с появившимися на свет естественным путем, в частности в возрастной группе детей от 1 года до 4 лет[16]. Исследования CCG показали повышение риска развития НБ, связанного с рождением путем кесарева сечения, у детей первого года жизни. Ученые предположили, что повышенный риск может быть обусловлен использованием анестезии, в ходе исследования было обнаружено, что эпидуральная анестезия увеличивает риск развития НБ[8]. Тем не менее исследование, проведенное в штате Нью-Йорк, показало повышенный риск развития НБ при повторных родах путем кесарева сечения, но не при первых родах, осуществленных с помощью этой операции, что свидетельствует не в пользу роли анестезии в увеличении риска возникновения НБ[4]. Однако механизм подобной связи еще не изучен.
При проведении нашего исследования зарегистрировано 20 (25,0%) детей, рожденных путем кесарева сечения.
У 13% больных опухоль была обнаружена пренатально по данным УЗИ на поздних сроках гестации.
В исследовании K. Y. Urayama и соавт. проведен анализ встречаемости ВПР у пациентов с НБ[16]. Хотя данные были скудны для того, чтобы провести обоснованный статистический анализ в целях оценки рисков, связанных с конкретными нарушениями, в работе продемонстрировано преобладание случаев НБ у пациентов с патологией сердечно-сосудистой и мочеполовой систем по сравнению с контрольной группой[16]. Эти результаты подтверждаются данными ученых из CCG, которые показали повышение риска развития НБ, связанное с увеличением количества врожденных аномалий[12]. Исследователи из штата Массачусетс провели Эхо-КГ у пациентов с НБ и у детей из контрольной группы для сравнения частоты встречаемости ВПС у больных НБ и у детей с лейкемией. Они обнаружили значительно большую долю случаев этих нарушений в группе пациентов с НБ (20,0%) по сравнению с контрольной группой (3,6%)[7].
Мы исследовали частоту встречаемости пороков развития у пациентов с НБ. В 23 (28,8%) случаях при НБ были выявлены ВПС, в том числе МАРС, что превышает встречаемость ВПС, включая МАРС, в популяции[2].
При анализе частоты встречаемости ВПР на 100 детей, родившихся живыми, в РФ показано, что они составляют в целом 2,91% (1,99%–3,98%), но не превышают 4,0%, что совпадает с данными ученых США. Таким образом, значительное преобладание частоты встречаемости пороков развития и НБ в нашем исследовании не случайно, оно отражает связь развития ВПР и канцерогенеза в процессе эмбриогенеза[2].
ЗАКЛЮЧЕНИЕ
На сегодняшний день проблема ранней диагностики злокачественных новообразований у детей не разрешена. Существуют различные подходы к ранней диагностике: с одной стороны, это выделение групп риска на основании популяционных или клинических исследований, с другой — проведение тотального скрининга всех детей определенного возраста на наличие или отсутствие специфических маркеров. Подобные исследования у детей в отношении нейробластомы (НБ) проводили в Японии и Северной Европе[13, 14]. Их результаты не привели к улучшению выживаемости пациентов, но продемонстрировали рост заболеваемости, что может быть связано с диагностикой благоприятных форм НБ, которые не имели бы клинического значения в течение жизни ребенка.
В своей работе мы сделали первый шаг в поиске факторов риска развития НБ у детей первого года жизни и показали, что в отношении детей, рожденных с определенными характеристиками, необходимо интенсифицировать режимы динамического наблюдения, в том числе проводить УЗИ-мониторинг 2–4 раза в год на протяжении первых лет жизни до момента окончательного формирования симпатических ганглиев. К этой группе мы относим детей, рожденных с массой тела 4 кг и более, независимо от срока гестации. Результаты проведенного исследования подтверждают целесообразность и необходимость оценки антропометрических показателей новорожденных детей, а именно массы тела при рождении с учетом гестационного возраста.
В нашем исследовании проанализирован возраст детей на момент установки диагноза. Обращает на себя внимание большая частота случаев диагностики заболевания во втором полугодии жизни. В 16,3% случаев диагноз установлен с явным запозданием, что связано с недостаточным наблюдением детей участковым педиатром в первичной сети здравоохранения и с недостаточностью знаний о детской онкологии у врачей в целом.
Следующим этапом данной работы может быть внедрение в образовательный стандарт постдипломного образования врачей вопросов ранней диагностики злокачественных новообразований.








