Талассемии — гетерогенная группа генетически обусловленных заболеваний, характеризующихся количественным нарушением синтеза глобиновых цепей, результатом чего является частичное или полное отсутствие продукции нормального Hb с развитием хронической гемолитической анемии. Типы талассемии в зависимости от пораженной глобиновой цепи имеют названия α, β, γ, δ или их сочетания. β-талассемия бывает большой, промежуточной и малой формы. Большая форма (анемия Кули) является самым тяжелым вариантом заболевания, при котором пациент нуждается в пожизненной регулярной заместительной терапии эритроцитной массой. При промежуточной форме клинические проявления болезни выражены в меньшей степени и потребность в заместительных трансфузиях возникает редко. Малая форма β-талассемии характеризуется легкой гипохромной микроцитарной анемией, появляющейся на фоне интеркуррентных заболеваний и не нуждающейся в коррекции[1, 27, 33].
Талассемия встречается преимущественно в странах Средиземноморского бассейна, на Среднем Востоке, в Юго-Восточной Азии, южной части Тихого океана и в Южном Китае, частота носителей гена болезни в популяции — от 2% до 25%. На территории бывшего СССР талассемии наиболее распространены в Азербайджане (в некоторых районах наблюдают у 7–10% населения), Грузии, Армении, на Северном Кавказе, в республиках Средней Азии. В связи с миграцией населения из эндемичных районов гемоглобинопатии распространились в регионах, где ранее они крайне редко встречались среди коренных жителей (в России, Северной Америке, Европе и др.), и сегодня представляют глобальную проблему общественного здравоохранения[1, 27].
У пациентов с большой формой β-талассемии потребность в заместительных трансфузиях эритроцитной массы в сочетании с неэффективным эритропоэзом и повышенной абсорбцией железа в ЖКТ ведет к гемосидерозу внутренних органов, включая сердце. При этом жизненно необходимой становится терапия хелаторами железа — второе после трансфузионной терапии направление в лечении таких больных [33]. Трансфузии и хелаторная терапия значительно улучшили выживаемость и снизили смертность пациентов с большой формой β-талассемии: в 60-е годы XX века 80% таких больных умирали к 16 годам[19], в то время как сегодня по крайней мере 80% из них доживают до возраста 40 лет и более[17]. Это уникальное достижение, однако кардиологические осложнения по-прежнему являются ведущей причиной смерти трансфузионно-зависимых пациентов с β-талассемией (около 70% случаев)[33]. Ассоциированная с перегрузкой железом кардиомиопатия (КМП) представляет собой систолическую или диастолическую дисфункцию миокарда в результате отложения железа в сердце, независимо от других сопутствующих процессов[30]. КМП характеризуется наличием рестриктивной формы с ранним развитием диастолической дисфункции, которая неуклонно прогрессирует, приводя в конечной стадии к дилатационной КМП[31].
Хотя β-талассемия традиционно считается болезнью, связанной с перегрузкой железом, механизм поражения сердца при этой патологии гораздо более сложный (рис. 1). Помимо токсического воздействия избытка железа на миокард, дополнительную нагрузку на сердце дают повышение сердечного выброса, характерное для хронической анемии, высокая вероятность развития миоперикардита вследствие нарушений в иммунной системе, а также повышенная постнагрузка, связанная с повреждением артериальных сосудов[2, 26, 31, 36].
Рис. 1. Патофизиология кардиомиопатии, ассоциированной с перегрузкой железом, при β-талассемии ([23], с изменениями]
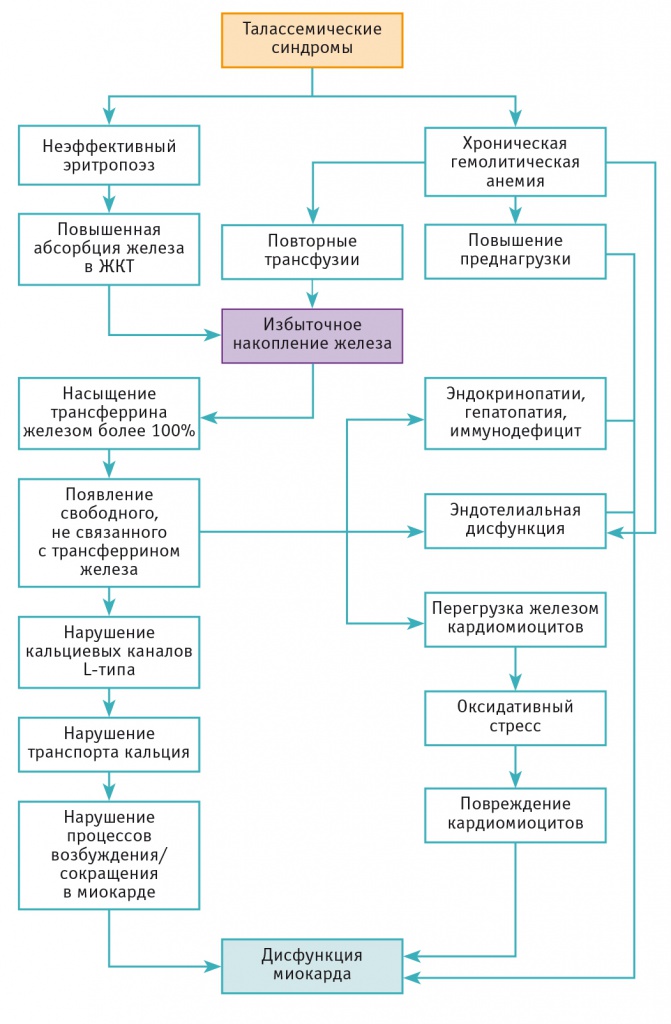
Поскольку Hb отвечает за транспорт кислорода, для сохранения объема его доставки при хронической анемии компенсаторно увеличиваются сердечный выброс и сердечный индекс. Увеличение сердечного индекса обычно достигается ростом конечно-диастолического объема, ударного объема и ЧСС. Для поддержания нормального системного давления в условиях повышенного сердечного выброса организм снижает системную сосудистую резистентность путем дилатации периферических артерий, что ведет к уменьшению диастолического давления[41]. В соответствии с законом Старлинга, при снижении постнагрузки и усилении преднагрузки у пациентов с хроническими анемиями отмечают компенсаторное повышение сократимости миокарда (рост фракции выброса). Отмечено, что при анемиях увеличение ударного выброса в покое происходит при концентрации Hb ниже 90 г/л[12]. В то же время у пациентов с β-талассемией даже при адекватной трансфузионной терапии со средним предтрансфузионным содержанием Hb более 95 г/л, с хорошей супрессией сверхактивности костного мозга и со средним содержанием Hb между трансфузиями 113 г/л до некоторой степени увеличивался сердечный выброс (сердечный индекс — 4,3 ± 0,9 л/м2 при β-талассемии и 3,9 ± 0,8 л/м2 у здоровых добровольцев, р < 0,01)[3].
Любая серьезная инфекция может спровоцировать поражение сердца, особенно при наличии другой сопутствующей кардиальной патологии. Поскольку иммунная состоятельность при β-талассемии нарушена[24, 25, 29], пациенты более чувствительны к инфекциям — как вирусным, так и бактериальным. Кроме того, такие бактерии-сидерофоры, как Yersinia и Klebsiella, используют железо для размножения и хорошо растут в организме пациентов с перегрузкой железом[25, 29]. В прошлом у больных β-талассемией с недостаточной хелацией или без таковой перикардит наблюдали в 50% случаев[19], в то время как сейчас при использовании хелаторной терапии он встречается редко (в 5% случаев)[3].
В последнее время на основании клинических, функциональных и анатомических исследований обнаружено, что в развитии сердечной дисфункции при β-талассемии также играет роль системное поражение артериального русла[16]. Предполагают, что повреждение эластической ткани артерий и пролиферация эндотелия возникают вследствие снижения биодоступности оксида азота из-за хронического гемолиза, а также в результате непосредственного воздействия повышенной концентрации лабильного железа в плазме[23].
Токсическое воздействие железа может косвенно нарушать функцию сердца, вызывая повреждение других органов, в частности при развитии гипотиреоза и сахарного диабета[2]. Гипотиреоз может стать причиной перикардиального выпота, снижения функции ЛЖ, брадикардии и повышения резистентности периферических сосудов. Инсулинозависимый сахарный диабет ассоциируется с появлением сердечной дисфункции и поражением сосудов.
В сердце железо откладывается как в кардиомиоцитах всех отделов сердца, так и в проводящей системе, включая синоатриальный и атриовентрикулярный узлы[13]. В свободной стенке ЛЖ железо накапливается преимущественно в эпикардиальных слоях, в меньшей степени — в эндокарде и среднем слое[14]. С эпикарда отложения железа распространяются на перикард, увеличивая риск возникновения перикардита, который может иметь компонент спровоцированного железом химического воспаления. Они также могут приводить к фиброзу перикарда (как при наличии вирусного миокардита, так и без него). Гистологически при перегрузке железом обнаруживают гипертрофию миоцитов с множественными отложениями коричневого гранулированного вещества — железа — в цитоплазме кардиомиоцитов[2].
Клинические проявления поражения сердца при β-талассемии — сердечная недостаточность, аритмии и миоперикардит[2, 22, 27, 33]. Проявления миоперикардита и аритмий неспецифичны, симптомы у них такие же, как и в общей популяции. Дебют может быть внезапным, иногда ассоциированным с инфекцией. У некоторых пациентов начальные проявления — симптомы левожелудочковой недостаточности: одышка, кашель, повышенная утомляемость, сопровождающаяся хрипами и ритмом галопа при аускультации органов грудной клетки, — но следует заметить, что у большинства больных появляются симптомы правожелудочковой недостаточности. Пациенты часто попадают в клинику с выраженной утомляемостью и болями в животе, которые связаны с увеличением печени. Возможен кашель без диспноэ. Эти признаки можно неверно истолковать как не имеющие отношения к заболеванию сердца[33].
Вызванное железом токсическое поражение сердца часто проявляется аритмиями: у пациентов с β-талассемией встречаются предсердные или желудочковые экстрасистолии, пароксизмальная предсердная тахикардия, фибрилляция предсердий. Жизнеугрожающая желудочковая тахикардия встречается редко и часто ассоциируется со снижением функции ЛЖ. Кратковременная неспецифическая желудочковая тахикардия — довольно распространенное явление при повышении содержания железа в сердце. Предсердные аритмии встречаются реже. Они тяжелее клинически и сложнее поддаются лечению, но менее специфичны как проявления токсичности железа. Некоторые из этих аритмий также могут быть пусковыми механизмами развития застойной сердечной недостаточности или снижения функции сердца у пациентов с β-талассемией без предшествующей дисфункции ЛЖ[2, 22].
Сердечная недостаточность может возникнуть в любом возрасте начиная с 10 лет, но при адекватном лечении β-талассемии она обычно появляется в третьей или четвертой декаде жизни[3]. При клинических проявлениях сердечной недостаточности прогноз неблагоприятен. Талассемическая КМП может быть обратима при своевременной интенсификации хелаторной терапии[20], но ранняя диагностика КМП существующими традиционными методами недостаточно успешна. Систолическая и диастолическая функции миокарда у пациентов с посттрансфузионной перегрузкой железом, измеряемые традиционными методами, остаются сохранными вплоть до финальных стадий болезни. Причем прогрессия от легких отклонений эхокардиографических показателей до молниеносного развития сердечной недостаточности часто происходит быстро и неуклонно[31, 33].
Повсеместно для прогнозирования поражения сердца железом опираются на традиционный биохимический параметр — содержание ферритина в сыворотке крови. При хелаторной терапии оно, как правило, существенно снижается. Использование ферритина сыворотки как показателя перегрузки железом ограничивается тем, что это белок острой фазы и на его концентрацию в сыворотке влияет множество факторов: воспаление, лихорадка, болезни печени, инфекции, гемолиз, дефицит аскорбиновой кислоты. Показано, что содержание ферритина сыворотки может быть высоким даже до повышения отложений железа в органах и тканях[15]. С другой стороны, интенсивная хелаторная терапия у пациентов с выраженной перегрузкой железом способна снизить концентрацию ферритина в сыворотке крови, в то время как уровень железа в тканях, особенно в сердце, останется повышенным[7].
Концентрация железа в печени по данным биопсии до недавнего времени считалась «золотым стандартом» прямого определения общих запасов железа в организме[8], а также более достоверным по сравнению с концентрацией ферритина сыворотки индикатором риска сердечной заболеваемости и смерти. Однако более поздние исследования, в том числе с использованием МРТ сердца в режиме Т2*, показали отсутствие статистически значимой связи между концентрациями железа в печени и сердце и прогностической ценности определения концентрации железа в печени для оценки состояния сердца[5, 6, 37]. Таким образом, использование концентрации железа в печени как фактора, определяющего поражение сердца, оказалось ошибочным. Темпы накопления железа в печени и сердце различны, а с помощью МРТ удалось установить, что темпы очищения от железа при интенсификации хелаторной терапии в этих двух органах значительно различаются: печень отвечает быстрее[7]. К тому же биопсия является инвазивной процедурой и не может использоваться многократно для последующего наблюдения.
Натрийуретический пептид типа В (BNP) и концевой пронатрийуретический пептид (NT-proBNP) — неспецифические маркеры перегрузки сердца объемом или давлением. Концентрация BNP в плазме крови повышается у пациентов с очевидной дисфункцией сердца, но его содержание не отражает тяжести сердечной недостаточности[4]. Сведения о значимости определения уровней BNP и NT-proBNP у пациентов с β-талассемией противоречивы: некоторые исследователи обнаружили связь между концентрацией BNP, ранними проявлениями диастолической и систолической дисфункций и содержанием ферритина в сыворотке крови[28], в то время как другие авторы такой связи не выявили и считают, что прогностической ценности у измерения уровней BNP и NT-proBNP для определения перегрузки сердца железом нет[11].
Рентгенография грудной клетки позволяет обнаружить кардиомегалию, возникающую вследствие гипердинамического кровообращения, а в случаях сопутствующей легочной гипертензии — застойные явления в легких и плевральный выпот[33].
ЭКГ при β-талассемии редко бывает в норме: у пациентов без сердечной недостаточности изменения обнаруживают в 46% случаев[34], при ее наличии — практически у всех больных. Часто встречаются широкий комплекс QRS с низким вольтажом, инверсия зубца Т, неспецифические изменения интервала ST-T, признаки гипертрофии ЛЖ, замедление атриовентрикулярного проведения или аритмии[2].
Эндомиокардиальная биопсия не является рутинным методом оценки содержания железа, однако может использоваться для точного определения отложения железа в тканях миокарда с детальным гистологическим анализом поражения органа-мишени[32]. Железо откладывается в разных отделах миокарда, но больше всего в эпикарде, что ограничивает возможности эндомиокардиальной биопсии в клинической диагностике[13, 32].
В последние годы лучшим неинвазивным методом оценки содержания железа в миокарде считают МРТ сердца в режиме Т2*[21, 22]. Он более чувствителен, чем классические МРТ-методы (T2, SIR), и позволяет выявить даже относительно небольшую концентрацию железа в миокарде еще до появления нарушений строения и функции сердца[21]. МРТ-сканеры создают изображение органа на основании сигнала, появление которого зависит, помимо прочего, от концентрации железа в ткани. В органе без отложений железа эти сигналы гомогенны и релаксация (угасание сигналов) длится дольше, при этом изображение органа остается светлым. В органе с отложениями железа парамагнитный эффект железа способствует изменениям интенсивности и восприимчивости магнитно-резонансного сигнала, при этом время релаксации укорачивается, изображение быстрее становится темным[22]. Т2* — время (мс), необходимое органу для потери примерно двух третей сигнала. Т2* уменьшается при повышении концентрации железа, т. е. чем меньше его значение, тем выше концентрация железа в тканях. Некоторые исследователи используют показатель угасания сигнала R2 (R2 = 1,000/T2), обратный показателю Т2*, который измеряется в Гц или с-1[5, 14]. Установлена хорошая воспроизводимость результатов метода в разных учреждениях и на разных аппаратах[40], и исследование Т2* МРТ сердца сегодня признано наиболее точным методом определения отложения железа в сердце, коррелирующим с химическими измерениями при посмертных биопсиях сердца[14]. Показано, что Т2* миокарда не зависит от концентрации ферритина в сыворотке крови и концентрации железа в печени[6] (рис. 2). Согласно многочисленным исследованиям, пациентов с Т2* > 25 мс расценивают как не имеющих отложения железа в сердце; с Т2* от 10 до 20 мс — как имеющих небольшие или умеренные отложения железа в сердце и риск сердечной декомпенсации средней степени; с Т2* < 10 мс — как имеющих значительные отложения железа в сердце и высокий риск сердечной декомпенсации[22, 27].
Рис. 2. Магнитно-резонансная томограмма в режиме Т2*, цветное картирование содержания железа в тканях: А — высокое содержание железа в печени (стрелка) у пациента с β-талассемией; Б — умеренное содержание железа в сердце (стрелка) у пациента с β-талассемией
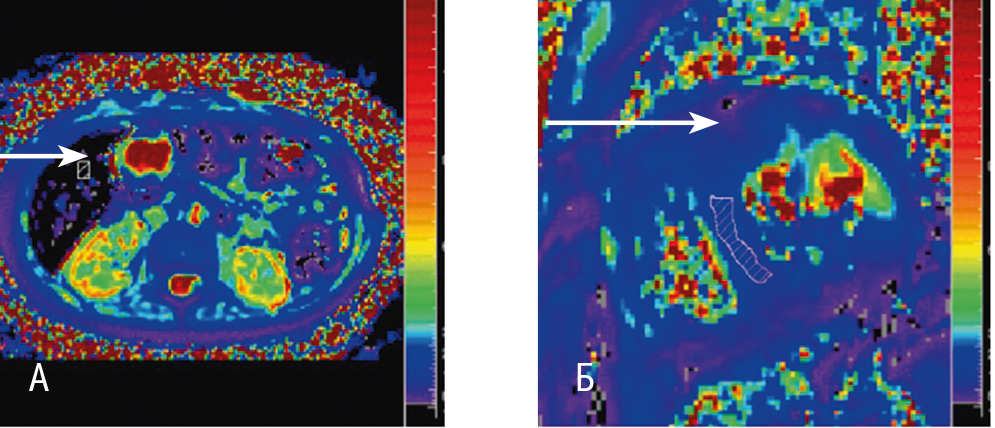
Недостатки МРТ — высокая стоимость, большие временны́е затраты, невозможность использования у пациентов с водителями ритма, дефибрилляторами и имплантированными металлическими устройствами, а также у лиц, страдающих клаустрофобией, отсутствие общедоступности[2]. Необходимо отметить, что для определения Т2* необходимо дополнительное программное обеспечение к томографу и требуется обучение специалиста. Следует также учитывать, что на сегодняшний день рекомендуемые показатели Т2* установлены для томографов мощностью 1,5 Т. Исследования оценки перегрузки железом различных органов на томографах мощностью 3 Т проводят, но опыт клинического применения этих аппаратов еще очень мал. Известно, что значения Т2* на томографах мощностью 3 Т меньше, чем на аппаратах мощностью 1,5 Т[33].
Трансторакальная Эхо-КГ — широко распространенное и относительно недорогое исследование, позволяющее оценить не только строение сердца, но и его систолическую и диастолическую функции, давление в легочной артерии, состояние клапанов и перикарда. При анализе параметров Эхо-КГ у пациентов с β-талассемией необходимо учитывать особенности гемодинамики при хронической анемии. В частности, анемия ассоциируется с компенсаторным увеличением сердечного выброса, в связи с чем фракция выброса ЛЖ у таких пациентов должна быть выше нормы. Больным с анемией и талассемией рекомендован показатель нормальной фракции выброса ЛЖ более 60%, в то время как у здоровых людей он составляет более 50%[39]. Таким образом, заключение с «нормальными» показателями систолической функции, выданное врачом УЗИ, не имеющим опыта работы с подобными пациентами, может ввести в заблуждение неопытного клинициста[38].
Кроме того, сердечно-сосудистые компенсаторные механизмы при хронической анемии способствуют формированию гипердинамического типа циркуляции, поэтому увеличение скоростей внутрисердечного кровотока может отражать нормальный физиологический ответ, а не патологические изменения вследствие стеноза клапанов (в частности, в легочном кровотоке)[38, 39].
При β-талассемии показатели систолической функции, как правило, не изменяются в течение длительного времени. Нарушения систолической функции ЛЖ становятся очевидными, когда в миокарде уже имеются значительные отложения железа[39]. Диастолическая дисфункция развивается раньше, чем систолическая, причем на поздних стадиях заболевания она становится рестриктивной[31, 39]. Однако исследование традиционных диастолических показателей у пациентов с β-талассемией демонстрирует противоречивые результаты, поскольку эти показатели зависят от объемных условий и ЧСС[10, 35].
Новая технология оценки функции сердца — тканевая доплерография (ТД) — позволяет получить информацию о локальном движении стенок сердца и его скорости, различить пассивные и активные движения и лучше описать региональную функцию миокарда[39]. Показатели ТД в меньшей степени, чем традиционные эхокардиографические показатели, зависят от перегрузки объемом и давлением. Клиническое применение методов ТД только развивается, но уже опубликованы первые результаты исследований, в том числе результаты лечения пациентов с β-талассемией. Отмечают, что ТД позволяет выявить региональную систолическую и диастолическую дисфункцию миокарда при β-талассемии, в том числе и у детей, раньше, чем традиционные ультразвуковые методы[9, 10]. Однако в некоторых исследованиях не было обнаружено преимуществ ТД перед традиционными доплеровскими показателями[18], в связи с чем необходимо дальнейшее изучение места ТД в клинической практике.
ЗАКЛЮЧЕНИЕ
Сердечная недостаточность, возникающая в первую очередь в результате отложения железа в миокарде, является основной причиной смерти пациентов с β-талассемией. Дополнительную нагрузку на сердце дают адаптация к условиям анемии, а также нарушение иммунного статуса и эндотелиальная дисфункция.
Кардиомиопатия при β-талассемии длительное время протекает бессимптомно. Клинические симптомы появляются, как правило, уже на финальных стадиях болезни. В связи с этим особое значение имеют раннее выявление поражения сердца и своевременная интенсификация хелаторной терапии.
На сегодняшний день основным методом, позволяющим оценить концентрацию железа в миокарде, является МРТ сердца в режиме Т2*. Содержание ферритина в сыворотке крови и железа в ткани печени по данным биопсии не отражает концентрацию железа в ткани сердца. Эхо-КГ по-прежнему имеет клиническое значение для выявления и динамического наблюдения отклонений в морфологии и функции сердца, однако она должна выполняться в центрах, где уже имеется опыт работы с пациентами с перегрузкой железом, и учитывать особенности гемодинамики при данной болезни.








