Внебольничной (домашней, амбулаторной) считается пневмония, которая развилась вне больницы или в первые 72 часа после госпитализации. Несмотря на значительные успехи в медицинской науке, внебольничная пневмония (ВП) сохраняет высокую актуальность для педиатрической практики, что определяется высоким уровнем заболеваемости и относительно высокой смертностью от этого заболевания. В реальной практике серьезными проблемами являются ранняя диагностика и выбор рациональной терапии ВП у детей[1].
В последние годы в мире проведено большое количество исследований, касавшихся различных аспектов пневмонии в детском возрасте, появились обновленные зарубежные руководства по ведению детей с ВП. В 2013 г. Минздравом России были приняты новые стандарты медицинской помощи при пневмонии и Порядок оказания медицинской помощи населению по профилю «пульмонология». С 2014 г. в Национальный календарь профилактических прививок России включена вакцинация против пневмококковой инфекции. В связи с этими инициативами назрела необходимость пересмотра целого ряда практических рекомендаций, касающихся ВП у детей. В настоящее время межрегиональная общественная организация «Педиатрическое респираторное общество» готовит к изданию новую версию научно-практической программы «Внебольничная пневмония у детей», которая создается на основе консенсуса ведущих экспертов России и стран СНГ.
В данной статье освещен ряд современных положений относительно диагностики, лечения и профилактики ВП у детей. Указанные аспекты тесно связаны с этиологией пневмонии, в связи с чем представлена также актуальная информация о возбудителях заболевания и их резистентности.
ЭТИОЛОГИЯ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ
Этиологию заболевания определяют в зависимости от условий, в которых произошло инфицирование, возраста пациента, наличия сопутствующих заболеваний и вакцинации против пневмококковой и гемофильной инфекций, коклюша, гриппа. Основное значение в возникновении ВП имеют различные бактерии, в таблице 1 представлены суммированные сведения об их роли по данным монографии Европейского респираторного общества[11].
Таблица 1
Ключевые бактерии, вызывающие внебольничную пневмонию у детей в различном возрасте[11]
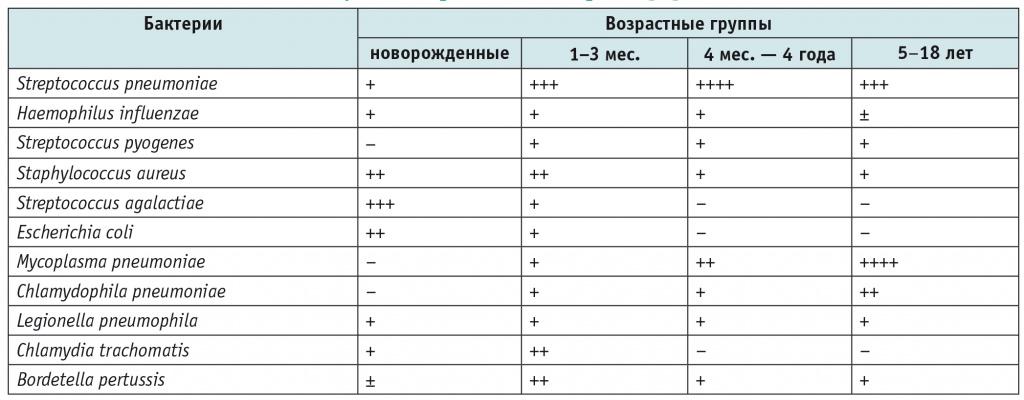
Примечание: (++++) — очень часто; (+++) — часто; (++) — относительно нечасто; (+) — редко; (±) — очень редко; (‒) — отсутствуют.
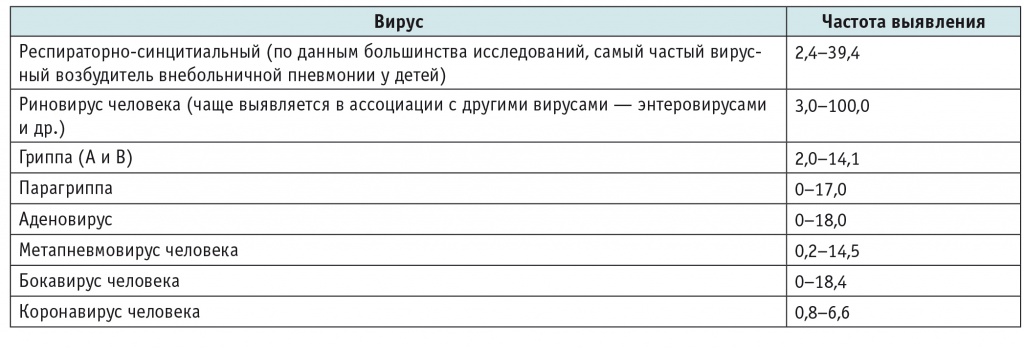
В то же время большое значение в этиологии ВП, особенно у детей раннего возраста, имеют вирусы, которые могут быть единственным возбудителем или играть роль копатогена при пневмонии бактериальной этиологии. В 2009‒2013 гг. в разных странах были проведены 13 крупных исследований с участием более 7 тысяч детей, в которых оценивали этиологическую роль вирусов при ВП. В среднем вирусы были выявлены у 41,3% пациентов — от 17,9 до 73,5% в различных исследованиях (табл. 2)[18].
Таблица 2
Роль вирусов при внебольничной пневмонии у детей, %[18]
Нарастающей глобальной проблемой, влияющей на стратегию антибактериальной терапии (АБТ), является резистентность бактериальных возбудителей инфекции к антибиотикам. Наиболее объемные данные по резистентности клинических штаммов Streptococcus pneumoniae в России получены в рамках многоцентрового исследования ПеГАС, которое проводилось в три этапа в 1999‒2009 гг.[4]. Уровень резистентности пневмококков к пенициллину в 2006‒2009 гг. превысил критические 10%. Однако чувствительность к амоксициллину, являющемуся препаратом выбора при пневмококковых инфекциях, сохранялась на очень высоком уровне (более 99,5%). Пневмококки лишены способности продуцировать β-лактамазы, а механизм их резистентности к β-лактамным антибиотикам обусловлен модификацией пенициллинсвязывающего белка. Устойчивость S. pneumoniae к макролидам и линкозамидам, по данным исследования ПеГАС, не превышает 10%, при этом резистентность к 16-членным макролидам и линкозамидам наблюдали реже, чем к 14- и 15-членным макролидам. Резистентность S. pneumoniae к карбапенемам и ванкомицину отсутствовала, а к респираторным фторхинолонам были резистентны лишь единичные штаммы возбудителя[4].
ДИАГНОСТИКА ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ
Пневмония не имеет патогномоничных симптомов, в связи с чем основную роль в постановке диагноза ВП отводят комбинации клинических и инструментальных данных (табл. 3). Чувствительность сочетания лихорадки, тахипноэ, локальных ослаблений дыхания и хрипов для диагностики пневмонии составляет около 94%[8].
Таблица 3
Клинические проявления пневмонии[1, 2, 7, 8, 11, 13]

В условиях с ограниченными ресурсами ВОЗ рекомендует у детей в возрасте до 5 лет с кашлем или затруднением дыхания ставить диагноз пневмонии при наличии тахипноэ или втяжении грудной клетки на вдохе[2]. Российские эксперты считают, что диагностика ВП должна обязательно включать рентгенографию грудной клетки.
При ВП микоплазменной этиологии часто наблюдают бронхит, проявляющийся диффузными сухими и влажными хрипами, обычно асимметричными и непостоянными. Для ВП хламидийной этиологии характерно постепенное развитие, нередко на фоне заболевания отмечают воспалительные симптомы со стороны верхних дыхательных путей[7].
Результаты общего анализа крови при ВП зависят от этиологии заболевания[1, 7]:
- для ВП, вызванных S. pneumoniae и другими типичными бактериями, характерны нейтрофильный лейкоцитоз и существенное повышение СОЭ;
- для ВП микоплазменной, хламидийной и вирусной этиологии изменения нехарактерны (за исключением хламидийной пневмонии у детей первых месяцев, при которой может наблюдаться высокий лейкоцитоз).
Однако проведенные исследования показывают, что изменения в общем анализе крови при ВП обладают низкой информационной ценностью как для постановки диагноза, так и для уточнения этиологии заболевания[7, 10, 11, 13].
Значительное повышение в крови уровней СРБ и других белков острой фазы характерно для тяжелой пневмонии бактериальной этиологии. Определение значений СРБ в динамике может быть использовано для оценки эффективности терапии[7, 8, 10, 11].
Исследования последних лет свидетельствуют об информативности уровня прокальцитонина (ПКТ) крови при пневмонии:
- значение ПКТ существенно зависит от этиологии заболевания, и его определение может быть полезно при выборе терапии: для бактериальной пневмонии характерно повышение показателя более 1 нг/мл (при пневмококковой — обычно выше 2 нг/мл), при вирусной пневмонии он, как правило, ниже 1 нг/мл;
- уровень ПКТ, как правило, коррелирует с тяжестью заболевания и может использоваться как один из критериев для перевода пациента в отделение реанимации и интенсивной терапии;
- показатель быстро нормализуется на фоне адекватной АБТ и может применяться как объективный критерий для ее отмены[1, 11].
Рентгенография грудной клетки — надежный метод для подтверждения пневмонии, который позволяет определить объем поражения и наличие осложнений. Однако изменения на рентгенограмме не дают возможности судить об этиологии ВП. В то же время при выборе эмпирической АБТ нужно учитывать, что для пневмококковой пневмонии более характерна гомогенная тень с четкими границами, а для микоплазменной — негомогенная, без четких границ[7].
Пульсоксиметрия — неинвазивный метод измерения насыщения артериальной крови кислородом, который рекомендуют применять у всех пациентов с ВП для объективной оценки тяжести заболевания и решения вопроса об объеме лечебных мероприятий[8, 10]. При ВП с признаками бронхообструктивного синдрома целесообразны функциональные методы оценки внешнего дыхания (спирография, бронхофонография с бронхолитическим тестом).
Применение микробиологической диагностики при ВП ограничено объективными причинами, поэтому в амбулаторных условиях ее практически не проводят. Современные зарубежные руководства не рекомендуют проведение микробиологической диагностики ВП у детей в амбулаторных условиях. Бактериологический анализ крови целесообразно выполнять у госпитализированных детей с тяжелой ВП[8, 10]. Бактериоскопию мазка мокроты, окрашенного по Граму, и исследование культуры мокроты рекомендуется осуществлять у госпитализированных детей во всех случаях отделения мокроты. Основным методом диагностики является классический бактериологический анализ мокроты, чувствительность и специфичность которого составляют около 50%. Существенный недостаток этого метода — позднее получение результатов (через 3‒4 суток от забора материала)[1]. Каждый полученный образец плеврального экссудата рекомендуется направлять на бактериологический анализ. Целесообразны ПЦР-диагностика и определение антигенов пневмококка в плевральной жидкости[8, 10].
Проведение тестов для выявления антигенов пневмококка в моче для диагностики пневмонии у детей не рекомендуется в связи с высокой частотой ложноположительных результатов, что объясняется высоким уровнем носоглоточного носительства S. pneumoniae [10].
Иммунологические методы диагностики направлены на обнаружение антигена и/или антител возбудителя. Их применяют преимущественно в целях выявления вирусов и атипичных возбудителей. Методы ПЦР позволяют обнаружить и идентифицировать бактерии без выделения чистых культур, характеризуются высокой диагностической точностью и особенно актуальны для выявления атипичных бактерий и респираторных вирусов. Для анализа используют мазки со слизистых оболочек, трахеальный аспират, мокроту, кровь[8, 10, 13]. Недостатком ПЦР является невозможность отличить живого возбудителя от погибшего, что может приводить к ошибкам в интерпретации положительных результатов ПЦР при контроле эффективности лечения больного.
Современные зарубежные руководства не рекомендуют проведение рентгенографии грудной клетки при подозрении на ВП у ребенка, если состояние пациента не требует госпитализации[8, 10]. Утвержденный в 2012 г. Минздравом России стандарт первичной медико-санитарной помощи при пневмонии разработан для амбулаторных условий и не предусматривает выполнение рентгенографии грудной клетки у всех пациентов[6]. Однако необходимо учитывать, что у трети больных ВП диагностируется только через 3‒5 дней от начала заболевания. В связи с этим эксперты Педиатрического респираторного общества считают целесообразным проведение рентгенографии грудной клетки у всех детей с подозрением на пневмонию[1].
В целом диагноз пневмонии является достоверным в случае выявления на рентгенограмме грудной клетки инфильтрации легочной ткани и при наличии не менее двух из следующих критериев:
- лихорадка выше 38 °С в течение 3 суток и более;
- кашель с мокротой;
- физикальные симптомы пневмонии;
- лейкоцитоз более 15 × 109/л и/или число палочкоядерных нейтрофилов свыше 10%.
При наличии указанных клинических проявлений без рентгенографического подтверждения диагноз считается вероятным[1].
ЛЕЧЕНИЕ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ
Большинство детей с ВП могут эффективно лечиться в амбулаторных условиях. Показаниями для госпитализации являются:
- возраст до 6 месяцев;
- тяжелая пневмония;
- наличие тяжелых фоновых заболеваний — врожденного порока сердца, хронических заболеваний легких, иммунодефицита, сахарного диабета;
- проведение иммуносупрессивной терапии;
- отсутствие условий для лечения на дому или гарантий выполнения рекомендаций;
- отсутствие ответа на стартовую АБТ в течение 48 часов[1, 7, 13].
При неосложненной ВП целесообразна ранняя выписка из стационара — сразу после достижения клинического эффекта (на 3–4-й день госпитализации), что позволяет снизить риск возникновения нозокомиальных инфекций. Невыраженные симптомы заболевания, изменения в анализе крови и на рентгенограмме не являются препятствиями для выписки[1, 7].
Решающее влияние на прогноз пневмонии оказывает АБТ, поэтому при достоверном диагнозе или у больного в тяжелом состоянии с вероятным диагнозом ее следует начинать незамедлительно[1, 7, 13]. Выбор АБТ в каждом случае ВП осуществляют индивидуально: с учетом природной активности препаратов в отношении возбудителя и их возможной приобретенной резистентности, тяжести течения заболевания, наличия у пациента противопоказаний к использованию тех или иных антибиотиков. В реальной клинической практике, особенно в амбулаторных условиях, чаще проводят эмпирическую АБТ. Ее принципами являются раннее назначение антибиотика с учетом наиболее вероятного возбудителя и его чувствительности в регионе, возраста больного, наличия фоновых заболеваний, токсичности и переносимости препаратов у конкретного пациента.
Перорально применяемый амоксициллин даже у детей с тяжелой неосложненной ВП не уступает по эффективности бензилпенициллину или ампициллину, вводимым внутривенно[13]. В связи с этим у всех детей с ВП в амбулаторных условиях, а также у госпитализированных детей со среднетяжелой ВП целесообразно использовать пероральную АБТ. При тяжелой форме заболевания антибактериальный препарат (АБП) назначают парентерально или в виде ступенчатой терапии[1].
У детей старше 3 месяцев препаратом выбора для лечения ВП является амоксициллин (в стандартной дозе 45‒50 мг/кг/сут), поскольку данный антибиотик обладает стабильной высокой активностью в отношении самого частого и опасного возбудителя — S. pneumoniae, а также в большинстве случаев активен в отношении Haemophilus influenzae. Больным с фоновыми заболеваниями или принимавшим АБП в предшествующие 3 месяца назначают амоксициллин/клавуланат или цефуроксима аксетил[1, 7, 10, 11, 13]. В регионах с высокой частотой резистентности S. pneumoniae к пенициллину и у детей с риском того, что заболевания вызваны резистентными штаммами (распространенными прежде всего в детских учреждениях с круглосуточным пребыванием), рекомендуется использование амоксициллина в двукратной дозе — 80–90 мг/кг/сут[1].
При выборе режима АБТ нужно учитывать, что предиктором эффективности β-лактамных антибиотиков является показатель «Т > МПК» — время (Т), в течение которого концентрация препарата в крови выше его минимальной подавляющей концентрации (МПК) для возбудителя. Если Т > МПК превышает 40% от времени между приемами препарата, наблюдается надежный эффект, если выше 50% — максимальный. Показано, что при разделении суточной дозы амоксициллина и амоксициллина/клавуланата на три приема (каждые 8 часов) Т > МПК для пневмококка статистически значимо больше, чем при ее разделении на два приема (каждые 12 часов). В связи с этим у пациентов с ВП, особенно тяжелой, целесообразно разделять суточную дозу амоксициллина и ингибиторозащищенных аминопенициллинов на три приема[3].
При наличии признаков ВП микоплазменной или хламидийной этиологии, а также у пациентов с установленной аллергией на β-лактамы целесообразно назначение макролидов. Во втором случае в отношении S. pneumoniae более активны 16-членные макролиды (джозамицин, мидекамицин, спирамицин). При отсутствии ответа на стартовую эмпирическую терапию (в особенности у детей старше 5 лет) рекомендуется добавить к β-лактамному антибиотику макролидный[1, 10, 13].
Госпитализированным детям с сопутствующими заболеваниями или получавшим АБТ в предшествующие 3 месяца назначают ингибиторозащищенные аминопенициллины или цефуроксим парентерально в сочетании с макролидом. У пациентов с тяжелой ВП, переведенных в отделение реанимации и интенсивной терапии, применяют цефалоспорины 3‒4-го поколения или карбапенемы в сочетании с макролидом[1].
В случае парентерального назначения АБП рекомендуется ступенчатая терапия — двухэтапное применение антибиотиков с переходом с парентерального введения на пероральный прием после улучшения состояния пациента (обычно через 2–3 дня после начала лечения). Это приводит к сокращению сроков пребывания в стационаре и уменьшению стоимости лечения при сохранении его высокой эффективности[1, 10]. Оптимальным вариантом ступенчатой терапии является последовательное использование двух лекарственных форм (для парентерального введения и приема внутрь) одного и того же антибиотика. Возможно проведение АБТ препаратами, близкими по антимикробным свойствам[1].
Оценка эффективности АБТ проводится через 48 часов после ее начала. В случае недостаточности или отсутствия эффекта от лечения АБП заменяют или добавляют второй препарат[1]. Длительность АБТ определяется тяжестью и длительностью болезни, наличием осложнений, а также наличием или отсутствием фоновых заболеваний. При ВП, вызванной типичными бактериями, терапию обычно проводят 7–10 дней, атипичными бактериями — 10–14 дней[1, 11]. В последние годы наблюдается тенденция к сокращению сроков АБТ, даже при тяжелом варианте ВП[7, 10, 13]. Эксперты Педиатрического респираторного общества считают, что продолжительность АБТ при ВП должна составлять не менее 5 дней.
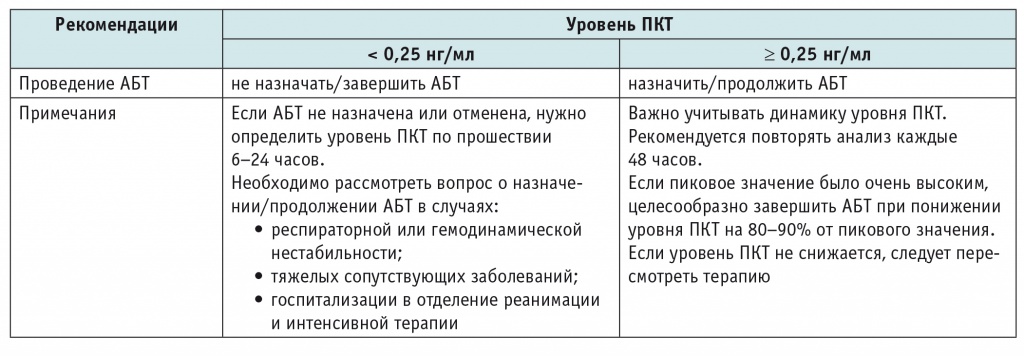
Исследования последних лет показали возможность сокращения длительности АБТ при ВП у детей в 1,5‒2 раза (с 9‒11 до 5‒6 суток) под контролем уровня ПКТ крови. Это позволяет без снижения эффективности терапии уменьшить потребление АБП, сократить сроки госпитализации, уменьшить число нежелательных лекарственных явлений, а также способствует сдерживанию роста резистентности бактерий. Определение уровня ПКТ полезно у всех госпитализированных детей с ВП (желательно использовать приборы с функциональной чувствительностью не более 0,1 нг/мл)[3]. Современные ключевые рекомендации по проведению АБТ под контролем уровня ПКТ представлены в таблице 4.
Таблица 4
Рекомендации по проведению антибактериальной терапии (АБТ) под контролем уровня прокальцитонина (ПКТ) крови
Среди пневмоний вирусной этиологии наиболее частым и тяжелым является заболевание, вызванное вирусом гриппа. При подозрении на гриппозную пневмонию противовирусное лечение рекомендуют начинать как можно раньше[10]. К средствам прямого воздействия на вирусы гриппа относятся ингибиторы нейраминидазы (осельтамивир, занамивир), препараты адамантанового ряда (амантадин, римантадин), а также умифеновир.
Осельтамивир избирательно ингибирует нейраминидазу вирусов гриппа А и В, тем самым ограничивая выход вирионов из инфицированной клетки и их распространение в организме. Вне клеток препарат угнетает рост вирусов, подавляет их репликацию и выделение из организма. Занамивир также ингибирует ферментативную активность нейраминидазы вирусов гриппа А и В, нарушая их агрегацию и выход из клеток. Он способствует уменьшению выраженности симптомов гриппа, сокращает продолжительность лихорадочного периода, снижает частоту развития осложнений. Препарат выпускается в виде аэрозоля и может применяться у детей старше 5 лет при заболеваниях, вызванных вирусами гриппа или их сочетанием с бактериальными возбудителями. В Кокрановских метаанализах, включавших большое число доказательных исследований, показана эффективность применения ингибиторов нейраминидазы у детей[14, 19].
Адамантаны имеют ограниченное применение в связи с узким спектром действия (только вирус гриппа А), быстрым формированием резистентных штаммов и часто встречающимися нежелательными явлениями[10].
Умифеновир (Арбидол) имеет широкий спектр противовирусной активности и, кроме того, оказывает иммуномодулирующее действие. В ряде клинических исследований показана его эффективность при гриппе[9]. Умифеновир может назначаться у детей старше 3 лет.
Инозин пранобекс обладает прямой противовирусной активностью в отношении широкого спектра ДНК- и РНК-вирусов в сочетании с иммуностимулирующим действием. Он может быть использован при ВП, вызванной различными вирусами (в том числе вирусом гриппа) или ассоциированной с ними[20].
По показаниям у пациентов с ВП проводят оксигенотерапию, назначают антипиретики, муколитики, бронхолитики, антигистаминные препараты и пробиотики[1].
В нашем исследовании, проведенном на базе Тверской областной детской поликлиники и Университетской детской клинической больницы ГБОУ ВПО «Первый Московский государственный медицинский университет им. И. М. Сеченова» Минздрава России была проведена оценка эффективности патогенетической терапии в раннем восстановительном периоде у 72 детей (в возрасте от 6 месяцев до 12 лет) с ВП, сопровождавшейся обструктивным синдромом. Все пациенты получали АБТ в соответствии с действующим стандартом, а также с момента обращения до 10‒14-го дня лечения — комбинированный бронхолитик (фенотерол + ипратропия бромид) ингаляционно, а с третьего дня — муколитик амброксол. На 10‒14-й день пациентов разделили на две группы: в основной группе детям был назначен препарат фенспирид (с бронхолитическим, противовоспалительным и антигистаминным эффектами) сроком на 14 дней, в контрольной фенспирид не применяли. Помимо стандартных критериев, в динамике оценивали показатели бронхофонографии, прежде всего акустический компонент работы дыхания (АКРД) в среднечастотной зоне, который является отражением степени нарушения проходимости на уровне средних бронхов.
В первые 3 дня на фоне бронхолитической терапии отмечены уменьшение клинических признаков обструкции и снижение показателя АКРД в высокочастотной зоне, что говорит об улучшении проходимости на уровне мелких бронхов. Однако АКРД в среднечастотной зоне повышался, что сопровождалось нарастанием аускультативных данных (увеличением количества сухих и влажных крупно- и среднепузырчатых хрипов). Благодаря использованию в терапии муколитика, показатель АКРД плавно снижался, что, вероятно, было связано с улучшением мукоцилиарного транспорта и отхождения мокроты. В контрольной группе после курса муколитика этот показатель продолжал плавное снижение, но длительно сохранялся выше нормальных значений. В основной группе на фоне применения фенспирида отмечали быструю нормализацию АКРД в среднечастотном диапазоне, что является признаком восстановления бронхиальной проходимости. В целом проведенное исследование продемонстрировало целесообразность назначения детям с ВП, сопровождающейся обструктивным синдромом, не только бронхолитической, но и последовательной муколитической и противовоспалительной терапии в раннем восстановительном периоде.
ПРОФИЛАКТИКА ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ
Основное значение в профилактике ВП имеет специфическое направление — иммунизация против пневмококковой инфекции, а также против гемофильной инфекции, коклюша, гриппа и кори.
Для профилактики пневмококковой инфекции используют полисахаридные и конъюгированные с белком вакцины (пневмококковые конъюгированные вакцины — ПКВ), создающие защиту от наиболее распространенных и опасных серотипов S. pneumoniae. Полисахаридная 23-валентная вакцина представляет собой смесь полисахаридов 23 серотипов пневмококка, обеспечивающих В-зависимую защиту у взрослых и детей старше 2 лет. Длительность иммунитета после прививки составляет от 3 до 5 лет. Современные ПКВ содержат полисахариды 10 или 13 серотипов пневмококка, которые обеспечивают Т-зависимую защиту, в том числе у детей раннего возраста (с 2 месяцев жизни)[1, 5].
В мире накоплен опыт массовой иммунизации детей раннего возраста 7-валентной ПКВ. По данным Кокрановского обзора, включавшего метаанализ 11 исследований в разных странах (более 113 тысяч детей до 2 лет), вакцинация ПКВ7 статистически значимо снижает частоту рентгенологически подтвержденной пневмонии[16]. Высокая эффективность ПКВ7 в предотвращении пневмонии подтверждена и в более поздних обзорах[15, 17]. В американском исследовании показано, что за 10 лет после внедрения универсальной вакцинации ПКВ7 частота госпитализации детей в возрасте до 2 лет по поводу ВП снизилась на 43%[12]. Таким образом, в результате внедрения ПКВ7 отмечалось значительное снижение бремени пневмококковой инфекции, в том числе ВП. Однако одновременно появились сообщения о распространении инфекций, вызванных серотипами пневмококка, которые не входят в состав ПКВ7 (прежде всего 19А). Для решения данной проблемы были созданы конъюгированные 10- и 13-валентные вакцины, включающие полисахариды этиологически значимых серотипов пневмококка. Новые вакцины демонстрируют высокую иммуногенность и аналогичную ПКВ7 безопасность[5].
Ключевые рекомендации по вакцинопрофилактике пневмококковой инфекции представлены в таблице 5.
Таблица 5
Рекомендации по вакцинопрофилактике пневмококковой инфекции у детей[1, 5]
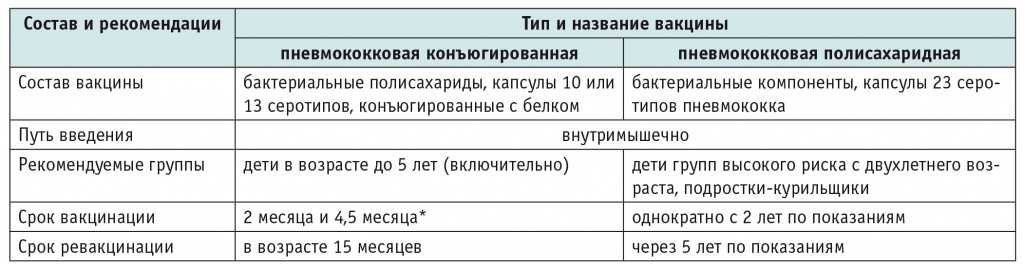
* При начале вакцинации с 6 месяцев до 2 лет вводят две дозы вакцины с интервалом в 2 месяца; при начале вакцинации с 2 до 5 лет вводят одну дозу вакцины.
К группам риска для вакцинации против пневмококка относят:
- лиц с хроническими бронхолегочными заболеваниями, в том числе бронхиальной астмой, наследственными и врожденными заболеваниями легких, ХОБЛ и пр.;
- пациентов с заболеваниями системы кровообращения тяжелого течения (сердечной недостаточностью, кардиомиопатией, врожденными пороками сердца);
- больных сахарным диабетом, с прогредиентным течением заболеваний печени и почек;
- лиц с функциональной или анатомической аспленией, ликвореей, кохлеарной имплантацией, нарушением иммунитета;
- пациентов с онкогематологическими заболеваниями, ВИЧ-инфекцией, нейтропенией;
- лиц, часто болеющих респираторными инфекциями верхних и нижних дыхательных путей, в том числе инфицированных туберкулезом.
Детям из групп риска рекомендовано в возрасте до 2 лет провести вакцинацию ПКВ, а после 2 лет — дополнительную вакцинацию полисахаридной вакциной (не ранее чем через 8 недель после ПКВ)[5].
Вакцинация против гриппа снижает также риск респираторных бактериальных инфекций и показана:
- организованным детям дошкольного возраста (посещающим дошкольные образовательные учреждения);
- учащимся 1‒11 классов;
- учащимся средних профессиональных учреждений;
- студентам высших учебных заведений.
Проведение вакцинации против гриппа осуществляется до начала эпидемического сезона детям с возраста 6 месяцев субъединичными или инактивированными расщепленными вакцинами[20].
Вакцинные препараты для иммунопрофилактики гемофильной инфекции рекомендованы для детей первых 5 лет жизни и используются с 3 месяцев. Схема иммунизации детей до 1 года включает трехкратное введение вакцины (в возрасте 3, 4,5 и 6 месяцев), совмещенное с введением вакцин против коклюша, дифтерии, столбняка и полиомиелита. Ревакцинирующую дозу вводят в 18 или 20 месяцев. При начале вакцинации в возрасте старше 1 года прививку делают 1‒2 раза с интервалом в 1,5 месяца[5].
ЗАКЛЮЧЕНИЕ
Внебольничная пневмония (ВП) у детей остается распространенным и жизнеугрожающим заболеванием.
Основное значение в лечении пациентов с ВП имеет антибактериальная терапия (АБТ), определяющая прогноз заболевания. Выбор антибиотика прежде всего обусловливается предполагаемой этиологией заболевания, тяжестью состояния больного, наличием или отсутствием аллергических реакций на препараты. Большое значение для определения тактики АБТ (выбора препарата и схемы лечения) имеет динамический контроль уровня прокальцитонина крови. У отдельных категорий пациентов необходимо назначение противовирусной терапии, бронхолитических и муколитических средств.
Главную роль в профилактике ВП играет вакцинация, прежде всего против пневмококковой инфекции.








