Брадисистолические нарушения ритма сердца (брадиаритмии) представляют собой широкий спектр аритмий, различающихся по этиологии, патогенезу, механизму возникновения и вариантам клинического течения. Характерным следствием большинства брадиаритмий являются усугубление сердечной недостаточности и чрезмерное увеличение степени когнитивной дисфункции. Длительность сохранения брадиаритмического синдрома и прогрессирования когнитивных расстройств — определяющий момент в отношении качества жизни, а также ближайшего и отдаленного прогноза жизни пациентов[2].
Неудовлетворенность клиницистов состоянием проблемы терапии и профилактики когнитивной дисфункции дает основания активизировать изучение патогенеза когнитивных расстройств. Необходимо отметить, что соответствующие экспериментальные и клинические исследования в настоящее время уже привели к формированию представлений о единстве патогенеза тяжелых форм когнитивных расстройств на их ранних стадиях. Речь идет о болезни Альцгеймера и сосудистой деменции[3, 8]. Более того, эти исследования дали возможность рассматривать патогенез когнитивных расстройств в одном ряду с патогенезом других заболеваний — атеросклероза, гипертонической болезни и сахарного диабета 2 типа, возникновение которых тесно связано с развитием процессов хронического системного воспаления[4].
Под термином «хроническое системное воспаление» в настоящее время понимают хроническую гиперактивность иммунной системы, прежде всего ее мононуклеарного фагоцитарного звена, продуцирующего избыточное количество цитокинов воспаления — интерлейкинов 1, 6, 8 (ИЛ-1, ИЛ-6, ИЛ-8), фактора некроза опухолей альфа (ФНО-α) и других протеинов воспаления. При этом различие между хроническим системным и традиционным острым воспалением, развивающимся в ответ на инфекцию или травму, локально или системно, заключается в том, что острое воспаление является, как правило, кратковременным эпизодом, во время которого уровень цитокинов повышается в десятки и сотни раз, тогда как фактор хронического системного воспаления действует длительно, а содержание цитокинов повышается в 3–4 раза[4].
О хроническом системном воспалении в ЦНС при дементивных процессах известно с 80-х годов XX века. Оно традиционно рассматривалось в качестве маркера протеинопатии, как следствие накопления бета-амилоида[19]. В последние годы роль хронического системного воспаления как важного фактора развития когнитивных расстройств, находящегося на более высокой ступени патогенетической лестницы, чем амилоидный каскад, особенно активно обсуждается в литературе[10, 13]. В настоящее время накоплено достаточно много данных, указывающих на двойную роль хронического системного воспаления — как причины протеинопатии и как ее следствия[24].
Представление о ведущей роли хронического системного воспаления в развитии когнитивных расстройств базируется на трех группах фактов, которые обобщены в целом ряде обзоров[8, 12, 17]. Первая группа касается протективного, в отношении когнитивного снижения, действия НПВС, на что указывают многочисленные, но не лишенные противоречий эпидемиологические проспективные исследования. Было показано, что все НПВС (ацетилсалициловая кислота, индометацин, ибопрофен и др.) обладают протективными свойствами, поскольку способны избирательно снижать продукцию бета-амилоида 42 и влиять на не связанный с протеинопатией механизм воспаления[12, 21]. Однако в ряде контролируемых исследований эти данные не нашли подтверждения, а в некоторых работах установлено, что протективный эффект проявляют не все НПВС, а только ингибиторы ЦОГ-1[7, 10]. При этом для получения данного эффекта препараты должны приниматься длительно в терапевтических дозах. Оказалось, что принимать такие средства нужно как можно раньше, желательно пациентам моложе 75 лет. При приеме в позднем (старческом) возрасте протективный эффект отсутствует. Установлены также различия эффективности в зависимости от аллели гена АпоЕ: лица с генотипом АпоЕε4 хуже реагируют на НПВС[9].
Вторая группа фактов, свидетельствующих о роли хронического системного воспаления в патогенезе когнитивных расстройств, касается значительного повышения уровней маркеров воспаления в периферической крови[21–23]. В первую очередь это касается С-реактивного белка (СРБ). При использовании высокочувствительной методики было обнаружено наличие этого маркера воспаления практически у всех больных с когнитивными расстройствами[11]. Установлено также повышение содержания ИЛ-1β, ФНО-α, ИЛ-6 и других провоспалительных цитокинов при деменциях[23]. В проспективных исследованиях показано, что лица с повышенной продукцией ФНО-α имеют повышенный риск развития когнитивных расстройств[22]. Подробный анализ результатов этих исследований имеется в обзоре P. McGeer[16]. Достаточно убедительным в этой области является также 6-месячное наблюдение G. S. Watson, в котором установлено, что введение синтетического антагониста ФНО-α в спинномозговой канал пациентам с болезнью Альцгеймера приводит к существенному улучшению показателей шкалы краткой оценки психического статуса (Mini-Mental State Examination — MMSE)[24].
Третья группа фактов указывает на роль активации макрофагов ЦНС (микроглии и астроцитов) и гиперпродукции провоспалительных цитокинов — ИЛ-1β, ИЛ-6, фактора хемоаттракции макрофагов 1 (МСР-1) и ФНО-α — в развитии деменции[1, 18, 20]. Известно также, что для деменции характерно активирование микроглии[1, 8]. С повышенным провоспалительным ответом микроглии на стресс связан повышенный риск когнитивных расстройств у лиц с генотипом АпоЕε4.
В свою очередь, бета-амилоид и продукты деградации нервной ткани являются стимуляторами микроглии и астроцитов, что создает замкнутый круг. Разорвать его можно либо путем подавления активности макрофагов, либо посредством элиминации бета-амилоида из нервной ткани. В первом случае важная роль принадлежит рецепторам, активирующим пролиферацию пероксисом гамма (РРАRγ), которые препятствуют провоспалительной активности универсального фактора транскрипции, контролирующего экспрессию генов иммунного ответа (NF-kB)[5, 6]. Во втором случае, как это недавно показано[14], важная роль принадлежит транспортной системе АпоЕ, и причиной патогенной роли АпоЕε4 может быть замедление элиминации бета-амилоида.
Подводя итог данным о роли хронического системного воспаления в развитии когнитивных расстройств, необходимо выделить общность когнитивных и сосудистых изменений. Патофизиологические механизмы когнитивных расстройств на ранних (доклинических) стадиях оказываются общими. При этом конвергирующим фактором является хроническое системное воспаление, а НПВС и статины, используемые для профилактики сосудистых нарушений, служат факторами, протективными не только для когнитивных расстройств, но и для атеросклероза, обусловливающего развитие многих болезней старения. Так, повышенный уровень провоспалительных цитокинов является фактором риска кардиоваскулярной патологии, а мононуклеарные макрофаги во многом определяют развитие атеросклероза и воспаления в ЦНС[13, 15].
В заключение можно констатировать: в соответствии с данными исследований последних лет, воспаление, вызванное активацией иммунной системы мозга и всего организма, обрело признание в качестве одного из ведущих факторов ранних стадий патогенеза когнитивной дисфункции.
Цель исследования: изучить взаимосвязь медиаторов воспаления (CРБ, ИЛ-6, ФНО-α) и когнитивной дисфункции у пациентов с брадиаритмиями.
МАТЕРИАЛЫ И МЕТОДЫ
Обследованы 47 пациентов в возрасте от 40 до 65 лет (средний возраст — 59,7 ± 6,3 года) с разными клиническими формами брадиаритмий на фоне ишемической болезни сердца (ИБС). Ни у кого из обследованных в качестве основной или сопутствующей патологии не было выявлено острых заболеваний воспалительного характера, и у всех пациентов традиционные лабораторные показатели воспаления были в пределах нормальных значений. Критериями исключения являлись: наличие острых или обострение хронических воспалительных заболеваний в течение двух недель до включения в исследование; тяжелая сердечная недостаточность (ФК III, IV по классификации NYHA); острый инфаркт миокарда, инсульт в анамнезе; заболевания щитовидной железы; сахарный диабет 2 типа; ревматическая болезнь сердца.
Исследования проводили в два этапа. На первом этапе определили концентрации показателей воспаления (СРБ, ФНО-α, ИЛ-6) методом твердофазного иммуноферментного анализа с использованием стандартных тест-систем у пациентов с разными клиническими формами брадиаритмий. Первую группу составили 22 пациента с атриовентрикулярной (АВ) блокадой II степени, вторую — 14 пациентов с АВ-блокадой III степени, третью — 11 пациентов с синдромом слабости синусового узла (СССУ), четвертую (контрольную) — 20 пациентов с ИБС, но без сопутствующего нарушения сердечного ритма и проводимости.
На втором этапе провели оценку когнитивных функций с использованием краткой шкалы оценки психического статуса (Mini-Mental State Examination — MMSE), пробы Шульте (среднее время выполнения теста); определение слуховой памяти по методу R. Meili (1969) и ассоциативной памяти по В. М. Блейхеру (1976). Анализ эмоционального фона осуществлялся с помощью госпитальной шкалы тревоги и депрессии (Hospital Anxiety and Depression Scale — HADS). Результаты тестирования оценивали в баллах. Все пациенты были осмотрены психиатром. В дальнейшем участников исследования распределили на две группы: первую группу составили 36 человек с когнитивными расстройствами на фоне брадиаритмии, вторую (контрольную) — 11 человек без когнитивных расстройств. Пациенты были сопоставимы по полу и возрасту. В этих группах провели определение концентраций показателей воспаления (СРБ, ФНО-α, ИЛ-6) и изучение корреляционных связей между результатами нейропсихологического тестирования и уровнями маркеров воспаления.
Статистическую обработку результатов выполняли с помощью пакета программ SPSS 11.5 for Windows. Использовали метод Шапиро — Вилкса, критерии Краскела — Уоллиса, Манна — Уитни с поправкой Бонферрони, точный критерий Фишера; корреляционный анализ проводили по методу Спирмена. Результаты представляли в виде медианы (Ме) с интерквартильным размахом (25–75-й процентили). Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведена сравнительная оценка концентраций ФНО-α, СРБ и ИЛ-6 у пациентов с разными клиническими формами брадиаритмий и в контрольной группе (табл. 1).
Таблица 1
Концентрация маркеров воспаления у пациентов с брадиаритмиями и в контрольной группе, Ме (Q1–Q3)
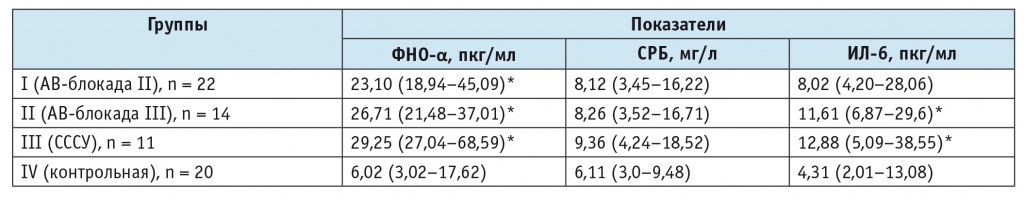
Примечания.
- (*) — различия с контрольной группой статистически значимы (р < 0,05).
- В таблицах 1–4: АВ-блокада ― атриовентрикулярная блокада; СССУ ― синдром слабости синусового узла; Ме ― медиана; Q1 и Q3 ― 25-й и 75-й процентили.
Содержание провоспалительных цитокинов различалось в разных клинических группах и было наибольшим при СССУ и АВ-блокаде III степени. При вышеуказанных брадиаритмиях повышение уровня ИЛ-6 по сравнению с контрольной группой было статистически значимым (р = 0,005 для СССУ и АВ-блокады III степени). Концентрация ФНО-α при СССУ и АВ-блокаде III степени также была выше, чем в контрольной группе (р = 0,005 для СССУ и АВ-блокады III степени). При АВ-блокаде III степени медиана превышала медиану в контрольной группе в 4,4 раза, при СССУ — в 4,8 раза. При АВ-блокаде II степени наблюдалось увеличение концентрации ФНО-α по сравнению с контрольной группой (р = 0,035), статистически значимого повышения концентрации ИЛ-6 не отмечалось (р = 0,165).
Концентрация СРБ во всех группах не превышала уровня 10,0 мг/л, что указывало на отсутствие острого воспаления, обострения хронического заболевания и травмы. При сравнении концентрации СРБ выявили, что у пациентов основных групп (с брадиаритмиями) этот показатель статистически значимо не отличался от контрольного.
Итак, АВ-блокады и СССУ сопровождались увеличением концентраций провоспалительных цитокинов. Мы предполагаем, что при данных видах брадиаритмий инициирующим аритмогенным фактором является субклиническое воспаление, которое сопровождается синтезом провоспалительных цитокинов и приводит к образованию аритмогенного субстрата. Возможен также срыв аутотолерантности при появлении клонов В-лимфоцитов. Антитела при связывании со специфическими миокардиальными антигенами могут приводить к нарушениям нормального функционирования клеток миокарда.
Изменения исследуемых показателей при АВ-блокадах отвечали таковым при СССУ, однако были менее выраженными. Предположительно это связано с тем, что локальное аутоиммунное воспаление при АВ-блокаде охватывает меньший участок миокарда, по всей видимости, локализованный в зоне АВ-узла.
Нами показано участие субклинического воспалительного процесса с аутоиммунным компонентом при брадиаритмиях, развитие которых до настоящего времени объясняли исключительно особенностями проводящей системы сердца. Вероятно, срыв аутотолерантности в данном случае является наследственно обусловленным и сопровождается нарушением клеточного метаболизма кардиомиоцитов, вследствие чего становится возможным проведение импульса по добавочным путям.
Результаты предложенных в нейропсихологическом исследовании тестов представлены в таблице 2.
Таблица 2
Показатели нейропсихологического тестирования у пациентов с брадиаритмиями и в контрольной группе, Ме (Q1–Q3)
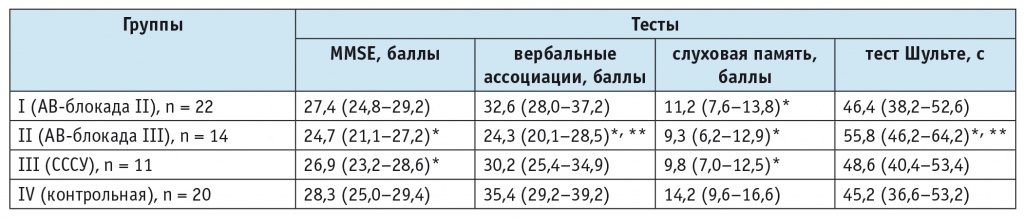
Примечания.
- (*) — различия с контрольной группой статистически значимы (р < 0,05); (**) — различия между I, II и III группами статистически значимы (р < 0,05).
- В таблицах 2, 5, 6 MMSE ― краткая шкала оценки психического статуса.
По результатам теста MMSE выявили статистически значимо меньшее количество баллов у пациентов с АВ-блокадой III степени и CCCУ по сравнению с контрольной группой. Результаты выполнения задания «Вербальные ассоциации» контрольной группой и пациентами с АВ-блокадой II степени и СССУ были статистически значимо лучше, чем у пациентов с АВ-блокадой III степени. Данные теста на слуховую память позволяют выявить снижение этой мнестической модальности у пациентов, которые страдают брадиаритмиями (р < 0,05). Среднее время выполнения пробы Шульте в контрольной группе статистически значимо меньше, чем у пациентов с АВ-блокадой III степени. Это отображает ухудшение способности к концентрации внимания и нарушение всех этапов переработки информации у последних. В группе пациентов с АВ-блокадой II степени и СССУ статистически значимые различия с контрольной группой наблюдали также в тесте на слуховую память.
Особенного внимания заслуживает своевременное выявление депрессии с преобладанием апатичного или тревожного состояния. Анализ данных HADS позволил констатировать достоверное нарастание тревоги и депрессии в группах пациентов с брадиаритмиями по сравнению с контрольной группой (табл. 3).
Таблица 3
Показатели тестирования по госпитальной шкале тревоги и депрессии у пациентов с брадиаритмиями и в контрольной группе, Ме (Q1–Q3)

Примечания.
- (*) — различия с контрольной группой статистически значимы (р < 0,05); (**) — различия между I, II и III группами статистически значимы (р < 0,05).
- В таблицах 3, 5, 6 HADS ― госпитальная шкала тревоги и депрессии.
На основании наличия или отсутствия когнитивной дисфункции были сформированы две группы, которым проводились лабораторные обследования. В группу пациентов с когнитивными расстройствами вошли 36 человек с брадиаритмиями, контрольную группу составили 11 пациентов без когнитивных расстройств. Результаты измерений уровней воспалительных маркеров представлены в таблице 4.
Таблица 4
Показатели маркеров воспаления у больных с когнитивными расстройствами и в контрольной группе, Ме (Q1–Q3)
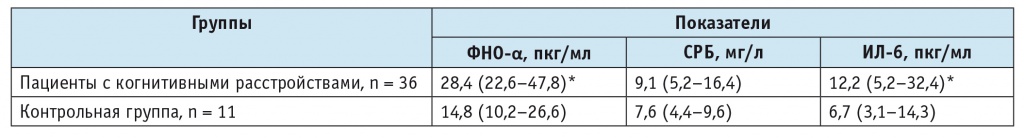
Примечание. (*) — различия с контрольной группой статистически значимы (р < 0,05).
Концентрации ФНО-α и ИЛ-6 у пациентов с когнитивными расстройствами на фоне брадиаритмий были статистически значимо выше, чем в контрольной группе, различия по уровню СРБ не имели статистической значимости.
В таблицах 5 и 6 представлены результаты корреляционного анализа с использованием коэффициента r, который вычислен между результатами, полученными при проведении нейропсихологических тестов и тестирования по HADS, а также при исследовании воспалительных изменений.
Таблица 5
Корреляционные связи между результатами нейропсихологического тестирования и маркерами воспаления у пациентов без когнитивных расстройств
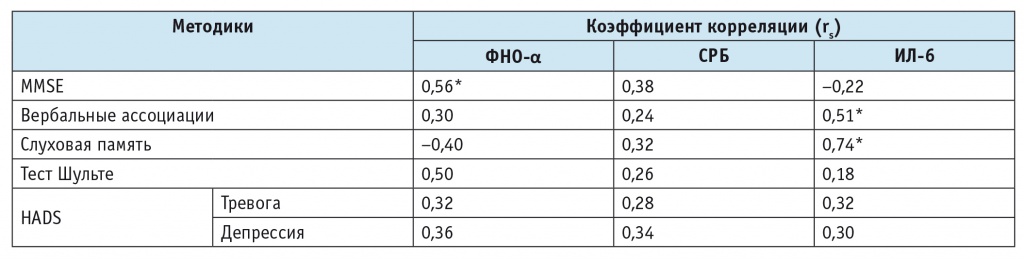
Примечание. (*) — корреляция статистически значима (р < 0,05).
Таблица 6
Корреляционные связи между результатами нейропсихологического тестирования и маркерами воспаления у пациентов с когнитивными расстройствами
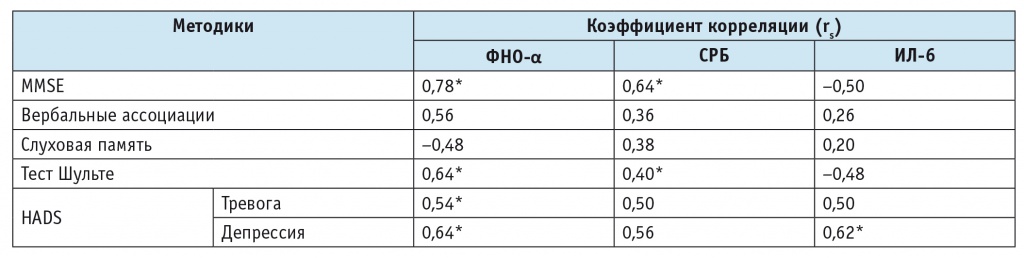
Примечание. (*) — корреляция статистически значима (р < 0,05).
У лиц контрольной группы статистически значимые корреляционные связи ФНО-α и ИЛ-6 выявлены с показателями MMSE, тестов на вербальные ассоциации и слуховую память. При наличии когнитивных расстройств эти корреляционные связи изменяются. Они обнаруживаются между ФНО-α и результатами MMSE и пробы Шульте. Обращает на себя внимание, что статистически значимые корреляционные связи существуют также между показателем СРБ и результатами тестов Шульте и MMSE. Корреляционные связи между такими показателями, как вербальные ассоциации, слуховая память и ИЛ-6, у пациентов с когнитивными расстройствами теряются, однако повышается корреляция между СРБ и результатами тестов на вербальные ассоциации, слуховую память и MMSE.
Анализ корреляционных взаимодействий свидетельствует, что существует прямая зависимость между проявлениями тревоги и депрессии, определяемыми по HADS, и значениями воспалительных биомаркеров у пациентов с когнитивными расстройствами на фоне брадиаритмий. Следует отметить, что аффективные расстройства часто сами по себе обуславливают повышение провоспалительных интерлейкинов.
ЗАКЛЮЧЕНИЕ
Основой для данного исследования послужило предположение о наличии взаимосвязи между появлением признаков ранних когнитивных расстройств у пациентов с брадиаритмиями и изменением показателей маркеров воспаления. Полученные данные подтвердили, что у пациентов с ранней верификацией когнитивных расстройств, а именно с брадиаритмиями без острых цереброваскулярных эпизодов в анамнезе, есть взаимосвязи между изменениями нейропсихологических тестов и показателями исследуемых воспалительных маркеров. Установленное в исследовании нарастание корреляционных взаимосвязей между показателями когнитивных расстройств и уровнями маркеров воспаления свидетельствует о роли нейродегенеративных расстройств у пациентов с брадиаритмиями.
Результаты иследования позволяют высказать предположение о вовлечении нарушений иммунного статуса в патогенетический механизм формирования клинической структуры когнитивных и психопатологических нарушений при брадиаритмиях.
Таким образом, полученные данные подтверждают гипотезу, что длительное существование брадиаритмии включает основные механизмы развития хронического нейродегенеративного процесса в ткани головного мозга и это приводит к иммунному воспалению и изменению проницаемости гематоэнцефалического барьера. Постепенный характер развития когнитивных расстройств у пациентов с брадиаритмиями требует разработки новых подходов к их ранней диагностике. Применение подобных взаимосвязей в дальнейшем может быть основой индивидуализации терапевтической тактики у данной категории больных.








