Исторически сложилось, что нарушением развития речи у детей занимаются логопеды, психологи, дефектологи, неврологи. Поэтому для достижения максимального результата необходимы преемственность и согласованность в работе всех специалистов. Эпидемиологические исследования в регионах, которые позволили бы представить реальную распространенность речевой патологии, не проводились, вследствие чего в литературе имеется разброс показателей по этой проблеме. Так, по данным Л. Н. Зуевой и Е. Е. Шевцовой, среди дошкольников доля страдающих нарушениями речи достигает 20–25%[7]. Л. С. Чутко указывает, что частота речевых расстройств среди детей дошкольного возраста составляет 5–10%[6].
Дети с нарушением развития речи в дошкольном периоде при переходе в общеобразовательную школу имеют проблемы с письменной речью, чтением (дислексия, дисграфия). Для многих из них школьная программа становится непосильной. Дети тяжело переживают социальную дезадаптацию, становятся раздражительными, агрессивными, замыкаются в себе, теряют уверенность. Очень важно вовремя распознать эту патологию и оказать необходимую помощь, пока существуют компенсаторные возможности головного мозга и не успели сформироваться патологические поведенческие реакции.
ВВЕДЕНИЕ
Жалобы родителей на нарушение речи у ребенка чаще всего предъявляются по достижении им трехлетнего возраста и в 5–7 лет. Это происходит потому, что до 3 лет родители ждут, когда ребенок заговорит самостоятельно, а в 5–7 лет дети с нарушением речи с трудом проходят предшкольную подготовку. Для овладения письменной речью и чтением требуется много времени, приобретенные навыки не закрепляются, что и является главным мотивом обращения к специалистам.
Этиологию специфического расстройства речевого развития в настоящее время связывают с наследственными факторами и гипоксически-ишемическим повреждением ЦНС в перинатальном периоде в виде формирования церебральной атрофии, сочетающимся с темповой задержкой развития на первом году жизни[5].
Специфические расстройства речевого развития в детском возрасте характеризуются первичными нарушениями развития речи, при которых ребенок имеет соответствующий возрасту интеллект, нормальный слух и нормальные условия для овладения речью, расстройствам речи не предшествует период нормального ее развития[5, 10, 14]. Данные расстройства характеризуются постоянным течением без ремиссий или рецидивов. В эту категорию не входят ринолалия, речевые нарушения, обусловленные нарушением слуха, умственной отсталостью, аутизмом, эпилепсией. Речевые звуки, используемые этими детьми, ниже уровня их интеллектуального развития, хотя понимание речи находится в пределах нормы. При этом могут отмечаться (или не отмечаться) расстройства артикуляции. Двигательные расстройства речевого акта у этих пациентов носят разноплановый характер, наблюдаются псевдобульбарная дизартрия, мозжечковая дизартрия, корковая дизартрия, экстрапирамидная мезенцефально-диэнцефальная дизартрия по типу гипо-, гипер- и дистонии[2]. Данные синдромы могут сочетаться у детей в различных вариациях.
Речевые нарушения в детском возрасте сопровождаются неврологической симптоматикой: двигательными нарушениями (нарушение равновесия, координации движений, мелкой моторики), синдромом дефицита внимания и гиперактивности (СДВГ), церебрастенией, эмоциональной лабильностью, неврозоподобными нарушениями (ночные страхи, энурез, тики, заикание), вегетососудистыми нарушениями, головными болями.
У детей применение Церебролизина описано с 1970-х годов как отечественными (Е. В. Шмидт, 1975), так и зарубежными авторами (W. Englert, D. Schlich, 1977). Этот препарат наиболее изучен при лечении СДВГ у детей и подростков (Н. Н. Заваденко, 1990; О. Л. Бадалян, 1993; Н. Ю. Сотникова, 2003) и на различных этапах лечения ЧМТ (Е. В. Изнак и соавт., 2010; Z. Fei, Y. I. Shenyui, 1992; D. Zhou, S. Yang, 1993; M. Wang et al., 1998). При СДВГ эффективность применения Церебролизина имеет уровень доказательности В[12].
Церебролизин представляет собой комплекс нейропептидов с молекулярной массой не более 10 000 Да (15%), свободных аминокислот (85%) и микроэлементов. Углубленные исследования безопасности препарата с использованием иммуноблоттинга и электронной микроскопии не выявили в Церебролизине функционально активных проонкогенов, нуклеиновых кислот и белковых соединений класса амилоидов, в том числе прионов[13].
Механизм действия Церебролизина связан со способностью активировать эндогенные защитные механизмы, основными составляющими которых являются нейротрофичность, нейропротекция, нейропластичность и нейрогенез[23, 24]. Нейротрофическое действие обеспечивает координацию процессов нейропротекции, нейропластичности и нейрогенеза на оптимальном уровне[23, 24]. В различных исследованиях показана структурная и функциональная эквивалентность нейропептидов Церебролизина и нейротрофических факторов. По имеющимся данным, препарат способен увеличивать связывание собственного нейротрофического фактора мозга (brain-derived neurotrophic factor — BDNF) к TrkB-рецепторам[18], активировать секрецию собственного BDNF[15], а также модулировать соотношение про- и зрелых собственных нейротрофинов, что прямо свидетельствует о нейротрофической модуляции[33]. Нейропротективное действие Церебролизина проявляется в снижении глутаматной эксайтотоксичности[19, 20], инактивации образования свободных радикалов[17, 31], подавлении воспалительного ответа[16, 22], уменьшении отека[30] и торможении процессов апоптоза и некроза[19–21, 29, 35, 36]. Церебролизин способен модулировать нейропластичность, оптимизировать нейрональные соединения в мозге, способствуя отрастанию поврежденных отростков нейронов и увеличению плотности синапсов и поддерживая тем самым способность мозга адаптироваться к изменениям среды[23, 25, 26, 28, 34].
Свой вклад в активацию процессов нейропротекции и нейрорегенерации также вносят входящие в состав Церебролизина аминокислоты. Они обладают детоксицирующим действием, способны активировать белковый синтез, восстанавливать медиаторный баланс с нормализацией синтеза аденозина, таурина, глицина[4]. Присутствие аденозина обеспечивает пул пуриновых и пиримидиновых оснований, необходимых для синтеза антиапоптозных белков. Микроэлементы, содержащиеся в препарате, являются каталитическими центрами синтеза всех нейропептидов головного мозга[3]. Под воздействием Церебролизина происходит активация нейрогенеза — процесса формирования нейронов и клеток глии из клеток-предшественников. Показано, что препарат способен стимулировать нейро- и ангиогенез в субвентрикулярной зоне боковых желудочков и в зубчатой извилине гиппокампа как у здоровых животных, так и на моделях патологии[23, 27, 32, 36, 37].
Цель работы: исследование эффективности применения полипептидного препарата Церебролизин в амбулаторных условиях у детей 3–7 лет, страдающих речевыми нарушениями, и анализ изменений церебральной гемодинамики на фоне лечения.
МАТЕРИАЛЫ И МЕТОДЫ
Для проведения исследования за период 2013–2014 годов из осмотренных 578 детей от 3 до 7 лет были отобраны 84 ребенка с речевыми нарушениями, что составило 14,5% от общего числа детей, прошедших осмотр.
Согласно логопедической классификации общее недоразвитие речи второго уровня выявлено у 10 из 84 человек (11,9%). У этих пациентов имеют место выраженные нарушения звукопроизношения, грубые нарушения грамматической и лексической сторон речи. Речевые расстройства сочетаются с неврологическими и психопатологическими симптомами и синдромами. Часто выявляются синдромы ликворно-венозной дистензии, синдромы двигательных расстройств. В психических процессах отмечается снижение познавательной деятельности — ослабление внимания, памяти, праксиса, гнозиса. Дети этой группы испытывают затруднения при обучении[7].
Общее недоразвитие речи третьего уровня было выявлено у 74 детей (88,1%). Для пациентов данной категории характерны менее выраженные нарушения звукопроизношения, незначительные аграмматизмы, бедность словарного запаса. В психическом облике этих детей имеет место эмоционально-волевая незрелость[7].
Среди обследованных детей преобладали мальчики: мальчиков было 53 (63%), девочек — 31 (37%); соотношение мальчиков и девочек — 1 : 1,7. У 65 детей (77%) имелись СДВГ, астенический синдром, эмоционально-волевые нарушения, недифференцированность движений пальцев рук и артикуляционных движений. Пациентов рандомизировали и относили к контрольной (первой) или основной (второй) группе методом случайных чисел, численность детей в первой и второй группах составила 41 и 43 ребенка соответственно. В первой группе проводили занятия с логопедом. Пациенты второй группы, помимо занятий с логопедом, получали внутримышечно инъекции Церебролизина. Стандартный курс препарата составлял 15 инъекций в утренние часы через день с постепенным наращиванием дозы от 0,1 мл/сут до 0,1–0,2 мл/кг/сут за 5 инъекций.
Контроль эффективности лечения осуществлялся путем изучения динамики неврологического и логопедического статусов, оценки тонкой моторики с помощью теста Лесны на диспраксию-дисгнозию[8]. Всем детям было проведено транскраниальное дуплексное сканирование (ТДС) на аппаратах Philips HD3 (датчики C 4–2, C 5–2) и «Унисон-2-03» (датчики СА 621, PA 230) до назначения лечения и спустя один месяц (по окончании курса). При интерпретации данных использованы оценочные таблицы Национального руководства по лучевой диагностике и терапии[9].
Проверка статистических гипотез о равенстве частот улучшения показателей речевого развития, а также патологических ультразвуковых паттернов, оцененных с помощью ТДС, в выделенных группах проводилась с использованием двустороннего точного критерия Фишера (F-критерий) и критерия Хи-квадрат (χ2) с поправкой Йетса. Достоверность различия по критерию Фишера и χ2 применяли для анализа различий частот выявления бинарного признака в группе контроля и опытной группе после лечения.
РЕЗУЛЬТАТЫ
В результате лечения показатели речевого развития улучшились у детей обеих групп: по окончании курса были отмечены коррекция звукопроизношения и автоматизация звуков, расширился словарный запас, улучшились лексика и грамматика, повысилось речевое внимание. На фоне лечения Церебролизином показатели речевого развития улучшились у 39 детей из 43, или у 90,7%, тогда как в группе сравнения аналогичный показатель составил 46,3% — 19 пациентов из 41 (χ2 = 17,302; р < 0,01).
Помимо этого, на фоне применения Церебролизина компенсировались неврологические нарушения. В группе детей, которые получали Церебролизин, количество выполненных заданий по мелкой моторике увеличилось на 23%, а в группе сравнения — на 11%. Редукция клинических признаков СДВГ у детей, получавших Церебролизин, также происходила более быстрыми темпами. Пациенты без медикаментозного лечения сохраняли неврологическую симптоматику.
Таким образом, характеризуя динамику неврологического и логопедического статусов у детей двух групп во время исследования, необходимо отметить, что пациенты, в план лечения которых входил Церебролизин, показывали более высокие результаты в отношении восстановления речевой функции (звукопроизношение, лексика, грамматика) и компенсации неврологической симптоматики.
С помощью метода ТДС пациенты исследовались на наличие патологических ультразвуковых признаков: мозаичной асимметрии индекса резистентности (resistance index — RI); внутрибассейновой асимметрии; диффузного повышения RI; снижения линейных скоростей кровотока в каротидном бассейне; снижения линейных скоростей кровотока в вертебробазилярном бассейне; асимметрии кровотока; измененной цереброваскулярной реактивности (вазодилататорный и вазоконстрикторный тесты); повышения скорости венозного оттока по базальным венам, вене Галена; увеличения ширины третьего желудочка, глубины залегания затылочных рогов боковых желудочков. При повторном обследовании в основной группе было выявлено значительное снижение количества больных, у которых встречались данные признаки (табл.). Все выявленные ультразвуковые характеристики нозологически неспецифичны, т. е. не позволяют поставить диагноз, но они дают возможность выявить детей, у которых отклонения в развитии речевой функции возникли на фоне морфологических нарушений головного мозга, нарушений кровотока.
Таблица
Динамика частоты выявления патологических ультразвуковых паттернов у детей 3–7 лет с речевыми расстройствами в исследуемых группах
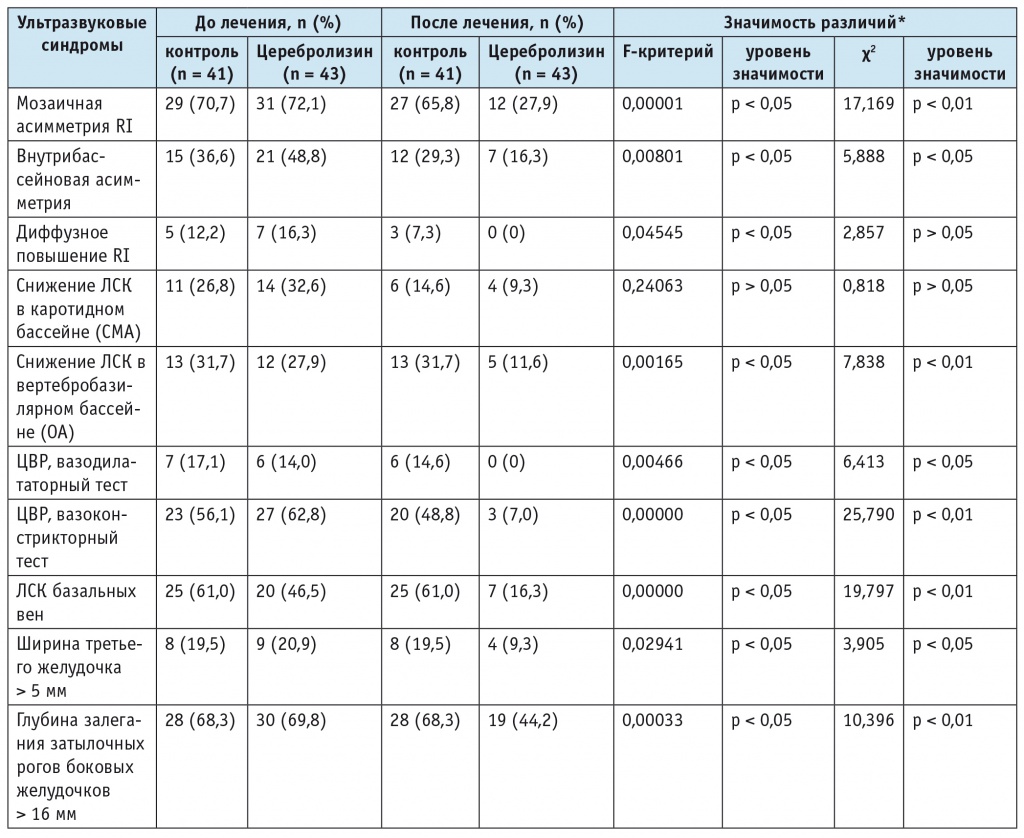
Примечание. ЛСК — линейная скорость кровотока; ОА — основная артерия; СМА — средняя мозговая артерия; ЦВР — цереброваскулярная реактивность; RI — индекс резистентности.
* Показана значимость различий между частотами выявления признаков в группе контроля и опытной группе после лечения.
Кроме того, одним из универсальных факторов, лимитирующих диапазон возможных реакций организма на любой предъявляемый раздражитель, является способность потреблять и утилизировать кислород. В целом возможность организма изменять уровень потребления кислорода в зависимости от меняющихся условий — это основной фактор, определяющий реабилитационный потенциал пациента. Клиническая оценка эффективности обмена кислорода проводится с помощью пробы на цереброваскулярную реактивность. Значимое улучшение неврологического и логопедического статусов в группе пациентов, получавших Церебролизин, сочеталось с восстановлением цереброваскулярной реактивности, а также с нормализацией индексов сосудистого сопротивления, симметрии кровотока и оттока крови по системе глубоких вен мозга. Нейротрофический эффект Церебролизина проявлялся в ослаблении признаков церебральной атрофии в виде уменьшения ширины увеличенного третьего желудочка и уменьшения глубины залегания затылочных рогов боковых желудочков.
Проведение инструментального обследование до и после лечения наглядно демонстрирует, что улучшение неврологического и логопедического статуса проходит на фоне положительной динамики церебральной гемодинамики. Применение Церебролизина приводит к нормализации сосудистого сопротивления, цереброваскулярной реактивности и восстановлению внутрибассейновой симметрии кровотока. Значимого влияния на линейные скорости кровотока Церебролизин не оказывал. Вклад в улучшение церебральной гемодинамики может вносить ранее показанная способность Церебролизина влиять на гемореологические и морфоденсиметрические показатели крови: снижение агрегации тромбоцитов (на 20–25%) и эритроцитов (более чем на 25–30%); нормализация размеров агрегатов тромбоцитов, эритроцитов; повышение деформируемости эритроцитов; сдвиг субпопуляционного состава эритроцитов в сторону нормальных форм; нормализация интегрального показателя кривизны мембраны и индекса спикулярности эритроцитов[1].
ЗАКЛЮЧЕНИЕ
В проведенном исследовании показана возможность эффективного амбулаторного лечения пациентов с нарушением речевой функции за счет добавления к комплексу логопедических упражнений курса препарата Церебролизин. Применение Церебролизина способствует регрессу неврологической симптоматики, ускоряет темпы речевого развития и повышает качество речи. Положительная динамика неврологических и логопедических нарушений повышает мотивацию и способствует росту приверженности к лечению пациентов и их родителей. Компенсация неврологических нарушений и улучшение показателей речевого развития коррелируют с улучшением гемодинамических показателей мозгового кровообращения. Исследование динамики патологических ультразвуковых паттернов с помощью метода транскраниального дуплексного сканирования может быть использовано в целях инструментального контроля ведения пациентов с нарушением речевой функции.








