Приблизительно 300 млн человек в мире имеют диагноз бронхиальной астмы (БА) [1]. При этом заболеваемость продолжает возрастать, и к 2025 году ожидается увеличение популяции больных БА еще на 100 млн человек [1, 2]. Распространенность в разных возрастных группах, прогрессирующее повышение заболеваемости и затрат на лечение приводят к увеличению бремени этой болезни как для бюджета здравоохранения, так и для общества и самих пациентов, что делает БА значительной медицинской и социальной проблемой [1-3]. При современном уровне доказательной медицины системный подход к проблеме БА возможен только на основе междисциплинарных исследований на стыке различных областей знания — пульмонологии, психиатрии, физиологии, психофизиологии, нейропсихологии, социологии. В этом направлении нужен определенный научный и практический прорыв, который позволит нам приблизиться к разработке необходимых при БА методов персонализированной медицины.
БА многие годы трактовалась как одна из классических психосоматических болезней. Не углубляясь в историю вопроса о трансформации самого понятия «психосоматические болезни» и прежних трактовок в этом аспекте БА, можно констатировать, что, согласно современным представлениям, БА является самостоятельной нозологической формой. БА — хроническое воспалительное заболевание дыхательных путей, характеризующееся обратимой бронхиальной обструкцией и гиперреактивностью бронхов.
Возникновение и прогрессирование БА может служить примером сложных психосоматических и соматопсихических взаимоотношений и взаимосвязей [4]. В подавляющем большинстве случаев на всех этапах развития БА в той или иной мере отмечается наличие психопатологических расстройств аффективного спектра, чаще тревожно-депрессивного комплекса. Степень выраженности психопатологических включений в основную клиническую картину заболевания создает дополнительные трудности в лечении больных БА. Одним из подходов к объективной оценке дезорганизации функционального состояния корковой мозаики ЦНС является анализ электрической активности мозга, особенно основного ритма ЭЭГ — альфа-активности [5, 6].
Многочисленные исследования показали, что развитие депрессивных состояний сопровождается нарушениями структуры всех частотных диапазонов ЭЭГ, но в большей степени изменения касаются основного ритма ЭЭГ — альфа-ритма [7-10]. Альфа-ритм — ритмические колебания с частотой 8-13 Гц и средней амплитудой 30-70 мкВ, регистрируется преимущественно в затылочных областях при закрытых глазах в состоянии спокойного бодрствования и максимально возможном расслаблении мышц. Ритм блокируется световой стимуляцией, концентрацией внимания и умственными нагрузками.
Альфа-диапазон при депрессиях может значительно усиливаться или редуцироваться, меняется пространственное распределение ритма [8, 11-13]. По современным представлениям, генерация альфа-ритма связана с реверберацией импульсной активности по интеркортикальным и таламо-кортикальными нейронным сетям, а выраженность его обусловливает синхронизацию функциональной активности различных мозговых систем, в частности определяет связь получаемой от афферентной системы организма информации с механизмами оперативной памяти, регулируя адаптационные процессы.
Поэтому альфа-диапазон ЭЭГ традиционно привлекает повышенное внимание исследователей благодаря его высокой чувствительности к разнообразным внешним воздействиям и тонким изменениям функционального состояния коры мозга, сопровождающим сенсорные, моторные, когнитивные и мнестические процессы [14, 15].
Характер изменений альфа-активности при депрессивных расстройствах зависит в первую очередь от особенностей депрессивного синдрома. Так, повышение индекса альфа-ритма свойственно больным с «большой депрессией», а его снижение в десинхронизированном типе ЭЭГ выявляется при дистимических расстройствах, т. е. при депрессиях невротического уровня [16-18]. Рядом авторов предложена нейрофизиологическая модель депрессии, постулирующая изменение фронтальной асимметрии — снижение левополушарной активности [19-25]. Исследователи связывают особенности изменения альфа-активности с доминированием тоскливого, тревожного или апатического аффекта, подтверждая тем самым общепринятое положение о связи структуры ЭЭГ с функциональной активностью корковых зон. Наблюдаемые при этом особенности профиля вегетативной нервной системы позволяют предположить, что одним из механизмов перестройки корковой ритмики является дисфункция диэнцефальных подкорковых структур [26].
Цель исследования: провести сравнительный анализ параметров основного ритма ЭЭГ человека — альфа-ритма — у больных БА и здоровых людей.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании при условии добровольного информированного согласия участвовали 57 пациентов (38 женщин и 19 мужчин) с частично контролируемой БА легкой и средней тяжести и с расстройствами аффективного спектра. Диагноз БА устанавливался в соответствии с международными согласительными документами (Global Initiative for Asthma, 2017). Возраст пациентов варьировал от 18 до 65 лет (средний возраст — 53,7 ± 10,9 года). Группу контроля составили 50 практически здоровых лиц, сопоставимых по возрасту и полу.
Проводилось комплексное клинико-инструментальное обследование: функциональное исследование легких (спирометрия, функция внешнего дыхания), ЭЭГ. Для оценки и анализа психопатологических расстройств аффективного спектра использовалась клинико-психопатологическая карта, разработанная В.Н. Красновым [27]; шкалы Гамильтона для оценки тревоги и депрессии; тест-контроль БА.
Общей психопатологической характеристикой обследованных больных БА была гипотимия с тревожным компонентом, при этом прослеживалась тенденция трансформации тревоги в тревожно-тоскливое состояние. Количество баллов по шкале депрессии Гамильтона составило 13-17.
Литературные данные свидетельствуют о различных профилях нейрофизиологических показателей у правшей и левшей, поэтому по опроснику латеральных признаков [28] в группы испытуемых отбирались правши.
ЭЭГ регистрировали с помощью аппаратно-программного комплекса для топографического картирования электрической активности мозга «Нейро-КМ» (Россия) с полосой пропускания от 0,1 до 45 Гц. Запись ЭЭГ осуществляли монополярно от симметричных лобных (F3, F4), центральных (C3, C4), теменных (P3, P4), затылочных (О1, O2), передне-височных (F7, F8), средне-височных (T3, T4) и задне-височных (Т5, Т6) корковых зон (схема 10-20%, четные каналы отведения — от корковых зон правого полушария, нечетные — левого). Референсным электродом служили объединенные ушные клипсы. Характеристики и топографическое распределение ритмов ЭЭГ определяли с помощью анализа ЭЭГ методом быстрого преобразования Фурье с усреднением не менее 30 эпох по 2 секунды с последующим картированием по системе BRAINSYS (Россия).
Проводили спектральный и когерентный анализы ЭЭГ. Величину когерентности (КОГ) вычисляли между всеми 14 отведениями корковых областей в диапазоне 7-13 Гц, а также с шагом 1 Гц. Определяли и величину средней когерентности (СрКОГ) каждой области со всеми остальными корковыми зонами — показателя функциональной активности выбранной зоны в интегральной деятельности мозга. При межгрупповом сравнительном анализе спектральной мощности (СМ) ритмов использовали приведение показателей к нормализованному типу через логарифмирование (LnCM), а сравнение параметров КОГ проводилось по формуле:
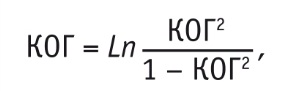
где КОГ2 — квадрат модуля КОГ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Данные визуального и спектрального анализов электроэнцефалограммы
Наиболее выраженные изменения фоновой ЭЭГ обследованных больных наблюдались в виде двух вариантов: низкоамплитудной дизритмии и усиления синхронизации в медленноволновых диапазонах. В первом случае отмечались снижение амплитуды биоэлектрической активности, редукция альфа-ритма, сглаженность регионарных различий по альфа-индексу, усиление диффузной низкоамплитудной медленноволновой активности. При втором варианте имели место билатеральные вспышки альфа- и тета-волн, возникающие синхронно во всех областях и указывающие на явления ирритации на уровне стволовых структур мозга. Характерной особенностью альфа-ритма стала слабая выраженность или полное отсутствие модуляции в веретёна.
Независимо от типа изменений ЭЭГ-картирование групповых спектральных характеристик ЭЭГ выявляло нарушения топики основного ритма — зональные различия по альфа-индексу были слабо выражены. Несмотря на то что в группу исследования включались только правши, фокус альфа-ритма у обследованных пациентов был нечетко обозначен в правой затылочной области, что характерно для нормы, а в отдельных случаях доминировал в затылочной области левого полушария, что указывало на более значительное снижение функциональной активности левого полушария.
При спектральном анализе ЭЭГ абсолютная СМ альфа-ритма у больных была ниже, чем у испытуемых контрольной группы, во всех отведениях ЭЭГ. Диффузное снижение СМ альфа-ритма приводило к тому, что при сопоставлении с остальными ритмами ЭЭГ СМ альфа-ритма не лидировала, а занимала позицию после СМ медленноволновых ритмов, чаще после тета-диапазона.
Изменение соотношений отдельных ритмов ЭЭГ у больных БА особенно наглядно можно проследить при анализе %СМ — составляющей доли в процентах альфа-ритма от совокупности СМ всех ритмов ЭЭГ в данной области коры.
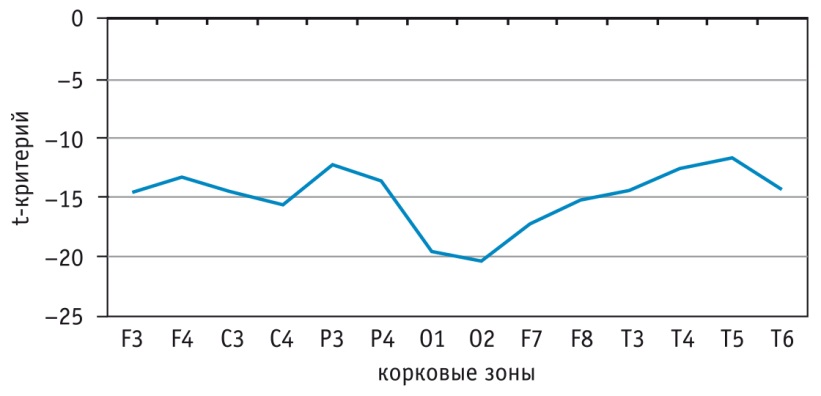
На рисунке 1 показана разность %СМ между показателями у больных и испытуемых контрольной группы. Во всех корковых зонах снижение %СМ альфа-ритма составляло более 12%. Наиболее значительная редукция (около 20%) — в затылочных областях с акцентом в правом полушарии, что и отражалось в нивелировании зональных различий корковых зон по выраженности альфа-индекса.
Рис. 1. Отличия %спектральной мощности альфа-ритма у больных бронхиальной астмой от нормы (p < 0,05 при модуле 1,7)
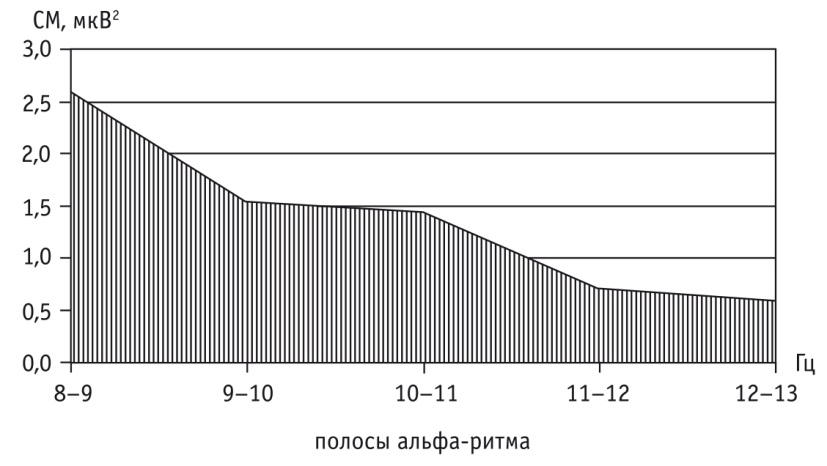
У больных отмечено смещение модального значения СМ ведущего ритма в более низкий частотный диапазон — 8-9 Гц (против 10 Гц у здоровых испытуемых), что отражает переход корковой ритмики на функционирование в более энергосберегающих режимах (рис. 2). Следующими по значению СМ в альфа-диапазоне являлись полосы 9-10 и 10-11 Гц, а самыми низкими — высокочастотные полосы 11-12 и 12-13 Гц. Средний показатель СМ по всем корковым зонам (СрСМ) высокочастотных составляющих альфа-ритма в 4 раза ниже СрСМ доминирующей частоты 8-9 Гц.
Рис. 2. Структура альфа-ритма — средние значения 1 Гц полос спектральной мощности (СМ) по всем отведениям
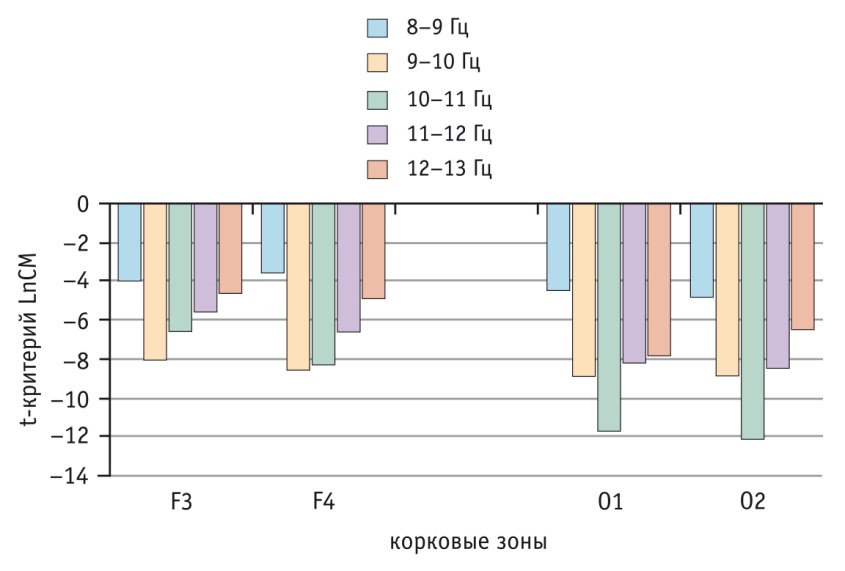
По сравнению с показателями контрольной группы (рис. 3) у больных БА полоса 8-9 Гц была снижена в меньшей степени, чем остальные. Наибольшая редукция полосы 10-11 Гц отмечалась в затылочных областях с небольшим акцентом в правом полушарии. В этих корковых зонах полосы 9-10, 11-12 и 12-13 Гц были уменьшены почти в равной мере. Во фронтальных корковых зонах закономерность иная — в большей степени редуцирована полоса 9-10 Гц, затем следуют полосы 10-11, 11-12 и 12-13 Гц. Эти данные указывают на значительную деформацию структуры основного ритма у больных. Генераторы альфа-ритма у пациентов работают в особом режиме, значительно отличающемся от нормы.
Рис. 3. Изменение структуры альфа-ритма у больных бронхиальной астмой по сравнению с нормой во фронтальных (F3 слева и F4 справа) и затылочных (О1 слева и О2 справа) областях коры (p < 0,05 при модуле 1,7)
Данные когерентного анализа электроэнцефалограммы
Наиболее низкие значения КОГ у больных БА выявлены в диапазонах длиннодистантных связей. Так, лобно-затылочные величины КОГ (О1-F3, О1-F4, О2-F4 и О2-F3) колебались в диапазоне 0,05-0,08. Короткодистантные связи имели существенно более высокие значения КОГ: затылочные области с теменными зонами (О1-Р3, О2-Р4) — 0,34 и 0,48, фронтальные области с близлежащими областями (F3-С3, F4-С4) — 0,75 и 0,74. Величина СрКОГ по альфа-диапазону у больных БА по сравнению с таковой у участников контрольной группы (рис. 4) по всем корковым зонам была значительно снижена (р < 0,05).
Рис. 4. Сравнение величины средней когерентности (СрКОГ) по альфа-диапазону у больных и испытуемых контрольной группы
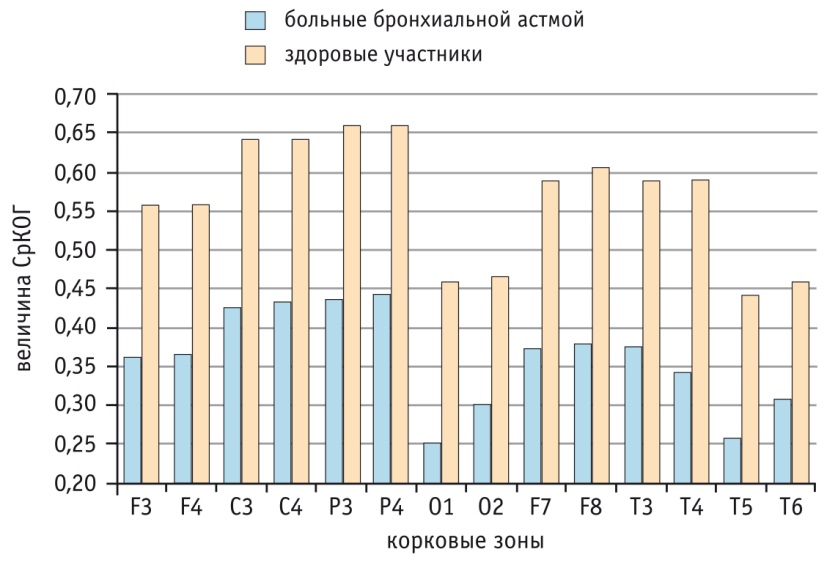
Во фронтальных, центральных и теменных зонах обоих полушарий уменьшение достигло полуторакратного размера, а в височных зонах — несколько меньшего. Самое большое различие СрКОГ по альфа-диапазону между нормой и больными выявлено в затылочных и задне-височных зонах, в частности в левой затылочной области — СрКОГ по альфа-диапазону у больных была почти в 2 раза ниже, чем у здоровых.
Полученные данные свидетельствуют о значительном диффузном ослаблении функциональных связей между всеми областями коры. Это касается и межполушарных связей, они уменьшены между всеми симметричными корковыми зонами по основному ритму, хотя и в разной степени. Так, между фронтальными зонами отличия от нормы менее выражены, чем между другими парами корковых областей. Особенно значительное уменьшение межполушарного взаимодействия отмечается между передне-, средне- и задне-височными зонами. Роль отдельных частотных полос альфа-ритма в связях между корковыми зонами неодинакова — основную роль играет низкочастотная полоса 8-9 Гц. Значения СрКОГ этой полосы наибольшие во фронтальных, теменно-центральных зонах, а также в височных зонах правого полушария. Следовательно, у больных БА перестройка структуры основного ритма в более замедленные режимы изменяет и снижает функциональную активность корковых зон.
Проведенное клинико-нейрофизиологическое исследование подтверждает наличие сопутствующих БА умеренных тревожно-депрессивных расстройств с тенденцией формирования тоскливого варианта аффективного спектра, на что может указывать усиление медленноволновой активности, преимущественно тета-диапазона.
ЗАКЛЮЧЕНИЕ
Исследование альфа-ритма ЭЭГ с применением спектрального и когерентного анализа позволило выявить у больных бронхиальной астмой (БА) особую мозаику пространственно-временных соотношений работы различных отделов коры и межкорковых взаимодействий. Это позволяет дифференцированно подходить к оценке функциональной активности различных корковых зон и их участия в интегративной деятельности мозга на основании спектральных и когерентных показателей альфа-диапазона. Данные показатели могут служить дополнительными характеристиками при диагностике и выборе терапевтических подходов у больных БА.








