Таблица 1
Когнитивные функции [1]

Более 35 миллионов человек во всем мире в настоящее время живут с деменцией [2]. Распространенность легких, а также умеренных (додементных) когнитивных расстройств (УКР) в разы превышает указанное значение, ее сложно оценить из-за недостаточной диагностики и низкой обращаемости к врачу по поводу данной проблемы. Возраст считается главным фактором риска возникновения когнитивных расстройств: к 65 годам распространенность УКР в популяции достигает 12–15%, с каждым следующим годом она увеличивается на 1% [3]. В связи с общим старением населения Земли прогнозируется, что каждые 20 лет количество больных деменцией будет удваиваться [2].
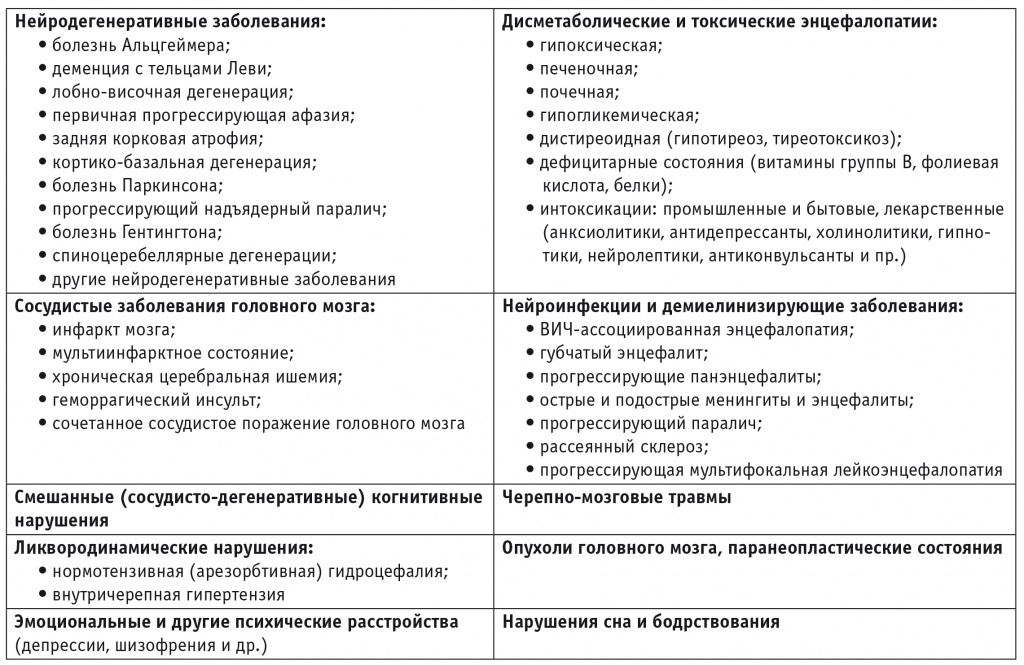
Широкая представленность когнитивных расстройств связана также с множественной этиологией: насчитывается более 100 причин их возникновения (табл. 2), среди них наиболее распространенными являются нейродегенеративные и цереброваскулярные заболевания [4].
Таблица 2
Основные причины когнитивных нарушений [4]
В большинстве случаев когнитивные нарушения нарастают постепенно, какое-то время не снижают социальной и бытовой адаптации человека и не сразу замечаются пациентом и его окружением. Такие нарушения выделяются в отдельный синдром УКР (табл. 3) [1]. Главным отличием УКР от деменции является наличие у пациента возможности независимого функционирования в быту и профессиональной сфере. Выделение УКР в отдельную нозологическую единицу имеет принципиальное значение, поскольку тактика лечения и прогноз при них отличаются от таковых при деменции.
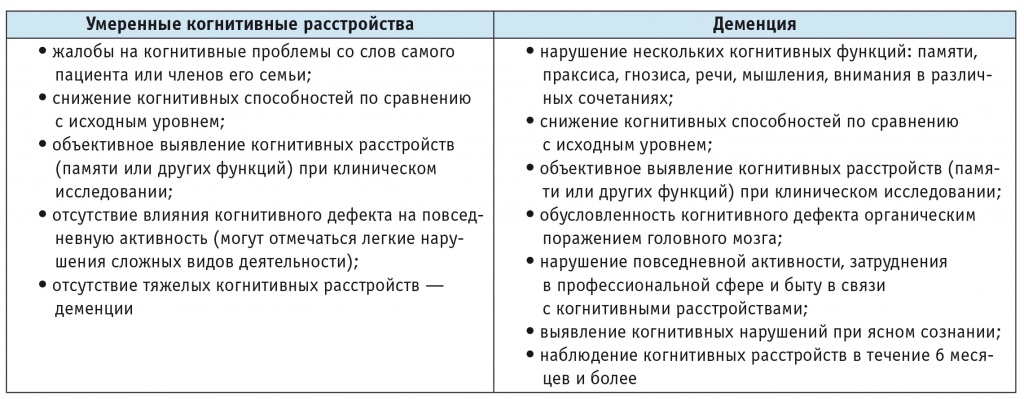
Таблица 3
Основные критерии диагностики умеренных когнитивных расстройств и деменции [1]
Чаще всего когнитивные нарушения, достигшие степени деменции, необратимы: только около 5% случаев деменции регрессируют при своевременном обнаружении и терапии [1]. Основными причинами обратимых когнитивных расстройств являются соматические заболевания (печеночная, уремическая энцефалопатия, эндокринная патология, дефицитарные состояния, алкоголизм, инфекции и пр.). Эти заболевания, многие из которых встречаются прежде всего в практике врача-терапевта, требуют особого внимания в плане своевременной диагностики и предупреждения развития необратимых повреждений головного мозга.
Прогноз УКР менее однозначен: у 5–15% пациентов с УКР в течение года развивается деменция, треть из них умирают в течение шести последующих лет (чаще всего от сопутствующей соматической, прежде всего сердечно-сосудистой, патологии), однако у 20% пациентов с УКР при последующем наблюдении отмечается улучшение когнитивных функций [5]. Диагностика когнитивных расстройств на ранних стадиях позволяет своевременно начать адекватную терапию и тем самым продлить активную жизнь пациента [6].
В настоящее время не существует способа предотвратить или затормозить развитие нейродегенерации, в том числе наиболее распространенной причины деменции — болезни Альцгеймера (БА), — который имел бы доказанную эффективность. Большие надежды возлагаются на коррекцию сосудистых факторов риска и профилактику развития сосудистых когнитивных нарушений. Особое значение придается контролю артериальной гипертензии: установлена статистически значимая взаимосвязь между исходно высокими цифрами систолического давления (180 мм рт. ст. и выше) и развитием тяжелых когнитивных расстройств; с каждым повышением системного артериального давления на 10 мм рт. ст. риск развития когнитивных нарушений возрастает на 7–16%; выраженность когнитивных расстройств зависит от наличия адекватной и постоянной гипотензивной терапии [7]. Надо отметить, что сосудистые факторы риска, такие как гипертоническая болезнь сердца, нарушения сердечного ритма, гиперлипидемия, ожирение, сахарный диабет и пр., провоцируют развитие когнитивных расстройств не только сосудистого, но и нейродегенеративного характера.
Основная цель терапии когнитивных расстройств на сегодняшний день состоит в том, чтобы как можно дольше поддерживать бытовую независимость пациента и отсрочить полную инвалидизацию.
К общим принципам терапии УКР и деменции относятся:
- отмена или минимизация доз средств, ухудшающих когнитивные функции (седативных препаратов, холинолитиков и пр.);
- коррекция сопутствующих заболеваний и факторов риска (сосудистых, аффективных, дисметаболических и других нарушений);
- нейропсихологическая реабилитация, т. е. создание когнитивного резерва, когнитивный тренинг (умственная и физическая активность, социальные контакты, эмоциональная жизнь);
- выбор препарата, улучшающего когнитивные функции;
- длительная терапия с обязательной оценкой ее эффективности.
Таблица 4
Препараты (группы препаратов), применяемые для терапии когнитивных нарушений
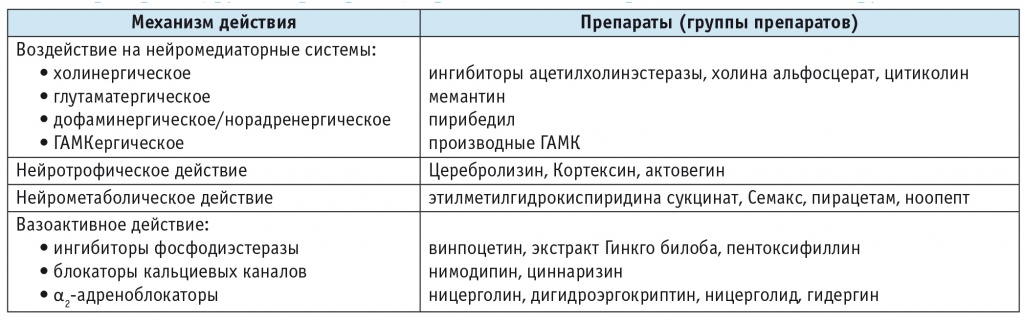
Фармакотерапия деменций основывается на применении двух групп препаратов с доказанной клинической эффективностью: ингибиторов ацетилхолинэстеразы (АХЭ) и антагонистов NMDA-рецепторов к глутамату. Поскольку дисбаланс холинергической системы и феномен эксайтотоксичности (разрушение нервных клеток в результате сверхраздражения) характерны для разных деменций, препараты данных групп широко используются в клинической практике как в виде монотерапии, так и в комбинации. При наличии клинического эффекта и отсутствии противопоказаний лечение проводится пожизненно.
Препараты, модулирующие глутаматергическую передачу, считаются перспективными в плане коррекции когнитивных нарушений различной степени тяжести и этиологии, поскольку патологические механизмы с дисрегуляцией глутамата постоянно участвуют в развитии наиболее частых форм деменции — нейродегенеративной, сосудистой и смешанной.
Глутамат — один из основных возбуждающих медиаторов головного мозга, особенно широко представленный в коре и гиппокампе (областях, непосредственно связанных с когнитивными функциями). Дисрегуляция с локальным повышением концентрации глутамата производит нейротоксический эффект. Накопление глутамата в синапсах связано с нарушением его обратного захвата пресинаптическими нейронами и/или глиальными клетками. Повышенный уровень медиатора приводит к росту постоянной фоновой активации нейронов — так называемого фонового шума (рис. 1А), — что мешает распознавать физиологически нужные сигналы и нарушает когнитивные процессы. Аномальное накопление глутамата в синапсах ведет к постоянной стимуляции NMDA-рецепторов и хронической деполяризации мембраны с избыточным поступлением кальция в клетку, тем самым запускается каскад патологических реакций (рис. 2), заканчивающихся гибелью клетки (феномен эксайтотоксичности) [8].
Рис. 1. Глутаматопосредованная нейропередача в норме (А) и при патологии (при избытке глутамата) с защитным действием мемантина (Б)
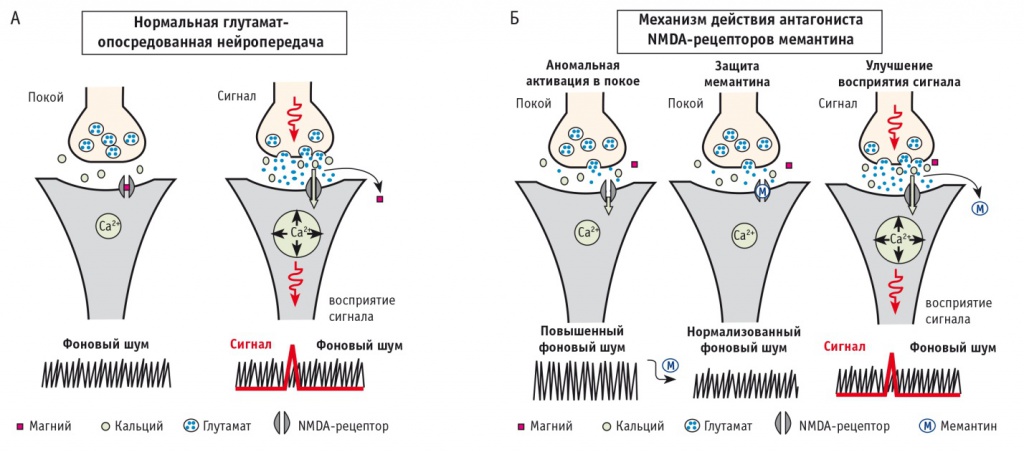
Рис. 2. Механизмы глутаматопосредованной эксайтотоксичности [8]
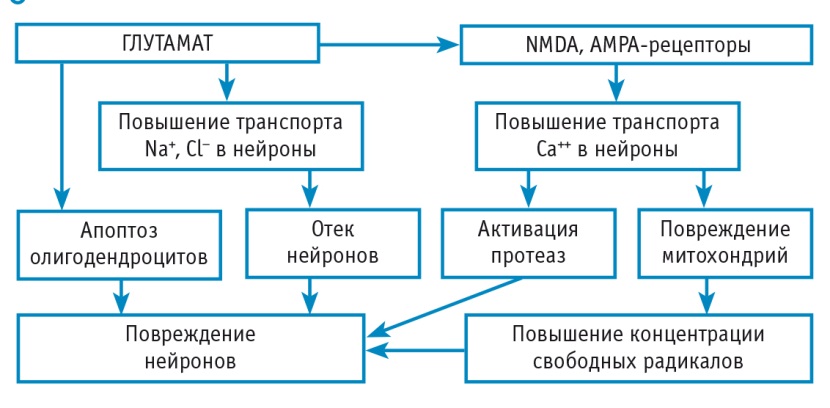
Избыточная стимуляция NMDA-рецепторов особенно вредна в условиях энергодефицита в клетке, например при ишемии. Известно, что активирующая активность L-глутамата играет значимую роль в патогенезе БА и ишемического повреждения при инсульте.
Предотвратить нейротоксическое действие возбуждающих аминокислот возможно с помощью антагонистов NMDA-рецепторов, при этом препарат должен обладать невысокой аффинностью, которая позволит действовать без вмешательства в физиологические эффекты глутамата, необходимые для осуществления процессов памяти и обучения [9].
Мемантин является неконкурентным потенциалзависимым антагонистом NMDA-рецепторов с низкой и средней аффинностью. Он связывается преимущественно с открытыми кальциевыми каналами (рис. 1Б), управляемыми NMDA-рецепторами, в состоянии покоя [10, 11] и блокирует поток ионов, уменьшая негативное влияние патологически повышенного уровня глутамата [12]. При полной деполяризации мембраны мемантин удаляется из канала, что обеспечивает нормальную синаптическую передачу. Соотношение сигнала и шумового фона при этом восстанавливается [5]. Таким образом, мемантин может препятствовать гибели клетки, т. е. оказывать нейропротекторное действие.
Доклинические исследования мемантина на клеточных культурах продемонстрировали следующие нейропротекторные свойства:
- предотвращение гибели корковых, гиппокампальных, мезэнцефальных и мозжечковых нейронов, вызываемой токсическим действием глутамата (показано на культурах);
- защита холинергических нейронов от повреждения, связанного с эксайтотоксическим эффектом, действием β-амилоида, митохондриальной дисфункцией и нейровоспалительным процессом;
- уменьшение аномального гиперфосфорилирования τ-протеина и препятствие образованию нейрофибриллярных клубочков, характерных для БА [13].
Часть из этих работ вошла в метаанализ Кокрейна (12 рандомизированных контролируемых исследований, 2006 г.) [14], который показал превосходство мемантина над плацебо при терапии БА от легкой до умеренной и от умеренной до тяжелой степени тяжести (использовалась шкала для оценки нарушений при болезни Альцгеймера — когнитивная подшкала, англ. Alzheimerʹs Disease Assessment Scale — cognitive subscale, ADAS-cog [15]). При этом клинический эффект при сосудистой деменции существенно не отличался от такового при плацебо.
В 2015 г. был проведен метаанализ, включивший более новые исследования эффективности и безопасности монотерапии мемантином при БА [16]. В него вошли 9 рандомизированных плацебо-контролируемых исследований с участием 2433 пациентов (табл. 5) [17–25]. На основании статистически значимых данных было установлено, что мемантин:
- замедляет прогрессирующее снижение когнитивных возможностей (в том числе внимания, узнавания, речи, зрительно-пространственных функций);
- снижает степень выраженности деменции;
- повышает повседневную активность пациентов;
- улучшает общее состояние больных;
- эффективен в отношении поведенческих нарушений (уменьшает выраженность и частоту возникновения ажитации, агрессии, психозов);
- обладает хорошей переносимостью (процент отказа от лечения, количество и выраженность нежелательных явлений при применении мемантина сопоставимы с результатами в группах плацебо).
Таблица 5
Исследования эффективности и безопасности монотерапии мемантином (20 мг/день) при болезни Альцгеймера
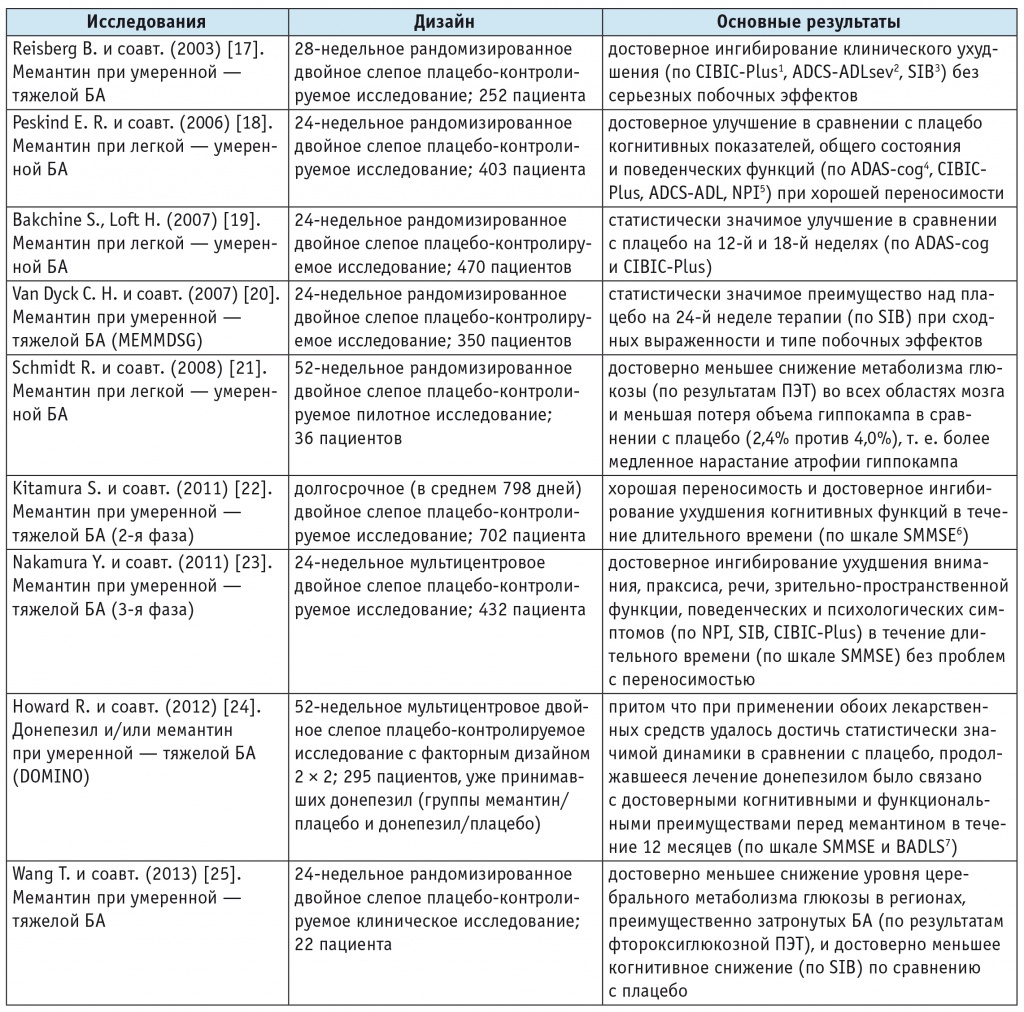
1 Clinician`s Interview-Based Impression of Change Plus Caregiver Input — шкала для оценки клиницистом и опекуном динамики состояния больного.
2 Alzheimer`s Disease Cooperative Study — Activities of Daily Living inventory modified for severe dementia — шкала для оценки повседневной активности при болезни Альцгеймера, модифицированная для тяжелой деменции.
3 Severe Impairment Battery — шкала для оценки тяжести нарушений.
4 Alzheimer`s Disease Assessment Scale — cognitive subscale — шкала для оценки нарушений при болезни Альцгеймера — когнитивная подшкала.
5 Neuropsychiatric Inventory — нейропсихиатрическое обследование.
6 Standardized Mini-Mental State Examination (SMMSE) — стандартизированная краткая шкала оценки психического статуса.
7 Bristol Activities of Daily Living Scale — Бристольская шкала оценки повседневной жизненной активности.
Примечание. БА — болезнь Альцгеймера; ПЭТ — позитронно-эмиссионная томография.
Эти данные согласуются с результатами множества работ, не вошедших в метаанализ [26–30]. Терапевтический эффект сохраняется длительное время — в долгосрочном исследовании средняя продолжительность лечения составляла 798 дней [22]. С клинической точки зрения выраженность положительного эффекта оказалась не слишком высокой. Тем не менее, поскольку механизм действия мемантина отличается от такового у ингибиторов АХЭ, ожидается, что он будет эффективен у пациентов со слабым действием ингибиторов АХЭ и расширит терапевтические возможности для пациентов с БА.
На основании проведенного анализа [16] сделан вывод о том, что мемантин можно эффективно использовать в качестве монотерапии БА, а также при отсутствии или неадекватном эффекте терапии ингибиторами АХЭ, при непереносимости последних и наличии противопоказаний к их назначению (например, при нарушении проводимости сердца или синдроме слабости синусового узла). В настоящее время препарат официально одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (англ. Food and Drug Administration, FDA) для лечения БА средней и тяжелой степени тяжести.
Наибольший опыт применения мемантина накоплен у пациентов с умеренной и тяжелой БА, однако ряд исследований свидетельствует о его эффективности на ранних стадиях [18, 19, 21], что открывает новые перспективы для применения препарата у пациентов с УКР.
Эффективность мемантина в терапии УКР активно изучается, исследования затрудняются гетерогенностью и вариабельностью течения данных расстройств. В ряде открытых клинических испытаний [31, 32] показана способность мемантина улучшать состояние когнитивных функций при УКР. По данным российских авторов, на фоне лечения мемантином у пациентов с УКР амнестического типа отмечается не только стабилизация когнитивной дисфункции, но и положительная динамика нейрохимического маркера нейродегенерации β-амилоида [32], что свидетельствует о возможности влияния при применении этого препарата на нейродегенеративные процессы. Необходимы дальнейшие исследования эффективности мемантина и его нейропротективных возможностей у пациентов с УКР. Вопрос о целесообразности назначения мемантина при УКР остается открытым и решается индивидуально для каждого пациента. При высоком риске конверсии УКР в деменцию применение мемантина может быть вполне оправданным [5].
Эффективность мемантина в терапии сосудистых когнитивных нарушений, как отмечено выше, не столь очевидна, как при БА. Исследований применения мемантина по данному показанию значительно меньше. Препарат был протестирован в двух плацебо-контролируемых исследованиях у пациентов с сосудистой деменцией при 28-недельном периоде лечения [33, 34]. В первом исследовании у 321 пациента лечение мемантином привело к лучшим по сравнению с плацебо показателям шкалы ADAS-cog (разница в 2,0 балла), но статистически значимых различий по шкале клинического впечатления (шкала для оценки клиницистом и опекуном динамики состояния больного, англ. Clinicianʹs Interview-Based Impression of Change Plus Caregiver Input, CIBIC-Plus) не обнаружилось (60% против 52%) [33]. Во втором исследовании у 579 пациентов лечение мемантином привело к лучшим, чем при применении плацебо, показателям ADAS-cog (разница в 1,8 балла, p < 0,001), но различий по шкале CIBIC-Plus опять-таки получено не было [34]. Результаты этих двух клинических исследований были объединены и подтверждены в рамках Кокрейновского метаанализа [14]. Надо отметить, что эффективность ингибиторов АХЭ при терапии сосудистых когнитивных нарушений также недостаточна и значительно ниже, чем при БА, что по сей день вызывает споры о целесообразности применения этих лекарственных средств при чисто сосудистой деменции [35].
Комбинированная терапия мемантином и ингибиторами АХЭ, по некоторым данным, дает максимально выраженный положительный эффект. Нежелательных взаимодействий между препаратами не возникает. Наоборот, в доклинических испытаниях показано, что антагонист NMDA-рецепторов и ингибиторы АХЭ действуют синергично, чем можно объяснить повышение их клинической эффективности, наблюдаемое при совместном применении [36, 37]. Обычно данная комбинация препаратов назначается при недостаточной эффективности монотерапии или снижении клинического эффекта в силу прогрессирования заболевания. При наблюдении с 1983 по 2004 г. за 943 пациентами с БА было показано, что добавление мемантина к терапии ингибиторами АХЭ изменяет клиническое течение болезни, значительно удлиняя период до госпитализации, т. е. дает возможность больному дольше оставаться дома. Пациенты, находившиеся на комбинированной терапии, демонстрировали более высокие когнитивные и функциональные возможности по сравнению с группой монотерапии, и сиделкам было проще за ними ухаживать. К сожалению, данных об увеличении продолжительности жизни при комбинированном лечении получено не было [38]. К таким же выводам пришли ученые в ряде коротких (от 12 до 24 месяцев) исследований [39, 40], однако требуется более длительное наблюдение, чтобы в полной мере оценить эффективность и перспективы комбинированного лечения. В настоящее время активно ведутся разработки новых молекул, сочетающих в себе антагонизм NMDA-рецепторов и усиление холинергической активности посредством ингибирования АХЭ [41].
Тактика назначения мемантина. В настоящее время практикуется однократный прием полной дозы мемантина, длительный период полужизни препарата позволяет следовать этой тактике без потери эффективности при высокой комплаентности и сохранении хорошей переносимости.
Титрация дозы мемантина стандартна:
- 1-я неделя — 5 мг (1 табл.) утром;
- 2-я неделя — 10 мг утром;
- 3-я неделя — 15 мг утром;
- 4-я неделя и далее постоянно — 20 мг утром.
Мемантин обычно хорошо переносится пациентами. Он более безопасен в использовании, чем препараты группы ингибиторов АХЭ, что подтверждено FDA на основе клинических данных с помощью статистической системы оценки неблагоприятных событий [42].
Мемантин не влияет на частоту сердечных сокращений, может применяться в терапевтических дозах у пациентов с заболеваниями почек, печени, редко вызывает желудочно-кишечные расстройства. Поскольку мемантин может оказывать легкое психостимулирующее действие, его не рекомендуется назначать на ночь [3].
ЗАКЛЮЧЕНИЕ
Когнитивные расстройства в настоящее время являются одной из наиболее распространенных и значимых проблем в неврологии. Количество пациентов с данной патологией растет из года в год, и они требуют максимально ранней диагностики и лечения, включающего применения нелекарственных методов и постоянной медикаментозной терапии.
Существуют различные подходы к ведению пациентов с умеренными когнитивными расстройствами и деменцией. Для деменций терапией выбора на сегодняшний день являются ингибиторы ацетилхолинэстеразы и антагонисты NMDA-рецепторов, в частности мемантин. Эффективность мемантина у пациентов с деменцией доказана в ходе множества доклинических и клинических исследований: он способен замедлять прогрессирующее снижение когнитивных возможностей и уменьшать степень его выраженности, улучшать общее состояние и повседневную активность пациентов, а также снижать частоту и выраженность поведенческих нарушений. Благодаря доказанной эффективности и хорошей переносимости мемантин рекомендуется для лечения деменций как в качестве монотерапии, так и в сочетании с препаратами группы ингибиторов ацетилхолинэстеразы.








