Этиология и эпидемиология обострений хронической обструктивной болезни легких
Во время обострения ХОБЛ нарастает легочная гиперинфляция, усиливаются обструкция малых дыхательных путей, воспаление дыхательных путей и системное воспаление (рис. 1) [4–9]. Более того, у пациентов с ХОБЛ более тяжелых стадий во время обострения более выражены локальный и системный воспалительный ответы, что указывает на роль тяжести ХОБЛ в стабильный период как предиктора тяжести ее обострений [8].
Рис. 1. Патогенез обострений хронической обструктивной болезни легких [9]
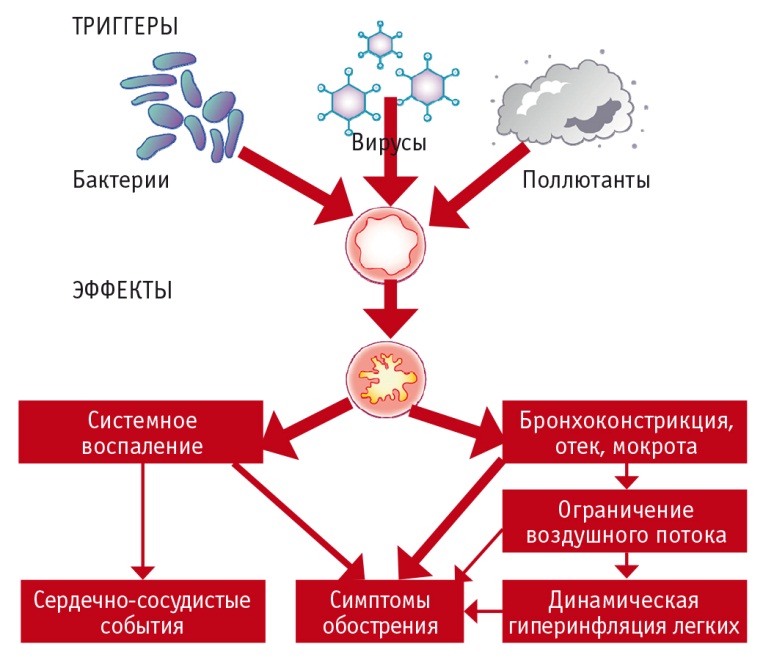
Обострения ХОБЛ — события гетерогенной природы, вызванные комплексными воздействиями на организм больного пневмотропных вирусов, бактерий и внешних загрязняющих веществ, которые приводят к усилению воспалительной реакции (см. рис. 1) [9]. В целом вирусные и бактериальные инфекции служат наиболее частыми триггерами обострений ХОБЛ [10–12]. Действуя одновременно, пневмотропные вирусы и бактерии часто обеспечивают синергичные эффекты во время обострений [8, 9]. Коинфекции вирусов и бактерий обнаруживают при 25% всех обострений, и для таких случаев характерны наиболее тяжелые функциональные нарушения и длительная госпитализация пациентов [13]. Приблизительно в трети случаев причины обострений выявить не удается [10].
Обычно по мере усиления тяжести заболевания частота обострений ХОБЛ увеличивается, но можно выделить группу больных с частыми обострениями вне зависимости от стадии ХОБЛ [3]. Действительно, согласно результатам наблюдения за пациентами с ХОБЛ на протяжении нескольких лет, частые обострения в анамнезе служат наилучшим предиктором будущих обострений [3, 14, 15]. Кроме того, получены доказательства, что перенесенное обострение повышает восприимчивость пациента с ХОБЛ к развитию последующего обострения, т. е. обнаружена тенденция к группировке обострений во временны́е кластеры [16, 17]. Наиболее опасное время для развития повторного нового обострения (или рецидива) — первые 8 недель после начального обострения [16, 17].
Невзирая на связь обострений ХОБЛ с усилением выраженности симптомов и снижением качества жизни пациентов, до 50% всех обострений остаются «нерепортируемыми», т. е. больные во время этих обострений не обращаются за медицинской помощью [15, 18]. Данный факт может отражать привычку пациентов к колебаниям выраженности симптомов по мере прогрессирования заболевания [15]. Выявление и обучение больных, которые запаздывают с обращением за помощью или не обращаются вовсе по поводу обострений, может улучшить их обращаемость, что в свою очередь поможет уменьшить болезненность и значительно снизить затраты здравоохранения на ведение больных с тяжелыми обострениями в стационарах [19].
Патофизиология обострений хронической обструктивной болезни легких
Механизмы развития обострений ХОБЛ до конца не изучены, но одним из наиболее важных звеньев их патогенеза следует признать усиленный воспалительный ответ в дыхательных путях [5, 8, 13]. Усиление воспаления дыхательных путей во время обострения ХОБЛ приводит к ухудшению легочной гиперинфляции, росту дисбаланса вентиляции и перфузии, нарастанию одышки, а в случае тяжелой ХОБЛ — также гипоксемии и гиперкапнии [20].
Кроме того, предположительно, повышение локальной экспрессии провоспалительных цитокинов в межреберных мышцах вносит свой вклад в развитие дисфункции дыхательных мышц [21], что в свою очередь приводит к усилению вентиляционного запроса. При прогрессировании ХОБЛ в слизистой оболочке дыхательных путей отмечено повышение числа клеточных элементов, в частности CD8+ лимфоцитов, макрофагов и нейтрофилов [22]. Во время обострения такой воспалительный паттерн меняется на преимущественно нейтрофильное воспаление [7, 13].
Более того, воспалительный ответ при обострении ХОБЛ модулируется природой инфекционного триггера: как подчеркнуто выше, вируснобактериальная ассоциация приводит к наиболее выраженному усилению воспаления и тяжести обострений [19, 23]. Как правило, во время обострений ХОБЛ значительно повышается число нейтрофилов в мокроте и периферической крови, что характерно для обострений любой тяжести, независимо от их причины [13]. Несмотря на то что традиционно обострение ХОБЛ рассматривают как преимущественно нейтрофильный воспалительный ответ, у многих пациентов с ХОБЛ большое значение имеет и эозинофильное воспаление [24, 25].
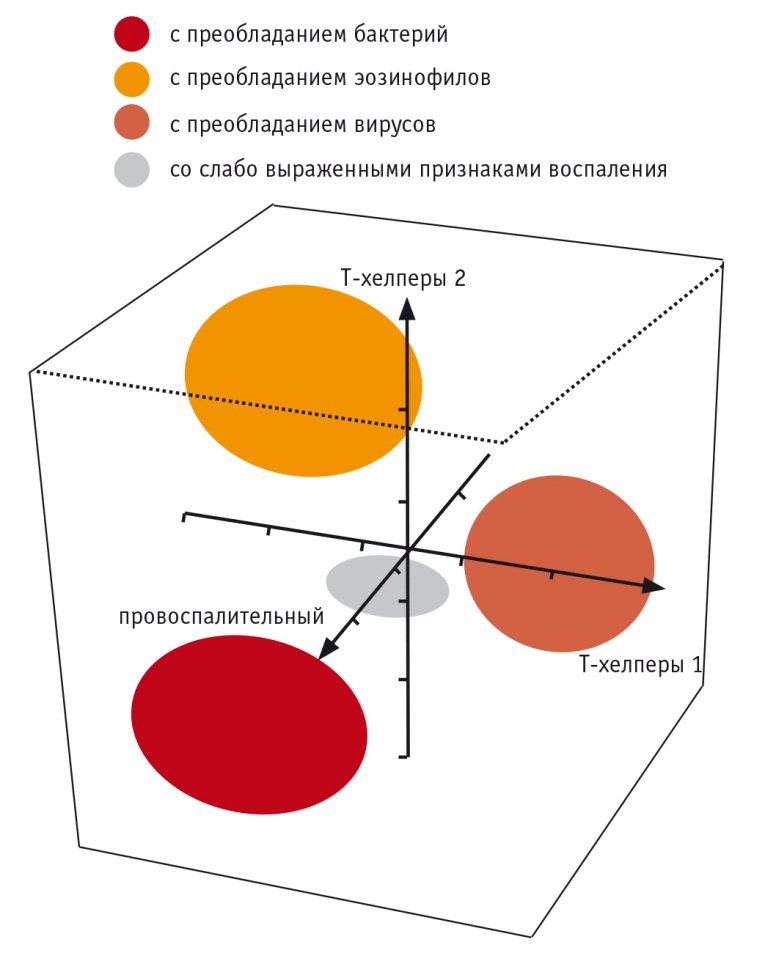
В исследовании M. Bafadhel и соавт., включавшем 145 пациентов, определены 4 биологических фенотипа обострений ХОБЛ, почти не отличающихся клинически, но дифференцируемых по некоторым высокочувствительным биомаркерам: обострения, ассоциированные с бактериями (35%), эозинофилией мокроты (24%), вирусами (34%), и «маловоспалительные обострения» (11%) (рис. 2) [26]. Наиболее чувствительным и специфичным маркером эозинофилии мокроты во время обострений была эозинофилия периферической крови (площадь под ROCкривой — 0,85) с пороговым значением 2% (чувствительность — 90%, специфичность — 60%).
Рис. 2. Биологические маркеры, ассоциированные с клиническими фенотипами обострений хронической обструктивной болезни легких [26]
Клинические последствия обострений
Тяжелые обострения ХОБЛ, требующие госпитализации больных, ассоциированы с высокой внутригоспитальной летальностью, по данным одного метаанализа, составляющей в среднем 6,7% [27]. Однако критический период риска летального исхода во время обострения превышает среднюю длительность госпитализации, и поэтому истинная летальность при тяжелых обострениях ХОБЛ достигает 15,6% [28]. Согласно результатам крупного проспективного когортного исследования S. Suissa и соавт., 50%ная выживаемость больных ХОБЛ после 1го тяжелого обострения составляет всего 3,6 года [28].
Обострения ХОБЛ (особенно частые) также ассоциированы с выраженным и долговременным снижением качества жизни, физической активности и физической выносливости, слабостью периферических скелетных мышц [29, 30]. S. Spencer и P. W. Jones показали, что после перенесенного обострения ХОБЛ качество жизни, оцениваемое с помощью опросника St. George’s Respiratory Questionnaire, восстанавливается лишь через 4 недели, а для полного возвращения к исходному качеству жизни необходимо до 6 месяцев [31].
Обострения ХОБЛ надолго снижают физическую выносливость: по данным C. G. Cote и соавт., в течение первых 2 лет после обострения у пациентов с ХОБЛ зафиксировано уменьшение дистанции в тесте с 6минутной ходьбой в среднем на 74 м [32].
Кроме того, в нескольких исследованиях продемонстрировано, что частые обострения ХОБЛ ухудшают легочную функцию [29, 33–35]. В исследовании TORCH за пациентами с ХОБЛ наблюдали в течение 3 лет и показали, что ежегодная скорость снижения ОФВ1 у лиц, переносивших одно среднетяжелое или тяжелое обострение в течение года, на 37% выше, чем у больных без обострений (p < 0,001), а среди пациентов с двумя и более обострениями в течение года — на 65% выше (p < 0,001) [36]. По сведениям G. C. Donaldson и соавт., частые обострения приводят к сокращению времени, которое пациент с ХОБЛ проводит вне дома (–0,16 часов в день в год; p < 0,001), т. е. снижению физической активности, а также к более быстрому падению ОФВ1 (p = 0,011) [37].
Определение обострений
Согласно определению руководства Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2017 г., «обострение ХОБЛ — острое ухудшение респираторных симптомов, требующее дополнительной терапии» [1]. Поскольку в разных клинических исследованиях определения обострений могут отличаться, то они обычно основаны на клинических проявлениях (тяжести симптомов) и/или на объеме использования ресурсов здравоохранения [38]. Например, в одном из самых крупных исследований ХОБЛ (UPLIFT) обострения определяли как появление/усиление как минимум одного из респираторных симптомов (кашля, количества мокроты, «гнойности» мокроты, свистящих хрипов или одышки) на протяжении ≥ 3 дней [39]. Как правило, среднетяжелыми обострениями считают события, требующие терапии системными глюкокортикоидами (ГК) и/или антибиотиками, а тяжелыми — события, требующие госпитализации пациентов [40, 41].
Невозможность прямого сравнения результатов разных клинических исследований обусловлена множеством обстоятельств, однако одним из наиболее важных препятствий служит отсутствие согласованного определения обострения ХОБЛ [38, 42]. По этой причине создан и валидирован вопросник Chronic Pulmonary DiseasePatient Reported Outcomes, включающий 14 пунктов, который предлагает стандартизированный подход к определению и репортированию обострений на основе симптомов [43].
Немедикаментозные стратегии профилактики обострений
Отказ от курения
Максимальный положительный эффект отказа от курения в замедлении прогрессирования ХОБЛ доказан. Как продемонстрировано в исследовании Lung Heath Study, 25% пациентов с ХОБЛ способны надолго отказаться от курения [44]. По данным исследования, проведенного среди больных ХОБЛ в системе госпиталей ветеранов США (с участием 23 497 человек), отказ от курения уменьшает риск обострений ХОБЛ (ОР = 0,78; 95%ный ДИ: 0,75–0,87), причем выраженность эффекта зависит от длительности периода без курения [45].
Согласно результатам оценки стоимости/эффективности антисмокинговых программ, интенсивные программы отказа от курения ассоциированы с более низким риском обострений (0,38 vs 0,60) и меньшей продолжительностью госпитализаций (0,39 vs 1,00) [46]. Проанализировав все доступные методы терапии ХОБЛ в систематическом обзоре, N. S. Godtfredsen и соавт. сделали вывод, что отказ от курения позволяет замедлить прогрессирование ХОБЛ даже на тяжелых стадиях и улучшает выживаемость больных [47].
Вакцинация
В настоящее время всем пациентам с ХОБЛ независимо от степени тяжести рекомендованы регулярные вакцинации от гриппа и пневмококковой инфекции [48, 49]. По данным одного из исследований эффективности вакцинации против гриппа у пожилых пациентов с хроническими заболеваниями легких, вакцинация способствует значительному снижению числа обострений, госпитализаций и летальных исходов [50]. Сведения о возможности уменьшить риск обострений ХОБЛ с помощью антипневмококковых вакцин противоречивы. Так, в Кокрейновском систематическом обзоре на основе 4 рандомизированных исследований не удалось показать статистически значимого снижения числа обострений после вакцинации против пневмококковой инфекции [51]. С другой стороны, по сведениям I. Alfageme и соавт., 23валентнаяя полисахаридная антипневмококковая вакцина позволяет значительно уменьшить риск развития внебольничной пневмонии у пожилых пациентов с ХОБЛ (в возрасте старше 65 лет) и у больных с выраженной бронхиальной обструкцией (ОФВ1 < 40%) [52].
Кроме того, в нескольких исследованиях получены свидетельства положительного влияния бактериальных лизатов на риск обострений у пациентов с ХОБЛ. Например, по данным J. P. Collet и соавт., применение иммуноактивного лиофилизированного водорастворимого экстракта ОМ65 снижало количество обострений на 29% у больных хроническим бронхитом или ХОБЛ легкой степени [53], а М. Soler и соавт. продемонстрировали снижение риска и продолжительности госпитализации у пациентов с тяжелой ХОБЛ [54].
В исследовании M. Cazzola после использования механического бактериального лизата PMBL у больных среднетяжелой и тяжелой ХОБЛ зарегистрировано уменьшение риска инфекционных обострений и госпитализации, а также длительности пребывания в стационаре [55].
Легочная реабилитация
В настоящее время представлены очень убедительные данные о высокой эффективности программ легочной реабилитации при ХОБЛ, однако их результаты связаны в основном с повышением физической выносливости и качества жизни пациентов, но о влиянии реабилитации на обострения ХОБЛ известно относительно немного. Программы легочной реабилитации улучшают прогноз пациентов с ХОБЛ, что связано с их комплексным воздействием: уменьшением легочной гиперинфляции, десенситизацией к диспноэ, ослаблением депрессии и тревоги, а также повышением физической активности. В проспективном рандомизированном исследовании, выполненном в Уэльсе, удалось доказать, что легочная реабилитация уменьшает длительность госпитализаций пациентов с ХОБЛ (10,4 дня по сравнению с 21 днем в группе контроля) [56]. По заключению метаанализа, выполненного на основе 6 исследований с участием 230 пациентов с ХОБЛ, легочная реабилитация снижает риск госпитализаций (совокупный ОР = 0,26) и летального исхода (совокупный ОР = 0,45) [57].
Фармакологические стратегии профилактики обострений
Снижение риска обострений ХОБЛ продемонстрировано для лекарственных препаратов нескольких групп, однако действенность этих препаратов для разных категорий пациентов с ХОБЛ, вероятно, неодинакова [58]. Выделение фенотипов ХОБЛ помогает охарактеризовать пациентов, лучше всего отвечающих на определенные виды терапии, т. е. индивидуализировать подход к лечению [59, 60].
Длительно действующие бронходилататоры
Сегодня наиболее эффективными среди бронходилататоров признаны длительно действующие (до 24 ч) (ДДБД). В настоящее время эти препараты, позволяющие уменьшать выраженность симптомов заболевания и риск развития обострений, служат основой базисной терапии ХОБЛ [1]. ДДБД включают два класса препаратов с различными механизмами действия: β2-агонисты и антихолинергические препараты.
Длительно действующие β2-агонисты. Поддерживающая терапия длительно действующими β2-агонистами (ДДБА) помогает не только улучшить функциональные показатели и уменьшить выраженность клинических проявлений, но и снизить риск развития обострений ХОБЛ.
В исследовании INHANCE терапия индакатеролом (ИНД) в дозе 150 мкг в сутки в течение 26 недель уменьшила количество обострений ХОБЛ на 31% по сравнению с плацебо (ОР = 0,69, 95%ный ДИ: 0,51–0,94) [61]. По данным объединенного анализа исследований INHANCE, INVOLVE и INLIGHT1, прием ИНД в течение 3 месяцев в дозе 150 мкг в сутки сопровождается снижением числа обострений на 37% (ОР = 0,63, 95%ный ДИ: 0,44–0,91), а в дозе 300 мкг в сутки — на 34% (ОР = 0,66, 95%ный ДИ: 0,49–0,90) [62].
Длительно действующие антихолинергические препараты. Сегодня наиболее убедительная доказательная база по способности уменьшать риск будущих обострений получена для длительно действующего антихолинергического препарата (ДДАХ) тиотропия бромида [63].
В исследовании MISTRAL терапия тиотропия бромидом уменьшила среднее количество обострений ХОБЛ на 35% больше, чем плацебо (1,57 vs 2,41 обострения в год, p < 0,01), сократила среднюю продолжительность обострений на 37% (21,1 vs 33,3 дня в год, p < 0,01), а также статистически значимо увеличила время до первого обострения (p < 0,001) [64]. Терапия тиотропия бромидом сопровождалась снижением количества курсов антибиотиков на 34% (p < 0,001), системных ГК — на 24% (p < 0,01).
В других исследованиях также отмечено значительное уменьшение числа госпитализаций больных, принимавших тиотропия бромид (на 38–47%), и времени, проведенного ими в стационаре (на 50%) [65, 66].
Снижение риска развития обострений ХОБЛ показано и при использовании других ДДАХ. В исследованиях GLOW1 и GLOW2 терапия гликопиррония бромидом (ГЛИ) уменьшила число среднетяжелых и тяжелых обострений ХОБЛ на 31% через 26 недель и на 34% через 52 недели [67, 68]. Через 26 недель лечения риск тяжелых обострений, ставших поводом для госпитализации больных, получавших ГЛИ, был на 65% ниже, чем в группе плацебо (OР = 0,35, 95%ный ДИ: 0,141–0,857) [67].
По данным исследования ATTAIN, частота развития обострений ХОБЛ у пациентов, принимавших аклидиния бромид в дозе 800 мг в сутки, составила 0,4 в год, а плацебо —0,6 в год. По сравнению с плацебо ОР развития обострений при лечении аклидиния бромидом в дозе 400 мг 2 раза в день составил 0,67 (95%ный ДИ: 0,48–0,94, р < 0,05) [69]. Согласно результатам оценки частоты обострений с помощью медицинской документации и вопросника Evaluating Respiratory Symptoms, среднегодовое количество обострений сократилось в среднем на 28% [70].
Примечательно, что ДДАХ более эффективны для снижения риска обострений ХОБЛ, чем ДДБА. По данным исследования POETCOPD (включены 7384 больных, исследование продолжали в течение 1 года), в котором сравнивали тиотропия бромид и салметерол (САЛ) [71], на фоне терапии тиотропия бромидом зарегистрировано уменьшение риска развития обострений на 17% (p < 0,001) и увеличение времени до первого обострения ХОБЛ на 42 дня (187 дней vs 145 дней) по сравнению с применением САЛ. Риск развития тяжелых обострений на фоне приема тиотропия бромида уменьшился на 27% (p < 0,001).
При субгрупповом анализе показано, что преимущество тиотропия бромида перед САЛ проявляется независимо от пола, возраста, терапии ингаляционными ГК (ИГК) и статуса курения. В исследовании INVIGORATE (3444 больных ХОБЛ) при сравнении эффектов тиотропия бромида и ИНД в течение 1 года получены схожие результаты: на фоне терапии ДДАХ число обострений оказалось на 29% меньше, чем при приеме ДДБА [71].
Фиксированные комбинации длительно действующих β2-агонистов и длительно действующих антихолинергических препаратов. Относительно недавно для терапии ХОБЛ созданы фиксированные комбинации ДДБА и ДДАХ, позволяющие принимать эти препараты одновременно с помощью одного ингалятора. В большинстве специальных исследований продемонстрирована высокая эффективность комбинаций ДДБА/ДДАХ, превосходящая таковую монотерапии входящими в их состав бронходилататорами [72]. Наиболее свежие данные свидетельствуют о высокой эффективности комбинации ИНД/ГЛИ для уменьшения риска обострений ХОБЛ.
Основная задача исследования SPARK (362 исследовательских центра, 2224 пациента с ОФВ1 менее 50% должного и обострениями в анамнезе) состояла в сравнении влияния ИНД/ГЛИ, монотерапии ГЛИ и тиотропия бромидом на число обострений ХОБЛ втечение 64 недель [73]. По сравнению с монотерапией ГЛИ и тиотропия бромидом прием ИНД/ГЛИ снизил общее количество обострений ХОБЛ (от легких до тяжелых) на 15% и 14% соответственно [73]. По данным последующего метаанализа, ИНД/ГЛИ способствует увеличению времени до следующего обострения на 35% [74].
В исследовании FLAME сравнивали эффективность ИНД/ГЛИи САЛ/флутиказон (ФЛУ) в отношении снижения риска обострений ХОБЛ. Всего в исследовании участвовали 3062 пациента с ХОБЛ, выраженной одышкой (≥ 2 баллов по шкале Medical Research Council) и анамнезом обострений в течение последнего года [75]. Исследование FLAME продемонстрировало более высокую эффективность комбинации ИНД/ГЛИ, чем САЛ/ФЛУ, по способности уменьшать число всех обострений (различие в эффективности составило 11%, p = 0,003) (рис. 3), а также среднетяжелых и тяжелых обострений (на 17%, p < 0,001).
Рис. 3. Индакатерол/гликопиррония бромид превосходит салметерол/флутиказон по снижению среднегодового уровня всех обострений хронической обструктивной болезни легких (легких, средней тяжести и тяжелых) [75]
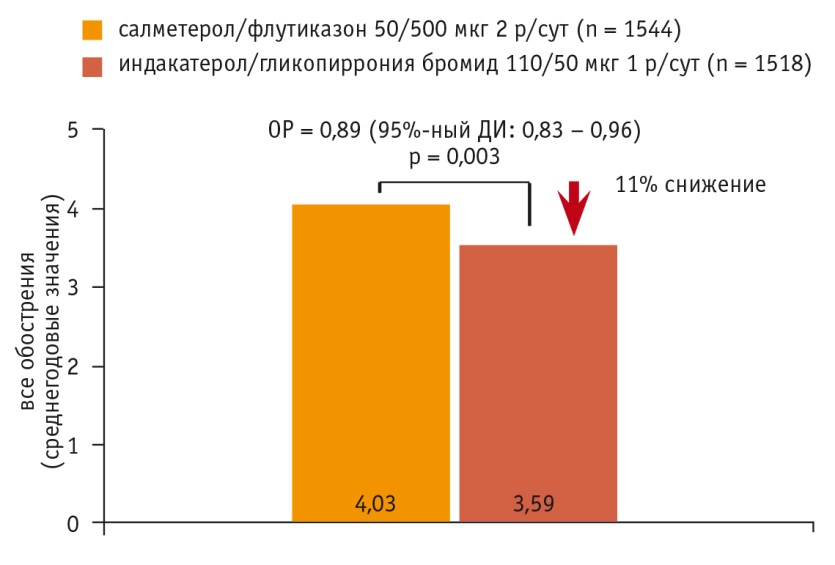
Несмотря на небольшое число тяжелых обострений, которое не позволило установить статистически значимые различия их частоты между группами терапии, в группе ИНД/ГЛИ до 1го тяжелого обострения прошло существенно больше времени, чем в группе САЛ/ФЛУ (снижение риска на 19%, p = 0,046) [75]. В отличие от САЛ/ФЛУ эффективность ИНД/ГЛИ не зависела от уровня эозинофилии периферической крови. Частота побочных эффектов и смертей была сходной в обеих группах терапии, однако у больных, принимавших САЛ/ФЛУ, зафиксировано статистически значимо большее число случаев пневмонии (4,8% vs 3,2%, p = 0,02) [75].
Судить о влиянии других фиксированных комбинаций ДДБА/ДДАХ на риск обострений ХОБЛ преждевременно, так как этот аспект терапии специально не изучали. В исследованиях TOnado 1 и TOnado 2 продемонстрировано снижение числа обострений ХОБЛ на фоне лечения тиотропия бромидом/олодатеролом по сравнению с монотерапией олодатеролом (ОР = 0,83; 95%ный ДИ: 0,71–0,99), но не тиотропия бромидом [76]. В исследованиях комбинации формотерола (ФОР) и аклидиния бромида статистически значимые различия числа обострений на фоне терапии этой комбинацией препаратов, монокомпонентами и САЛ/ФЛУ не обнаружены [77–80]. Лечение комбинацией вилантерола и умеклидиния также статистически значимо не влияло на риск обострений при сравнении с терапией монокомпонентами или тиотропия бромидом [81].
Ингаляционные глюкокортикоиды и их комбинации с β2-агонистами
Влияние приема ИГК на число обострений ХОБЛ служит предметом научных дискуссий [82, 83]. Предположительно, основным механизмом действия ИГК следует считать противовоспалительный. Однако при ХОБЛ ИГК воздействуют лишь на некоторые компоненты бронхиального воспаления (Тлимфоциты и макрофаги) [84]. Меньшую эффективность ИГК при ХОБЛ, чем при бронхиальной астме, можно объяснить с позиции снижения экспрессии и активности одного из ключевых ядерных ферментов — деацетилазы гистонов 2, необходимого для «выключения» активированных воспалительных генов [85, 86].
В исследовании ISOLDE (751 пациент с ХОБЛ) у участников, принимавших ИГК, среднее число обострений заболевания было значительно ниже (на 25%; 0,99 в год на 1 пациента), чем у пациентов, получавших плацебо (1,32 обострения в год) [87]. Однако в настоящее время ИГК при ХОБЛ чаще всего назначают в сочетании с ДДБА, т. е. применяют фиксированные комбинации ИГК/ДДБА. Согласно международным клиническим рекомендациям, терапия ИГК рекомендована только больным ХОБЛ с высоким риском развития повторных обострений (не менее 2 обострений за последний год или ОФВ1 < 50% должного, т. е. группы С и D по классификации GOLD) [1].
В исследовании TORCH комбинация САЛ/ФЛУ снижала частоту обострений ХОБЛ на 25% по сравнению с плацебо, что статистически более значимо, чем при монотерапии теми же препаратами (на 15% при терапии САЛ и на 18% — ФЛУ) [40].
В исследовании W. Szafranski и соавт. терапия комбинированным препаратом, содержащим будесонид (БУД) и ФОР, уменьшила число тяжелых обострений ХОБЛ на 24%, а легких обострений — на 62% [88]. Исследование P. M. Calverley и соавт. также подтвердило преимущества терапии БУД/ФОР перед монопрепаратами и плацебо: время до развития следующего обострения составило 254 дня, а в группах БУД, ФОР и плацебо — 178, 154 и 96 дней соответственно [89]. Как показал математический анализ результатов двух данных исследований, число больных, которых необходимо пролечить БУД/ФОРдля предупреждения одного обострения (number needed to treat), по сравнению с плацебо составляет 2,2–2,4 [90].
Снижение риска обострений ХОБЛ показано и при использовании новых комбинаций ИГК/ДДБА. В исследовании FORWARD терапия экстрамелкодисперсной комбинацией беклометазона дипропионата и ФОР в течение 48 недель уменьшила риск обострений ХОБЛ на 28% по сравнению с ФОР (ОР = 0,72; 95%ный ДИ: 0,62–0,84) [91]. По данным объединенного анализа двух зеркальных исследований также зарегистрировано статистически значимое снижение риска среднетяжелых и тяжелых обострений ХОБЛ с помощью комбинации флутиказона фуроата и вилантерола по сравнению с вилантеролом [92].
Следует помнить, что терапия ИГК и ИГК/ДДБА сопряжена с достаточно большим количеством местных и системных нежелательных явлений, особенно при длительном приеме высоких доз ИГК [93]. Наиболее распространенные побочные эффекты включают ротоглоточный кандидоз, катаракту, глаукому, остеопороз и переломы костей, васкулопатии, СД, реактивацию туберкулеза, подавление функции коры надпочечников и др. [94]. В последние годы в число нежелательных явлений при терапии ИГК у пациентов с ХОБЛ также вошло повышение риска развития пневмонии. В крупном когортном исследовании, включавшем 135 445 больных ХОБЛ, продемонстрировано статистически значимое дозозависимое повышение риска пневмонии при использовании ИГК у больных с впервые диагностированной ХОБЛ: примерно на 28% при низких дозах, на 111% — при средних и на 224% — при высоких дозах. Развитие пневмонии также сопровождается увеличением стоимости медицинского обслуживания пациентов с ХОБЛ [95].
Поскольку ХОБЛ является комплексным и гетерогенным заболеванием с различными патофизиологическими механизмами, то вполне вероятна более высокая эффективность ИГК у определенных групп пациентов с ХОБЛ, или фенотипами ХОБЛ. Назначение ИГК с позиции фенотипирования ХОБЛ сегодня представляется наиболее перспективным [96]. К числу ИГКчувствительных фенотипов ХОБЛ можно отнести сочетание бронхиальной астмы и ХОБЛ, фенотипы с частыми обострениями и с повышенным содержанием эозинофилов в мокроте или в крови [93, 94].
Безусловно, определение перечисленных фенотипов попрежнему затруднительно: например, при частых обострениях (особенно вызванных бактериальной инфекцией) не всегда необходима терапия ИГК; у некоторых пациентов с сочетанием астмы и ХОБЛ возникают такие изменения дыхательных путей (ремоделирование и нейтрофильное воспаление), при которых ИГК также неэффективны; наконец, не разработаны точные и универсальные критерии эозинофилии мокроты и крови (чаще всего пороговые значения составляют ≥ 3% для мокроты и ≥ 300 клеток в 1 мкл для крови) [96].
Ингибиторы фосфодиэстеразы 4
Рофлумиласт и его активный метаболит рофлумиласт Nоксид являются селективными ингибиторами фермента фосфодиэстеразы 4 (ФДЭ4). Основной механизм действия рофлумиласта при ХОБЛ связан с угнетением воспалительной реакции дыхательных путей [97].
Практически во всех исследованиях зарегистрирована статистически значимо меньшая частота среднетяжелых и тяжелых обострений ХОБЛ на фоне терапии рофлумиластом, чем на фоне плацебо (на 14–17%) [98, 99].
S. I. Rennard и соавт. выполнили совокупный posthoc анализ исследований эффективности рофлумиласта у пациентов с ХОБЛ (стадии III и IV по классификации GOLD) и показали значительное снижение числа обострений ХОБЛ в подгруппе больных с бронхитическим вариантом заболевания (т. е. с хроническим кашлем и выделением мокроты) — на 26,2% (р = 0,001), в то время как в целом по группе ХОБЛ снижение числа обострений составило 14,3% (р = 0,026) [100].
E. D. Bateman и соавт. проанализировали влияние рофлумиласта на число обострений у больных ХОБЛ с частыми (≥ 2 в год) и нечастыми (< 2 в год) обострениями [101] на основе двух других исследований. Статистически значимое уменьшение количества обострений при терапии рофлумиластом зарегистрировано у всех больных: при нечастых обострениях — на 16,5% по сравнению с плацебо (р = 0,006), а при частых обострениях — еще более выраженное: на 22,3% (р = 0,002).
Недавно опубликованы результаты исследования REACT, в котором в течение 1 года изучали эффективность рофлумиласта у пациентов с тяжелой ХОБЛ, перенесших как минимум два обострения в предшествующем году, несмотря на терапию комбинацией ИГК/ДДБА или ИГК/ДДБА/тиотропия бромид [102]. Лечение рофлумиластом привело к снижению числа среднетяжелых и тяжелых обострений на 13,2% (при анализе с помощью регрессии Poisson ОР = 0,868, 95%ный ДИ: 0,753–1,002) или на 14,2% (при анализе с помощью негативной биноминальной регрессии ОР = 0,858, 95%ный ДИ: 0,740–0,995). Таким образом, добавление рофлумиласта к двойным или даже тройным комбинациям способствует уменьшению риска обострений у пациентов с бронхитическим фенотипом ХОБЛ и частыми обострениями. Однако терапия ингибитором ФДЭ4 сопряжена с частыми побочными эффектами (тошнотой, снижением массы тела и др.) [102].
В другом годичном исследовании со сходным дизайном RE(2)SPOND рофлумиласт также уменьшал число обострений на 8,5% по сравнению с плацебо, но этот небольшой эффект не достиг статистической значимости (ОР = 0,92; 95%ный ДИ: 0,81–1,04) [103]. Тем не менее post hoc анализ исследования показал, что терапия рофлумиластом статистически значимо уменьшает риск обострений у пациентов с 3 и более обострениями и/или госпитализацией в предшествующий год — на 39% (ОР = 0,61; 95%ный ДИ: 0,39–0,95) и на 22% (ОР = 0,78; 95%ный ДИ: 0,61–1,00) соответственно. Однако в связи с развитием побочных эффектов терапии пациенты из группы рофлумиласта чаще прекращали прием препарата (11,7%), чем пациенты группы плацебо (5,4%).
Антибиотики
В настоящее время растет число сведений о возможности длительного использования макролидных антибиотиков (азитромицина и кларитромицина) у пациентов с ХОБЛ и частыми обострениями. Потенциальные механизмы действия макролидов при хронических воспалительных бронхолегочных заболеваниях включают подавление секреции в дыхательных путях, угнетение миграции нейтрофилов и лимфоцитов в дыхательных путях, а также антипролиферативное воздействие на активно делящиеся клетки [104].
Относительно недавно опубликованы результаты самого масштабного исследования влияния длительной терапии азитромицином на развитие обострений ХОБЛ [105]. В исследование были включены 1142 больных ХОБЛ, которые в течение 1 года принимали азитромицин в дозе 250 мг в сутки ежедневно либо плацебо. У больных, принимавших азитромицин, число обострений ХОБЛ оказалось существенно ниже: 741 против 900 в группе плацебо, т. е. риск развития обострений составил 0,73 (р < 0,001). Частота обострений на 1 человека в год — 1,48 и 1,83, а среднее время до следующего обострения — 266 и 174 дня (р < 0,001) соответственно в группах азитромицина и плацебо. Различия между группами пациентов по числу госпитализаций не отмечены, однако число незапланированных визитов к врачу оказалось меньше среди больных, принимавших азитромицин: 2,46 против 2,57 события на 1 пациента в год (р = 0,048).
Таким образом, длительная терапия относительно высокими дозами азитромицина (по 250 мг ежедневно в течение 1 года) приводила к статистически значимому снижению числа обострений (на 27%) и повышению качества жизни больных, но сопровождалась развитием некоторых побочных эффектов (ухудшением слуха и повышением резистентности к антибиотикам микрофлоры носоглотки) [105].
В исследовании COLUMBUS, включавшем больных ХОБЛ с 3 и более обострениями в течение предшествующего года, терапия азитромицином в дозе 500 мг 3 раза в неделю в течение 1 года снизила количество обострений на 42% (ОР = 0,58, 95%ный ДИ: 0,42–0,79) [106].
Мукоактивные препараты
В нескольких эпидемиологических исследованиях показана довольно сильная взаимосвязь между повышенной продукцией мокроты и неблагоприятными исходами ХОБЛ, в том числе с повышенным риском развития обострений [107, 108]. С учетом данных о роли секрета в дыхательных путях при их хронических заболеваниях неоднократно предпринимались попытки изучения эффективности мукоактивных препаратов у пациентов с ХОБЛ.
По результатам нескольких рандомизированных клинических исследований, длительная поддерживающая терапия карбоцистеином способствовала снижению числа обострений ХОБЛ и улучшению качества жизни [109–111]. Относительно недавно проведено крупное, хорошо спланированное исследование PEACE, посвященное роли мукоактивных препаратов у больных ХОБЛ [109]. Изучено влияние терапии карбоцистеином (в дозе 500 мг в сутки) в течение 3 лет на развитие обострений ХОБЛ (в основном у пациентов с III и IV стадиями заболевания по классификации GOLD). Среднее число обострений на 1 пациента в группе принимавших карбоцистеин составило 1,01, а в группе плацебо — 1,35, т. е. на фоне мукоактивной терапии наблюдали снижение риска развития обострений на 24,5%. Однако популяция больных ХОБЛ в исследовании PEACE отличалась существенными особенностями (исследование проводили в Китае): ИГК принимали менее 20% пациентов, и многие не использовали бронходилататоры, что не позволяет распространить результаты исследования на типичных пациентов с ХОБЛ.
Согласно результатам двух недавних годичных исследований, высокие дозы NAC (по 600 мг 2 раза в сутки) снижают риск обострений ХОБЛ. В исследовании HIACE (с участием 120 больных) отмечено уменьшение риска обострений на 0,75 события в год (р = 0,019) [112], а в исследовании PANTHEON (1006 больных) — на 22% (ОР = 0,78; 95%ный ДИ: 0,67–0,90) [113].
В метаанализе M. Cazzola и соавт., основанном на 13 исследованиях с участием 4155 пациентов с ХОБЛ, продемонстрировано, что терапия NAC снижает риск обострений ХОБЛ на 25% (ОР = 0,75; 95%ный ДИ: 0,66–0,84), причем протективный эффект более силен при выраженной бронхиальной обструкции. Риск побочных эффектов NAC невысок и не зависит от дозы препарата [114].
Заключение
Обострения существенно снижают качество жизни пациентов с ХОБЛ. Для улучшения ведения таких больных необходим поиск более целенаправленных (таргетных) фармакологических способов профилактики обострений, даже с учетом уже используемых препаратов. С позиций решения основных задач терапии ХОБЛ эффективность немедикаментозных методов профилактики обострений не уступает таковой лекарственных средств.








