В основе патогенеза синдрома Гурлер лежит накопление в тканях дерматансульфата и гепарансульфата, что приводит к поражению внутренних органов: ЦНС, сердечно-сосудистой и дыхательной систем, печени и селезенки, — а также к прогрессирующей задержке психомоторного развития, ухудшению зрения и слуха, органомегалии и деформации скелета [22].
Медиана возраста пациентов на момент установления диагноза составляет 10–12 месяцев [3, 15]. Ожидаемая продолжительность жизни больных синдромом Гурлер без лечения не превышает 10 лет (медиана — 5,3 года) [4, 21]. При своевременном начале ферментозаместительной терапии рекомбинантным препаратом ларонидазой улучшаются функции дыхательной и сердечно-сосудистой систем, повышается качество жизни пациентов, однако препарат, к сожалению, не проникает через гематоэнцефалический барьер и не предотвращает поражение ЦНС [11].
В настоящее время единственным радикальным методом лечения синдрома Гурлер служит аллогенная трансплантация гемопоэтических стволовых клеток (алло-ТГСК). Первая успешная алло-ТГСК при синдроме Гурлер выполнена в 1980 г. [10]. В настоящее время в мире накоплен большой положительный опыт лечения синдрома Гурлер с помощью алло-ТГСК; по данным разных авторов, долгосрочная выживаемость составляет 50–85% [1, 5, 8, 13, 14].
При выполнении алло-ТГСК у детей с болезнями накопления, в частности с синдромом Гурлер, традиционно применяют миелоаблативные режимы кондиционирования (МАК). Тем не менее эти режимы подготовки могут увеличивать риск развития тяжелых осложнений, приводя к повышению летальности, связанной с трансплантацией, особенно у пациентов с низким общесоматическим статусом, характерным для детей с синдромом Гурлер в продвинутой стадии заболевания (т. е. более старшего возраста). Показано, что летальность реципиентов алло-ТГСК с общесоматическим статусом менее 80% после трансплантации составляет 28,3% против 16% в группе детей, имевших статус Карновского в модификации Ланского 80–100% [17].
Вследствие поражения миокарда и коронарных сосудов мукополисахаридами у пациентов с синдромом Гурлер чаще развиваются фатальные сердечно-сосудистые осложнения [16], ввиду специфического поражения повышен риск развития веноокклюзионной болезни печени [20]. В отдаленном периоде после алло-ТГСК описаны нарастание неврологического дефицита и нарушения поведения, связанные и с токсичностью МАК.
Внедрение режимов кондиционирования сниженной интенсивности доз (кондиционирование редуцированной интенсивности — РИК) и повышение качества сопроводительной терапии позволили снизить токсичность подготовки пациентов с синдромом Гурлер к алло-ТГСК. Это особенно актуально для детей старшего возраста, у которых, как правило, более выражены клинические проявления основного заболевания [12]. С другой стороны, по данным различных исследований, применение РИК у пациентов с синдромом Гурлер увеличивает вероятность отторжения трансплантата и, как следствие, ухудшает общую выживаемость.
Цель работы: сравнить эффективность и токсичность МАК и РИК при подготовке к алло-ТГСК у детей с синдромом Гурлер.
МАТЕРИАЛЫ И МЕТОДЫ
Проанализированы результаты 33 алло-ТГСК, выполненных 31 пациенту с синдромом Гурлер в период с 2004 по 2015 г. в трех клиниках Российской Федерации: ФГБУ «Российская детская клиническая больница» МЗ РФ (главный врач — профессор, д. м. н. Н. Н. Ваганов), ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» МЗ РФ (генеральный директор — академик РАН, д. м. н., профессор А. Г. Румянцев), НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. И. П. Павлова МЗ РФ (директор — профессор, д. м. н. Б. В. Афанасьев).
Диагноз синдрома Гурлер устанавливали на основании клинических проявлений заболевания, результатов оценки активности альфа-L-идуронидазы, содержания гликозаминогликанов в моче и генетического исследования.
Анализ общей выживаемости выполнен методом Каплана — Мейера с использованием программных пакетов SPSS 17.0 и Statistica 8.0. Для вычисления медиан применяли табличный процессор Microsoft Office Excel 2007.
Медиана возраста на момент установления диагноза составила 15 месяцев (3–24), на момент алло-ТГСК — 22 месяца (9–42); РИК — 28 месяцев, МАК — 18 месяцев. В качестве подготовки к алло-ТГСК использовали МАК (24 трансплантации у 23 детей) или РИК (9 трансплантаций у 8 детей). В группе с РИК алло-ТГСК выполняли от неродственного донора, полностью совместимого по генам HLA-cистемы (10/10, n = 6) или имеющего различие с реципиентом в 1 гене (9/10, n = 3). В группе с МАК неродственная алло-ТГСК проведена 18 пациентам (10/10, n = 17; 9/10, n = 1), родственная — 5 пациентам.
В большинстве случаев в качестве источника гемопоэтических стволовых клеток (ГСК) использовали костный мозг (63,6%, n = 21), для 10 трансплантаций (30,3%) применяли периферические стволовые клетки крови (ПСКК), в 2 случаях (6,1%) — клетки пуповинной крови.
При РИК применяли мелфалан (в дозе 140 мг/м2), флударабин (в дозе 150 мг/м2) и антитимоцитарный иммуноглобулин (Атгам по 60 мг/кг). В основе МАК был треосульфан (42 г/м2) в комбинации с флударабином, мелфаланом и антитимоцитарным иммуноглобулином (в случае алло-ТГСК от неродственного донора), в 4 случаях вместо треосульфана использовали бусульфан (в дозе 6 мг/кг), в 4 случаях мелфалан заменяли на тиотепу (10 мг/кг). Для профилактики острой реакции «трансплантат против хозяина» (РТПХ) применяли циклоспорин или такролимус в комбинации с метотрексатом или микофенолата мофетилом. Шести пациентам в группе с МАК перед алло-ТГСК дополнительно вводили ритуксимаб в дозе 375 мг/м2. Ввиду высокого содержания Т-лимфоцитов в трансплантате ПСКК у 3 пациентов в группе с РИК дополнительно проводили иммуномагнитную CD3/CD19-деплецию на приборе CliniMACS.
Восстановление гемопоэза фиксировали при достижении числа лейкоцитов в периферической крови выше 1000/мкл, нейтрофилов — более 500/мкл при отсутствии стимуляции гранулоцитарным колониестимулирующим фактором (Г-КСФ). Оценку донорского химеризма в периферической крови проводили на 30, 60, 90–100, 180 и 360-й дни после алло-ТГСК. Более 95% донорских клеток расценивали как полный донорский химеризм. В периоде после алло-ТГСК всем пациентам определяли активность альфа-L-идуронидазы. Клиническую стадию острой РТПХ и степень органного поражения оценивали в соответствии с общепринятой классификацией [18]. Выраженность клинических проявлений хронической РТПХ определяли по шкале NIH 2005 (NIH Consensus Conference, пересмотр 2014 г.), токсичность — по шкале NCI СТС ver. 3.0 (2006).
РЕЗУЛЬТАТЫ
На момент анализа данных живы 26 пациентов с медианой наблюдения 50 месяцев (7–140).
Восстановление кроветворения
У всех пациентов зафиксировано приживление трансплантата с достижением полного донорского химеризма к 30-му дню после ТГСК и нормальной активностью альфа-L-идуронидазы в лейкоцитах. Медиана восстановления числа нейтрофилов (более 500/мкл) составила 20 дней (11–29).
У 2 пациентов после РИК и 5 пациентов после МАК в различные сроки после алло-ТГСК зафиксирован смешанный гемопоэтический химеризм, с целью коррекции которого пациенты получали инфузии донорских лимфоцитов. В настоящее время у 2 из них сохраняется стабильный смешанный химеризм, у 5 пациентов (4 после МАК, 1 после РИК) отмечено вторичное отторжение трансплантата.
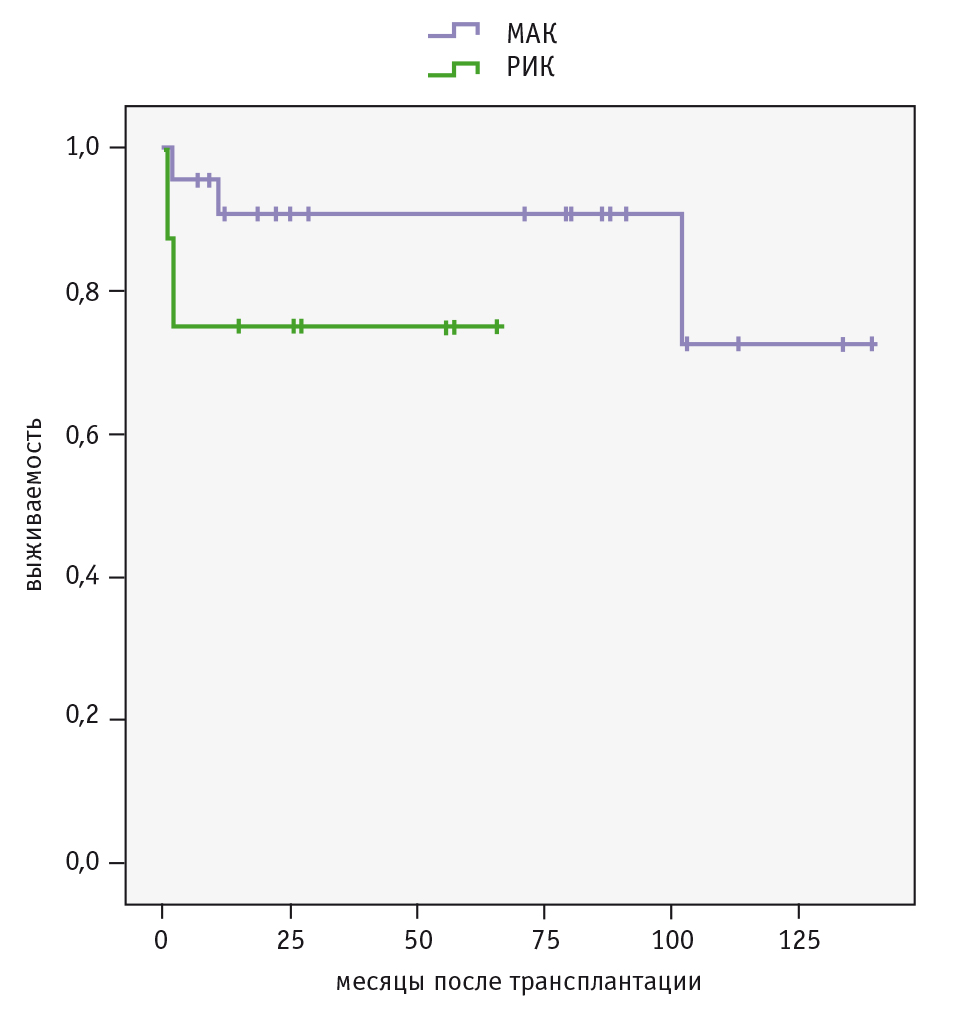
Четырехлетняя общая выживаемость после алло-ТГСК в общей группе составила 69,5 ± 0,16%. При сравнении общей выживаемости после использования МАК и РИК статистически значимых различий не получено: 72,75% и 75,00% соответственно (p = 0,24, рис.).
Рис. Общая выживаемость пациентов с синдромом Гурлер после аллогенной трансплантации гемопоэтических стволовых клеток в зависимости от режима кондиционирования
Осложнения
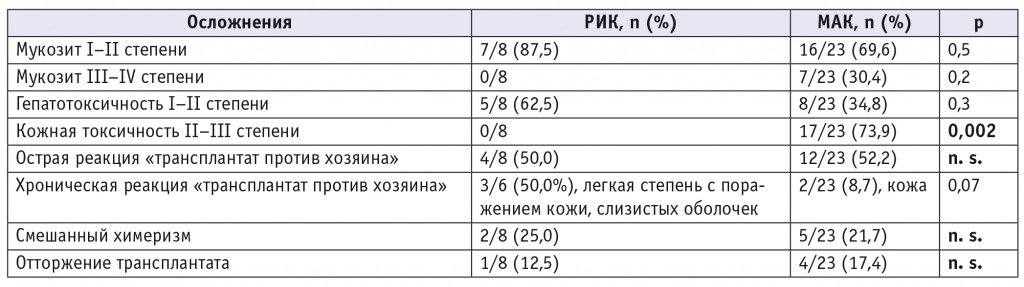
После алло-ТГСК с МАК у 7 из 23 (30,4%) пациентов наблюдали мукозит III–IV степени. У пациентов после алло-ТГСК с РИК мукозита III–IV степени не зарегистрировано.
Токсические гепатиты I–II степени выявлены у 5 (62,5%) больных после алло-ТГСК с РИК и у 8 (34,8%) пациентов после алло-ТГСК с МАК (р = 0,3). В группе пациентов, получивших МАК, кожная токсичность II–III степени отмечена в 17 случаях (73,9%), после алло-ТГСК с РИК кожной токсичности не зарегистрировано (р = 0,002). В общей группе пациентов (n = 29) острая РТПХ II–IV степени развилась у 16 пациентов, в том числе клинически значимая (III–IV степени) — в 2 случаях; при этом оба случая клинически значимой острой РТПХ зарегистрированы у пациентов с РИК. Локализованная форма хронической РТПХ отмечена у 3 из 6 (50,0%) пациентов после РИК и у 2 из 23 (8,7%) пациентов после МАК (p = 0,07). Распространенной формы хронической РТПХ не зарегистрировано ни в одной группе (табл.).
Таблица
Осложнения у пациентов с синдромом Гурлер после аллогенной трансплантации гемопоэтических стволовых клеток в зависимости от режима кондиционирования
Летальность
В группе пациентов, получивших МАК, во всех 3 случаях причиной смерти были инфекционные осложнения. Среди причин смерти после алло-ТГСК с РИК — острая РТПХ IV cтепени (1 пациент), TRALI-синдром (1 пациент).
ОБСУЖДЕНИЕ
Алло-ТГСК — единственный радикальный метод лечения, позволяющий значительно уменьшить выраженность клинических проявлений синдрома Гурлер, особенно поражения ЦНС.
Согласно большинству исследований, для больных синдромом Гурлер рекомендовано использование МАК [5, 19]. Однако у пациентов старшей возрастной группы с низким общесоматическим статусом применение МАК может быть ограничено. По данным Европейской группы по трансплантации крови и костного мозга (European Group for Blood and Bone Marrow Transplantation), оптимальным сроком выполнения алло-ТГСК является возраст до 2 лет, когда меньше степень мультиорганного вовлечения и возможно максимальное сохранение функций ЦНС. По литературным сведениям, у пациентов, перенесших трансплантацию в возрасте до 17 месяцев, зафиксирована лучшая бессобытийная выживаемость: 71% при трансплантации до 17 месяцев против 55% — после этого возраста [5].
Одной из причин выбора РИК в нашем исследовании послужил старший возраст пациентов, медиана которого в этой группе составила 28 месяцев. В одном мультицентровом исследовании медиана возраста — 13,5 месяца [2], по другим данным — 18 месяцев [9].
В нашем исследовании общая выживаемость при алло-ТГСК с РИК и МАК не различалась (75,00% и 72,75%, p = 0,24). У всех пациентов к 30-му дню после алло-ТГСК зарегистрировано приживление трансплантата с достижением полного донорского химеризма. В целом частота развития ранних токсических осложнений в группах сопоставима. Тем не менее в раннем периоде после алло-ТГСК при использовании РИК не зафиксировано токсических осложнений III–IV степени, тогда как у 7 пациентов (30,4%) после МАК отмечено развитие мукозита III степени, у 5 пациентов (21,7%) — кожной токсичности III степени. Кожную токсичность II–III степени наблюдали только после МАК (73,9% vs 0%, p = 0,002).
Частота развития смешанного химеризма и отторжения трансплантата у пациентов с синдромом Гурлер после алло-ТГСК с использованием МАК и РИК сопоставима (21,7% против 25,0% и 17,4% против 12,5%, p = n. s.), что не соответствует опубликованным сведениям об увеличении вероятности отторжения трансплантата при применении РИК у пациентов с синдромом Гурлер [1, 5–7].
ЗАКЛЮЧЕНИЕ
При аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК) у детей с синдромом Гурлер эффективность режимов кондиционирования со сниженной интенсивностью доз (РИК) и с миелоаблативным кондиционированием (МАК) сопоставима. Режим кондиционирования следует окончательно выбирать с учетом состояния пациента, его возраста и коморбидного статуса. С целью выработки конкретных рекомендаций при использовании РИК и МАК необходимо дальнейшее наблюдение для оценки отдаленных осложнений алло-ТГСК и качества жизни пациентов.








