Пандемия болезни, вызванной новым коронавирусом SARS-CoV-2, продолжается уже более года. По статистике университета Джонса Хопкинса, к началу марта 2021 года в мире было зафиксировано более 114 млн случаев COVID-19, ставших причиной смерти более 2,5 млн людей. В нашей стране общее число лиц, уже перенесших или болеющих в настоящее время COVID-19, составляет 4,2 млн, общее число летальных исходов, связанных с этим заболеванием, — более 85 тысяч1. Эти грозные цифры показывают значимость вызова, связанного с пандемией, стоящего перед современным здравоохранением и цивилизацией в целом. Без сомнения, борьба с новой болезнью, а именно поиск эффективного лечения и ее профилактика, стали приоритетной задачей для медицинской науки.
Комплексное влияние вируса COVID-19 на человеческий организм определяет многообразие клинических проявлений инфекционного процесса. SARS-CoV-2 вызывает мощную реакцию иммунной системы, активацию клеток моноцитарно-макрофагального ряда, T- и В-лимфоцитов, каскадную гиперпродукцию цитокинов, таких как ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-8 и др., гранулоцитарно-макрофагального колониестимулирующего фактора, ФНО-α, интерферонов (ИФН-γ, ИФН-α, ИФН-β), различных хемокинов, волнообразное повышение концентрации которых при неблагоприятном течении заболевания принимает характер «цитокинового шторма». Повреждение эндотелиальных клеток, связанное с репликацией SARS-CoV-2 и фиксацией иммунных комплексов, сопровождается диффузным эндотелиальным воспалением, гиперпродукцией сосудистого эндотелиального фактора роста, активацией свертывающей системы и тромбоцитов, вызывающих системные протромботические нарушения. Эта патология реализуется в виде острого васкулита, локальных тромбозов, тромбоэмболии и синдрома диссеминированного внутрисосудистого свертывания. Негативное действие вируса, системная воспалительная реакция и иммуноопосредованная коагулопатия приводят к поражению многих органов и систем. Помимо столь характерных для COVID-19 пневмонии и острого респираторного дистресс-синдрома (ОРДС), при этом заболевании возникает поражение сердечно-сосудистой системы (в виде перикардита, миокардита, васкулита сосудов различного калибра), пищеварительной системы (ЖКТ, поджелудочной железы и печени), почек, периферической и центральной нервной систем, скелетно-мышечной системы и др. [1-3].
Очевидно, что различные тканевые повреждения, возникающие при COVID-19, даже в случае благоприятного течения заболевания, не могут проходить бесследно, поскольку неизбежно развитие дегенеративных и дистрофических изменений (в частности, легочного фиброза), появление функциональных нарушений, психоэмоциональных проблем [4]. Комплекс симптомов, сохраняющийся после перенесенной инфекции COVID-19, получил название «постковидный синдром» (ПКС) (по МКБ-10, U09.9, «Состояние после COVID-19»)2. В англоязычной литературе также достаточно распространен термин «длительный COVID» («Long COVID»).
ПАТОГЕНЕЗ ПОСТКОВИДНОГО СИНДРОМА
Как было отмечено выше, инфекция SARS-CoV-2 оказывает негативное влияние на многие органы и системы человеческого организма.
Последствием вирусной пневмонии становится распространенный интерстициальный легочный фиброз, выраженность которого зависит от объема поражения легочной ткани и тяжести ОРДС. Важным фактором, влияющим на развитие данной патологии, является гиперпродукция трансформирующего фактора роста (TGF-β) — субстанции, обладающей противовоспалительным и иммуносупрессивным действиями, стимулирующей пролиферацию и дифференцировку фибробластов, а также синтез коллагена и подавление активности коллагеназ. Прогрессирующий легочный фиброз приводит к снижению жизненной емкости и перфузионной способности легких, сопровождается постоянным сухим кашлем, одышкой при физической нагрузке и признаками хронической гипоксемии [5-6].
Фиброз также возникает в ткани миокарда. Причиной этой патологии может быть непосредственное негативное действие SARS-CoV-2, чрезмерная стимуляция ренин-ангиотензин-альдостероновой системы (РААС), связанная с блокадой S-белком вируса АПФ-2 и с вторичным гиперальдостеронизмом; в качестве причины может выступать гипоксия миокарда, повышение нагрузки на ПЖ при массивном поражении легочной ткани, а также негативное кардиотоксическое действие ряда препаратов, которые использовались для лечения COVID-19 (в частности, гидроксихлорохин и азитромицин). Фиброз миокарда приводит к дилатационной кардиомиопатии, сопровождающейся снижением фракции выброса и развитием сердечной недостаточности [7-8].
Острое поражение почек — одна из наиболее частых висцеральных патологий, которая возникает при тяжелом течении COVID-19. Вирусная инвазия нефроцитов, активация РААС, гипертензия, эндотелиальная дисфункция и сосудистые тромбозы вызывают серьезное нарушение функции почек, вплоть до развития острой почечной недостаточности. По данным серии исследований, клинически значимую ренальную патологию отмечали у 20% больных, госпитализированных по поводу COVID-19, а 3–4% пациентов из-за развития острой почечной недостаточности потребовался гемодиализ. Исходом данной патологии может стать прогрессирующий нефросклероз и дальнейшее развитие или прогрессирование хронической болезни почек [9-11].
Большую роль в формировании осложнений COVID-19 играет патология периферических нервов и ЦНС. SARS-CoV-2 способен проникать в нейроны (учитывая широкую представленность АПФ-2 на мембране последних) как при гематогенном распространении, так и путем ретроградного аксонального транспорта, вызывая в ряде случаев клинически выраженные формы полинейропатии и энцефалита. С вирусным поражением нервной системы связывают хорошо известные ранние симптомы данной инфекции — аносмию и агевзию. Примерно у 10% пациентов появляются такие признаки энцефалита, как выраженная головная боль, головокружение, слабость, сонливость и дезориентация. Помимо прямого действия SARS-CoV-2, поражение нервной системы определяется васкулитом, тромбоэмболическими осложнениями на уровне мелких и крупных сосудов (в том числе развитием ишемического инсульта), нарушениями РААС и влиянием системной воспалительной реакции. Последствиями «нейроинвазии» на фоне COVID-19 становятся демиелинизирующие процессы (описаны случаи развития синдрома Гийена — Барре), очаговые некрозы нейронов, функциональные, сенсорные, нейромышечные и когнитивные нарушения [12-14]. Важную роль в развитии ПКС отводят дисфункции автономной (вегетативной) нервной системы, с которой связывают появление таких симптомов, как ортостатическая гипотензия, сердцебиение, ощущение перебоев в сердце, одышка, головокружение и др. [15].
У большинства пациентов в остром периоде COVID-19 отмечают миалгии, артралгии, выраженную мышечную слабость и «экстремальную» утомляемость. Их причиной являются тканевое повреждение, связанное с иммунокомплексным воспалением, системными микроциркуляторными нарушениями (в том числе с поражением капилляров и формированием сосудистого «сладжа»), нарушения нейромышечной передачи, гипоксемия и тканевая гипоксия. О некрозе мышечной ткани при COVID-19 свидетельствует повышение уровня таких маркеров, как креатинкиназа, АСТ и лактатдегидрогеназа. Крайним проявлением поражения скелетных мышц при COVID-19 становится рабдомиолиз, который описан при тяжелом течении этого заболевания. Последствиями перенесенной инфекции становятся очаговый и рассеянный фиброз мышечной ткани, мышечная атрофия, а также нарушения нейротрансмиттерных процессов [16-17].
Последствием COVID-19 могут стать серьезные нарушения функции эндокринной системы, в том числе хроническая надпочечниковая недостаточность. SARS-CoV-2 способен вызывать прямое повреждение клеток гипоталамуса, гипофиза и коры надпочечников; некроз клеток эндокринной системы также может быть связан с васкулитом, системной воспалительной реакцией и вторичными аутоиммунными нарушениями. В частности, отмечается молекулярная мимикрия спайк-белка SARS-CoV-2 и адренокортикотропного гормона, способная вызвать выработку аутоантител. Гипокортицизм в период после перенесенного COVID-19 может возникать вследствие высокого «напряжения» симпатоадреналовой системы при тяжелом течении вирусной инфекции, особенно при развитии септического состояния. Нельзя забывать о негативном действии на функцию коры надпочечников экзогенных глюкокортикоидов, которые широко используются для лечения тяжелых форм COVID-19 [18].
Иммуногенность SARS-CoV-2, связанная с молекулярной мимикрией этого микроорганизма и мощным иммунным ответом на вирусную инвазию, способна вызывать серьезные иммунные нарушения и появление широкого спектра аутоантител. Так, описано, что после перенесенного COVID-19 значительно повышался титр антинуклеарного фактора, антифосфолипидных антител, антинейтрофильных цитоплазматических антител, Анти-Ro, ревматоидного фактора, антител к циклическому цитруллиновому пептиду, антиэритроцитарных антител и др. Соответственно, SARS-CoV-2 может быть триггером ряда аутоиммунных заболеваний: имеются сообщения о развитии у реконвалесцентов после COVID-19 синдрома Гийена — Баре, антифосфолипидного синдрома, болезни Кавасаки, аутоиммунной гемолитической анемии [19-20].
СКЕЛЕТНО-МЫШЕЧНАЯ БОЛЬ В СТРУКТУРЕ ПОСТКОВИДНОГО СИНДРОМА
В остром периоде COVID-19 миалгии и артралгии отмечают у 50–90% больных, причем частота и выраженность этих симптомов коррелируют с тяжестью заболевания (в частности, с наличием стойкой фебрильной лихорадки) [21].
После завершения острого периода болезни у ряда пациентов сохраняются предпосылки для хронизации боли. Причиной этого, как было отмечено выше, являются дегенеративные и воспалительные изменения в структурах скелетно-мышечной системы, иммунные нарушения, патология периферической и центральной нервной систем (создающая условия для формирования периферической и центральной сенситизации), психоэмоциональные проблемы, а также большой спектр постковидной висцеральной патологии, формирующие неблагоприятный коморбидный фон [4, 22, 23] (рис.).
Рис. Схема развития скелетно-мышечной боли после перенесенного COVID-19
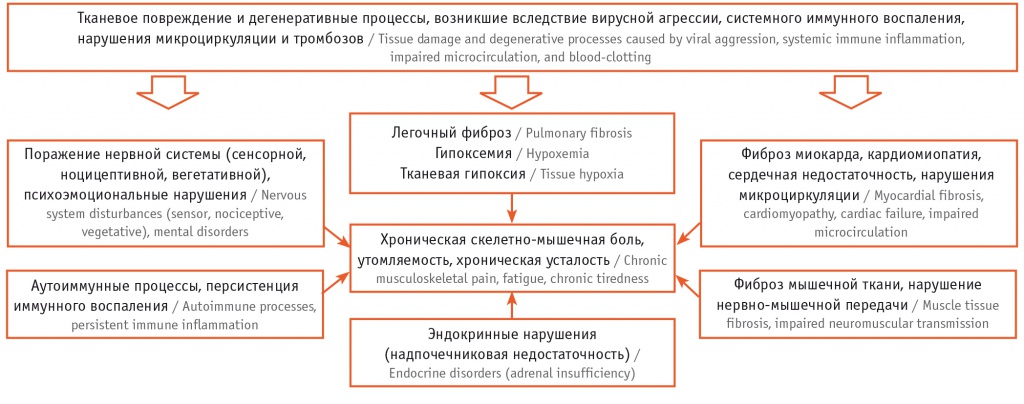
Точной статистики ПКС пока нет, однако предварительные расчеты показывают (в частности, приведенные в работе Н. Kemp и соавт.), что симптомы «длительного COVID» отмечены примерно у 10% пациентов. Так, наблюдение когорты из 4182 пациентов с диагнозом COVID-19, подтвержденным с помощью ПЦР, показало, что у 13% пациентов симптомы сохранялись через 28 дней после завершения острого периода болезни, у 4,5% — через 8 недель, у 2,3% — через 12 недель [24].
Гораздо более высокий процент лиц с ПКС показали египетские ученые I. Galal и соавт. [25], которые провели анализ клинических проявлений у 430 пациентов, перенесших COVID-19. После выздоровления симптомы заболевания сохранялись у 26,5% больных (средняя длительность составила 176 дней ± 35,1 дня). При этом у 60% выздоровевших отмечали миалгию, у 56% — артралгии, у 50% — признаки депрессии и тревоги, у 50% — нарушения сна, у 40% — головную боль, у 35% — снижение концентрации, у 15% пациентов — нарушения памяти.
Схожие данные были представлены итальянскими учеными A. Carfì и соавт. [26], которые оценили состояние 143 больных, перенесших COVID-19 (критерии выздоровления: отсутствие лихорадки и отрицательный ПЦР). Оценку симптомов проводили в среднем через 60 дней после завершения острого периода болезни. Было отмечено, что лишь 12,6% пациентов не испытывали каких-либо симптомов, связанных с перенесенной инфекцией. При этом суставные боли испытывали 27,3%, боли в груди — 21,7%, миалгии — 12% пациентов. Утомляемость и бессонница были отмечены у 53,1% и 43,4% обследованных лиц.
Британские ученые S. Halpin и соавт. [27] наблюдали когорту из 100 пациентов, выписанных из госпиталя после перенесенного тяжелого COVID-19 (32 пациента находились в реанимационном отделении). Через 1–2 месяца после выписки (в среднем через 48 дней) скелетно-мышечные боли возникали у 30% пациентов, находившихся в реанимационном отделении, у 15% пациентов было более легкое течение вирусной инфекции. Утомляемость сохранялась у 72% и 65% пациентов соответственно.
Исследователи из США, L. Jacobs и соавт. [28], оценили жалобы 183 пациентов, перенесших COVID-19, по данным опроса, на 35-е сутки после выписки из стационара. Согласно полученным данным, мышечную боль отмечали 55,0% пациентов, повышенную утомляемость — 55% опрошенных лиц.
В германской когорте больных COVID-19 частота скелетно-мышечной боли составила 12% [29].
Большой интерес представляет работа F. Soares и соавт. [30], которые сравнили появление скелетно-мышечной боли в группе из 46 больных, госпитализированных по поводу COVID-19, и в группе из 73-х больных, госпитализированных по другим причинам в тот же период. После выписки из стационара частота развития хронической боли (> 3 месяцев) в группе лиц, перенесших COVID-19, составила 19,6%, в контрольной группе — 1,4% (р = 0,002). Наличие выраженной утомляемости было отмечено у 66,8% и 2,5% соответственно (р = 0,001).
Перенесенный COVID-19 может стать причиной обострения уже имеющейся хронической боли. Так, N. Attal и соавт. [31] оценили состояние 50 пациентов, имевших хроническую невропатическую боль, связанную с полиневропатией, радикулопатией, травмой спинного мозга и перенесенным инсультом. Достаточно легко COVID-19 перенесли 49 пациентов, и лишь 1 погиб вследствие респираторных осложнений. Тем не менее у всех пациентов, перенесших инфекцию SARS-CoV-2, отмечалось усиление невропатической боли.
Последствиями перенесенного COVID-19 может стать развитие или обострение заболеваний, связанных с дисфункцией ноцицептивной и вегетативной нервной систем, для которых характерно наличие выраженной утомляемости, психоэмоциональных нарушений и хронической боли. Речь идет о фибромиалгии и синдроме хронической усталости (доброкачественном миалгическом энцефаломиелите). В настоящее время нет четких данных об увеличении частоты фибромиалгии и доброкачественного миалгического энцефаломиелита у лиц, которые перенесли инфекцию SARS-CoV-2. Однако ПКС, имеющий сходную клинику, может «маскировать» развитие и прогрессирование этих заболеваний, частота которых в мире в последние годы неуклонно растет [32-34].
Любопытно отметить, что COVID-19, при высокой частоте артралгий, относительно редко сопровождается развитием реактивного артрита. Так, М. Gasparotto и соавт. [35] в статье, опубликованной в феврале 2021 года, описывают собственное наблюдение постковидного артрита и приводят описания еще 6 случаев аналогичной патологии, представленных в мировой литературе. На момент написания настоящей статьи нам удалось в системе Pubmed найти описания 14 случаев артрита, возникшего после COVID-19.
ЛЕЧЕНИЕ ПОСТКОВИДНОГО СИНДРОМА: ПРИНЦИПИАЛЬНЫЕ ПОДХОДЫ
Подходы к ведению ПКС должны носить персонализированный характер и определяться индивидуальными особенностями этого состояния у конкретного пациента, в частности, тяжестью органной патологии, такой, например, как легочный фиброз, кардиомиопатия и др., и преобладающими проявлениями (дыхательной и сердечной недостаточностью, хронической болезнью почек, хронической скелетно-мышечной болью, хронической усталостью, психоэмоциональными нарушениями и др.) [4].
Вероятно, основным направлением патогенетической терапии ПКС может стать использование препаратов, тормозящих развитие фиброза (проходящих II–III фазы клинических исследований ингибиторов TGF-β, ингибитора ангиокиназ — нинтеданиба), а также применение иммуносупрессивных препаратов, останавливающих персистирующее иммунное воспаление [4].
В ряде случаев при ПКС, особенно при наличии признаков надпочечниковой недостаточности, может обсуждаться вопрос применения небольших доз глюкокортикоидов [4, 36]. Наличие стойкой скелетно-мышечной боли, в том числе связанной с обострениями хронических заболеваний суставов и позвоночника, неврологическими нарушениями, а также реактивным постковидным артритом, требует назначения обезболивающих средств (прежде всего НПВП), а также антидепрессантов и антиконвульсантов.
Принципиальное значение имеют структурированные реабилитационные программы, включающие дозированное повышение физической активности, аэробные упражнения, регулярные прогулки на свежем воздухе, психофизические упражнения и контроль веса. Столь же важны образовательные программы для пациентов, рациональная психотерапия и социальная поддержка, особенно для лиц с выраженными психоэмоциональными и функциональными нарушениями [37-40].
Поступила: 12.03.2021
Принята к публикации: 10.06.2021
________
1 https://gisanddata.maps.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6
2 COVID-19 Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University (JHU). URL: https://gisanddata.maps.arcgis.com/apps/dashboards/bda7594740fd40299423467b48e9ecf6 (дата обращения — 10.03.2021)








