Благодаря уникальному универсальному сочетанию анальгетического и противовоспалительного эффектов НПВП сохраняют лидирующее место среди современных лекарственных средств. Эти препараты являются ключевым инструментом при неотложной аналгезии в амбулаторной и стационарной практике, а также помогают длительно контролировать симптомы при хронических заболеваниях костно-мышечной системы [1-3]. Нимесулид, присутствующий на рынке уже 35 лет, остается востребованным препаратом, отчасти благодаря открытым в последние годы дополнительным фармакологическим свойствам и быстрому обезболивающему эффекту [4-6].
Запуск процесса воспаления связан с синтезом огромного количества медиаторов, цитокинов, факторов роста, нейротрансмиттеров и пептидов (субстанции Р, кининов), производных полиненасыщенных жирных кислот (в первую очередь простагландинов, лейкотриенов, тромбоксанов), последние как раз и считаются основной мишенью НПВП [7].
Нимесулид как единственный представитель класса сульфонанилидов, умеренно селективный ингибитор ЦОГ-2, был синтезирован до открытия механизмов ингибирования ЦОГ, при этом он в полной мере обладает основными эффектами, присущими НПВП, однако интересен не только ЦОГ-опосредованными механизмами, но и широким спектром дополнительных свойств [8, 9].
Показано, что нимесулид влияет на гуморальное звено воспалительных реакций: уменьшает продукцию провоспалительных цитокинов (ФНО-α, ИЛ-6 ИЛ-8, лейкотриена В4 [10-12]) — и на клеточные реакции: снижение синтеза фосфодиэстеразы IV уменьшает активность макрофагов и нейтрофильных гранулоцитов — важных участников острого воспаления [12, 13].
Нимесулид также снижает активность оксидативных реакций, ингибирует продукцию кислородных радикалов в очаге воспаления, уменьшает синтез лейкотриена С4, продуцируемого эозинофилами [13, 14].
Изученный спектр молекулярных механизмов нимесулида включает влияние и на циклический аденозинмонофосфат и экто-5'-нуклеотидаза/аденозиновый рецептор A2A, и на саму продукцию аденозина, что имеет значение в реализации его противовоспалительного действия [8, 15]. Показано, что противовоспалительные эффекты препарата связаны с повышением чувствительности к эндо- и экзогенным кортикостероидам стероидных рецепторов [8, 15, 16].
Роль гистамина в организме очень велика и связана со множеством физиологических реакций, включая регуляцию продукции соляной кислоты в желудке и функции ряда других органов пищеварительной системы, тонуса дыхательных путей и кровеносных сосудов; гистамин относят к числу медиаторов нервной системы [18, 19]. Значительно лучше изучено значение гистамина при аллергических и иммунных реакциях, к которым относятся и эффекты гистамина в очаге острого и хронического воспаления [8, 18].
Нимесулид ингибирует секрецию гистамина тучными клетками, связанную как с иммунными, так и с неиммунными стимулами, что, очевидно, облегчает болевой синдром [20, 21]. В эксперименте А. de Paulis и соавт. на модели синовиальных тучных клеток человека показано снижение высвобождения гистамина и простагландина D2 и лейкотриена C4 при воздействии различных стимулов. При этом ацетилсалициловая кислота, диклофенак и пироксикам подобного эффекта не обнаруживали [21].
Эти данные могут отчасти объяснять различную активность препаратов, используемых для воздействия на разные патофизиологические аспекты воспалительных артритов. Чуть ранее подобное действие было описано и при моделировании аллергического отека путем внутрикожной инъекции гистамина у здоровых добровольцев: нимесулид значимо сильнее плацебо (физраствора) уменьшал выраженность отека и зуда [22].
Подавление секреции гистамина оказывается полезным при патологии дыхательной системы, включая аллергический ринит и другие компоненты т. н. «аспириновой триады», связанной с перекрестной реакцией как на ацетилсалициловую кислоту, так и на другие препараты группы НПВП.
В эксперименте показано, что нимесулид, в отличие от индометацина, способен снижать сокращение изолированной бронхиальной мускулатуры человека в ответ на воздействие гистамина. Кроме того, в опыте на свиньях он уменьшал бронхоконстрикцию, вызванную ацетальдегидом, снижая высвобождение гистамина из тучных клеток и азофилов [20, 23].
Влияние нимесулида на выраженность симптомов аллергического ринита сопоставимо с таковым цетиризина. Двойное слепое рандомизированное параллельное контролируемое клиническое исследование с двойным контролем в трех группах продемонстрировало, что нимесулид значимо уменьшал выраженность заложенности и выделений из носа, а также чихания у пациентов с аллергическим ринитом к четвертому дню, уступая цетиризину только во влиянии на слезотечение [24].
В ряде исследований доказана возможность безопасного использования нимесулида и в случае предшествующего развития аллергических реакций при приеме других НПВП. По данным G.E. Senna и соавт., назначавших нимесулид 381 больному с предшествующей аллергической реакцией при применении НПВП, в 98,4% случаях это не сопровождалось какими-либо проявлениями аллергии [25].
В сходном исследовании у пациентов с доказанной аспириновой астмой или непереносимостью НПВП введение нимесулида оказалось безопасным у 91,7% наблюдаемых [26].
Оценка показателей бронхиальной проводимости в двойном слепом перекрестном плацебо-контролируемом исследовании с участием 20 пациентов с аспириновой астмой выявила, что нимесулид сравним с плацебо по влиянию на показатели сопротивления дыхательных путей и ОФВ1 (рис.) [27].
Рис. Средние (± стандартная ошибка среднего) изменения сопротивления дыхательных путей (СДП) (A) и объема форсированного выдоха за 1-ю секунду (ОФВ1) (В) после провокационной пробы с плацебо (физраствором), ингаляции раствора лизин-аспирина или приема 100 мг нимесулида [28]
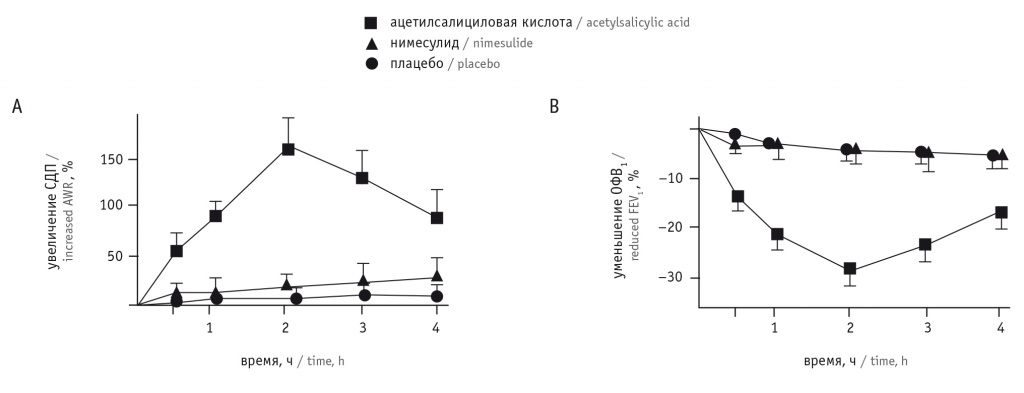
Пероральный нимесулид в дозе 100 мг хорошо переносился как клинически, так и функционально (без значительных изменений ОФВ1 и удельного сопротивления дыхательных путей после приема лекарства), в отличие от ацетилсалициловой кислоты, вызывавшей значительное увеличение сопротивления дыхательных путей (до 150%) и снижение ОФВ1 (до –30% через 2 часа после введения) [27, 28].
Безусловно, уникальный эффект нимесулида в ингибировании выработки гистамина очень важен при оценке рисков поражения ЖКТ, ведь спектр действия гистамина чрезвычайно широк именно в верхних отделах ЖКТ и влияние на его продукцию может иметь дополнительное значение для минимизации этих рисков [29]. В эксперименте показано, что нимесулид уменьшает стимулированную гистамином секрецию соляной кислоты в желудке опытных животных [30]. Исследование, посвященное поиску и оценке средств с гастропротективными свойствами (extract Rumex patientia L.), продемонстрировало, что введение нимесулида даже в очень больших дозах (300 мг/кг) не приводило к развитию НПВП-индуцированных эрозий и язв у экспериментальных животных, в отличие от других НПВП, применявшихся в этой работе (диклофенака, ибупрофена и мелоксикама) [31].
Более поздние исследования (Süleyman H. и соавт.) выявили, что на экспериментальных моделях нимесулид статистически значимо увеличивает противовоспалительный эффект мелоксикама, диклофенака, ибупрофена, при этом уменьшая ульцерогенное действие диклофенака и мелоксикама и предотвращая возникновение язвенных дефектов [32]. В клинической практике одномоментное назначение двух и более НПВП (за исключением топических форм) приводит к повышению риска повреждения ЖКТ и не рекомендовано.
ЗАКЛЮЧЕНИЕ
Значимую роль в реализации противовоспалительного и анальгетического действий нимесулида (Найз®) играет широкий спектр свойств, не связанных с ингибированием ЦОГ-2. Исследования этих уникальных свойств продолжаются, что открывает все более широкие перспективы применения нимесулида (Найз®) в неврологической и широкой терапевтической практике [33-35]. Одним из интересных эффектов следует признать воздействие на секрецию гистамина, связанную как с иммунными, так и с неиммунными механизмами. Это проясняет более выраженное обезболивающее и противовоспалительное влияние нимесулида (Найз®) и невысокий риск побочных явлений со стороны дыхательной и пищеварительной систем.
Поступила: 06.04.2021
Принята к публикаци: 26.04.2021







