ВВЕДЕНИЕ
Остеоартрит (ОА) занимает лидирующие позиции среди причин заболеваемости, потери трудоспособности и инвалидности населения во всем мире. Более 10% взрослого населения земного шара страдают ОА, причем показатели распространенности имеют устойчивую тенденцию к увеличению. Согласно отчетам Минздрава России за 2017 год, ОА — самое распространенное ревматическое заболевание (4 302 821 случай) [1]. По оценкам глобального исследования бремени болезней 2017 года (включено 195 стран), ОА располагается на одиннадцатом месте среди 354 нозологических форм, вызывающих инвалидизацию населения [2]. В нашей стране костно-мышечные заболевания (среди которых значительная доля приходится на ОА) находятся на 3 месте в структуре инвалидности после сердечно-сосудистой и онкологической патологии и являются одной из основных причин временной нетрудоспособности [3]. В 2018 году Управление по контролю качества пищевых продуктов и лекарственных средств США (Food and Drug Administration, FDA) отнесло ОА к серьезным заболеваниям, повышающим риск смертельных исходов, в частности, от кардиоваскулярных катастроф (инфаркта миокарда, острой недостаточности мозгового кровообращения и внезапной коронарной смерти) [4]. Возможными причинами являются длительно существующий болевой синдром, гиподинамия, метаболические и психоэмоциональные нарушения у пациента, а также постоянное низкоинтенсивное воспаление, лежащее в основе патогенеза ОА. За последние десятилетия представления об ОА как о дегенеративном процессе, причины которого часто ассоциировали с возрастом, претерпели значительную эволюцию, и теперь ОА принято считать «воспалительной» болезнью. В связи с этим в 2015 году Международное общество по изучению остеоартрита (Osteoarthritis Research Society International, OARSI) представило новое определение. Согласно ему, ОА — это заболевание суставов, характеризующееся клеточным стрессом и деградацией экстрацеллюлярного матрикса, возникающими при макро- или микроповреждениях, которые активируют ненормальные адаптивные восстановительные процессы, включая провоспалительные пути иммунной системы. Изменения, происходящие первоначально на молекулярном уровне, постепенно приводят к анатомическим и физиологическим нарушениям (деградации хряща, костному ремоделированию, образованию остеофитов, воспалению и т. д.) и развитию заболевания. Кроме того, для этого заболевания характерна высокая коморбидность/мультиморбидность, в которой значимое место отводят метаболическим нарушениям, в частности гиперурикемии (ГУ). Несмотря на то что ОА и ГУ встречаются достаточно часто, патогенетические механизмы взаимосвязи этих состояний изучены недостаточно. Вопрос, играет ли ГУ роль в развитии и прогрессировании ОА, остается предметом дискуссий. В связи с этим все более актуально изучение роли бессимптомной ГУ (когда отсутствуют клинические проявления подагры) при ОА.
На сегодняшний день ГУ определяется при повышении уровня мочевой кислоты (МК) в сыворотке крови более 360 мкмоль/л (> 6 мг/дл) [5]. К наиболее частым причинам, способствующим развитию ГУ, относят ожирение, АГ, метаболический синдром, применение диуретиков и низких доз ацетилсалициловой кислоты, хроническую болезнь почек, пожилой возраст, а также алиментарные факторы, включающие избыточное потребление богатых пуринами и фруктозосодержащих продуктов, алкоголя [6]. Однако лидирующие позиции занимает именно метаболический синдром, для которого характерно нарушение не только углеводного, липидного, но и пуринового обменов.
Количество лиц, имеющих повышенные значения МК, растет во всем мире. Недавние эпидемиологические исследования показали, что ГУ выявляется почти у каждого пятого жителя планеты (21,4%) и аналогично с ОА имеет возрастную зависимость. Так, в США распространенность ГУ в возрасте от 40 до 49 лет составляет 17,9%, а после 85 лет — 36,8% [7].
Важно отметить, что количество информации о взаимосвязи ОА с ГУ постепенно увеличивается [8–10]. В недавно опубликованной крупномасштабной работе (было включено 2213 лиц старше 60 лет, из них у 412 пациентов выявлены повышенные значения МК), проведенной в рамках Третьего национального исследования здоровья и питания в США (National Health and Nutrition Examination Survey III, NHANES III), также продемонстрирована данная ассоциация. Так, рентгенологический ОА (II стадии и выше, по Келлгрену — Лоуренсу) встречался в 44% случаев при ГУ и в 36,3% случаев при нормоурикемии (p = 0,056), а клинический ОА (сочетание рентгенологического ОА и болей в коленном суставе большую часть предшествующих исследованию шести недель) отмечен у 17,4% и 10,9% пациентов соответственно (р = 0,046). В многофакторном анализе авторы подтвердили, что при ГУ почти в 1,7 раза увеличивается коэффициент распространенности (КР) клинического ОА у больных, не страдающих ожирением (КР = 1,66; 95%-ный ДИ: 1,02–2,71) [11]. X. Ding и соавт. [12] в исследовании, включавшем 4685 человек, отметили связь между ГУ и наличием остеофитов коленных суставов, которая оставалась значимой и после поправки на ИМТ, СД (OШ = 1,43; 95%-ный ДИ: 1,01–2,03; р = 0,05). S. Krasnokutsky и соавт. [13] в течение двух лет наблюдали 88 пациентов (у них был исключен диагноз подагры) с ОА коленного сустава и показали, что уровень МК в сыворотке крови значимо коррелирует с сужением суставной щели, по данным рентгенографии (r = 0,40; р < 0,01). Причем было продемонстрировано, что риск быстрой прогрессии (сужение суставной щели за 2 года более чем на 0,5 мм) ОА коленных суставов выше у больных с высокими значениями МК, то есть более 6,8 мг/дл (AUC = 0,68; 95%-ный ДИ: 0,54–0,81; р = 0,01). Кроме того, авторы отметили прямо пропорциональную связь между уровнем МК и объемом синовиальной жидкости, определяемым на МРТ (r = 0,44; р < 0,01). Имеются данные, что у пациентов с ГУ по сравнению с больными с нормоурикемией значимо повышены показатели ИЛ-18 и ИЛ-1β в синовиальной жидкости (одним из возможных механизмов, объясняющих повышение ИЛ, является активация и стимуляция NLRP3 инфламмасом), которые могут способствовать более быстрой деградации хрящевой ткани. Помимо этого, уровни МК и ИЛ, определяемые в синовиальной жидкости, были связаны с тяжестью рентгенологических проявлений ОА коленного сустава: чем выше их значения, тем выше вероятность выявления III–IV стадий ОА [9].
Интересной представляется работа 2019 года, в ходе которой ученые исследовали особенности магнитно-резонансной (МР) картины ОА коленных суставов в зависимости от уровня МК. В исследование было включено 77 пациентов, соответствовавших следующим параметрам: достоверный диагноз ОА коленных суставов (согласно Американской коллегии ревматологов, АКР), возраст 65 лет и моложе, ИМТ менее 25 кг/м2, отсутствие подагры и других ревматических заболеваний, а также травмы анализируемого сустава. Все больные были распределены на две группы: в первую вошли лица с нормальными значениями МК, а во вторую — с повышенными (более 360 мкмоль/л). На фоне ГУ значимо чаще при МР-исследовании коленного сустава выявлялись остеофиты, синовит, эрозии хрящевой ткани и остеит в субхондральных отделах костей. С помощью логистической регрессии была подтверждена взаимосвязь между уровнем МК и синовитом, а также отеком околосуставных мягких тканей (ОШ = 1,017; 95%-ный ДИ: 1,007–1,028 и ОШ = 1,008; 95%-ный ДИ: 1,000–1,016 соответственно). Авторы делают вывод, что при ГУ повышается вероятность более быстрой прогрессии ОА данной локализации, в связи с чем рекомендовано стремиться к нормализации уровня МК [14].
Важно отметить результаты крупного популяционного исследования (AGES-Reykjavik Study), проведенного в 2019 году, в котром H. Jonsson и соавт. анализировали взаимосвязь между ГУ и болью в суставах. Под наблюдением находилось 5170 пациентов, средний возраст которых составил 76 ± 6 лет (от 66 до 96 лет). Корреляционный анализ продемонстрировал, что уровень МК значимо позитивно ассоциируется с возрастом, ИМТ, окружностью талии, уровнями глюкозы, триглицеридов, креатинина, гликированного гемоглобина, СРБ, с использованием антигипертензивных препаратов (тиазидов, петлевых диуретиков, ингибиторов АПФ) и гипогликемических средств), а также с наличием метаболического синдрома и ухудшением общего состояния здоровья. В регрессионном анализе, с учетом возраста, ИМТ и ОА суставов кистей, значения МК более 372 мкмоль/л у женщин независимо увеличивали риск интермиттирующих болей в кистях в целом (OШ = 1,30; 95%-ный ДИ: 1,07–1,58; p = 0,008) и таких же болей более чем в 10 суставах кистей (OШ = 1,75; 95%-ный ДИ: 1,32–2,31; p < 0,001). Исследователи делают заключение, что ГУ у пожилых женщин может быть довольно частой причиной периодических болей в определенных суставах, и это поднимает вопрос о целесообразности лечения бессимптомной ГУ [15].
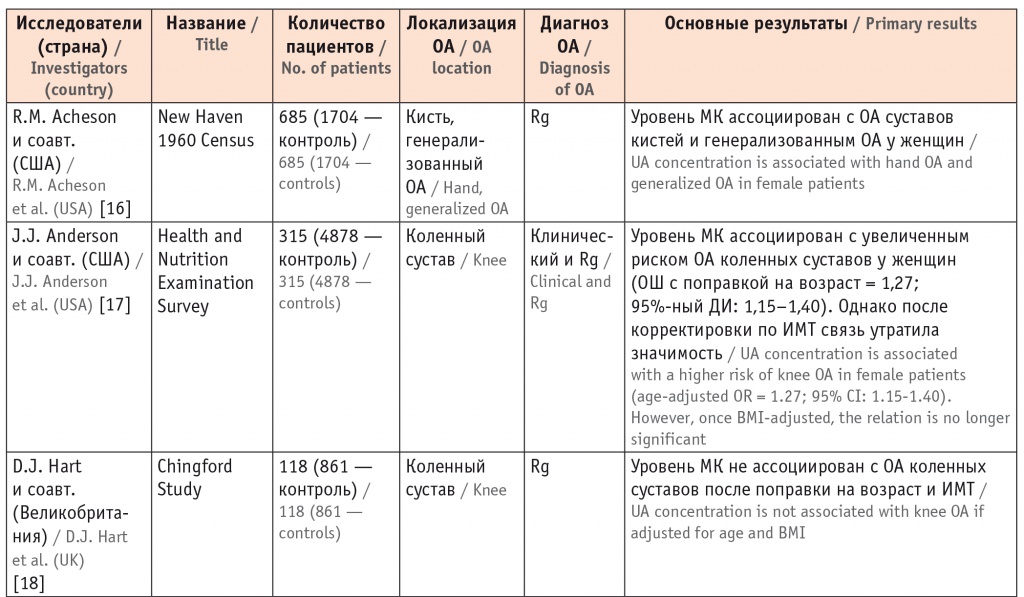
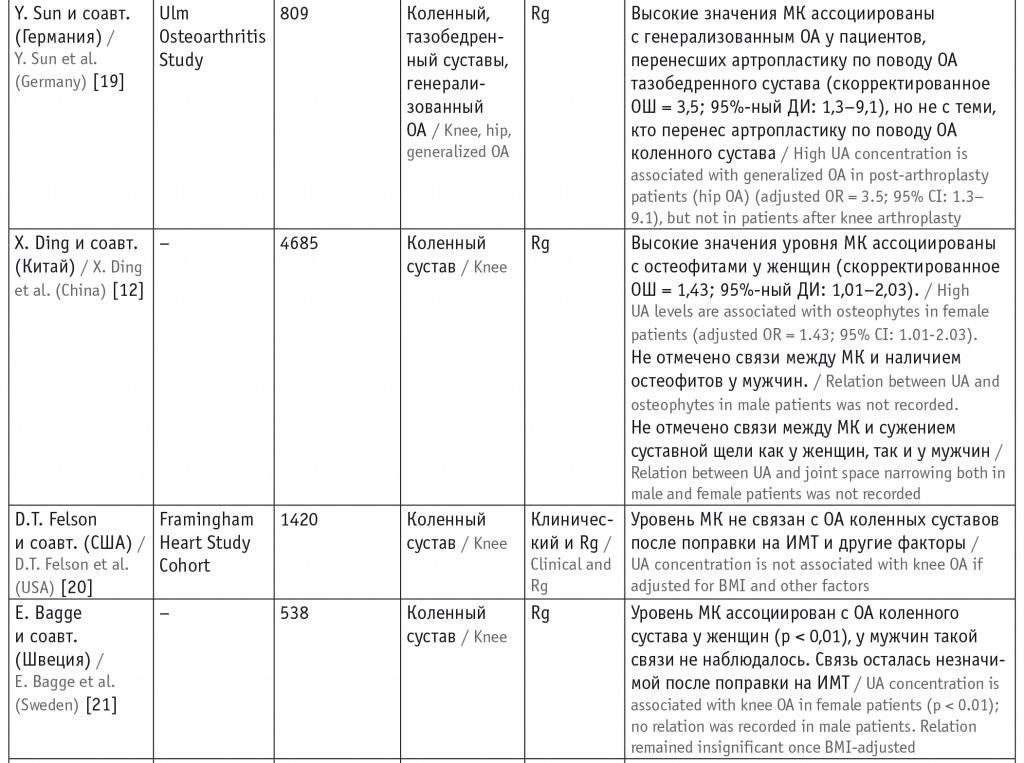
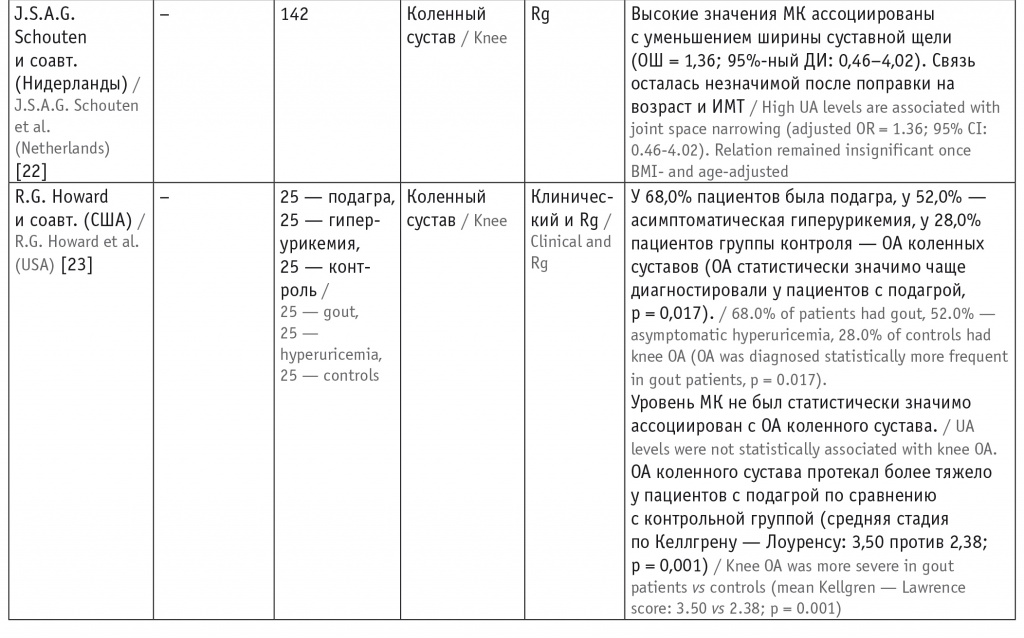
Таким образом, на сегодняшний день существует немало работ, подтверждающих связь между концентрацией МК и развитием/прогрессированием и более тяжелым течением ОА. Однако в некоторых исследованиях не выявлены данные ассоциации, что, конечно, требует дальнейшего изучения этого вопроса (табл. 1).
Таблица 1
Анализ работ, изучающих взаимосвязь между остеоартритом (ОА) и уровнем мочевой кислоты (МК)
В связи с этим в рамках программы «Разработка методов комплексной терапии заболеваний костно-мышечной системы» (НИОКТР АААА-А19-119021190150-6) мы провели предварительную оценку взаимосвязи ГУ с течением ОА коленных суставов и компонентами метаболического синдрома. В проспективное исследование было включено 107 женщин в возрасте 40–75 лет с достоверным диагнозом ОА (в соответствии с критериями АКР) коленных суставов I–III стадии (по Келлгрену — Лоуренсу), подписавших информированное согласие. Средний возраст пациенток составил 59,1 ± 8,9 года (от 40 до 74 лет), средняя длительность заболевания — 9 (4–12) лет. Средние значения ИМТ соответствовали ожирению (30,6 ± 5,7 кг/м2), окружность талии — 93,9 ± 12,1 см. У каждой пациентки была индивидуальная карта, включавшая в себя антропометрические показатели, данные анамнеза и клинического осмотра, оценку боли в коленных суставах по визуально-аналоговой шкале, сопутствующие заболевания. Всем пациенткам проводили стандартную рентгенографию коленных суставов, денситометрию поясничного отдела позвоночника и проксимального отдела бедра, лабораторное обследование с измерением уровней холестерина, триглицеридов, ЛПВП, ЛПНП, глюкозы, МК, АЛТ, АСТ, креатинина, фосфора, кальция, щелочной фосфатазы, СРБ, гликированного гемоглобина, олигомерного матриксного белка хряща (СOMP) в сыворотке крови, ИЛ-6 и лептина.
Статистический анализ проведен в программе Statistica 10.0. Использованы методы описательной статистики, вычислялись минимальные, максимальные и средние значения переменных, стандартных отклонений, медианы, интерквартильного размаха (25-й и 75-й перцентили), а также определялась статистическая значимость различий между средними значениями переменных с помощью t-теста Стьюдента для нормального распределения значений и U-теста по методу Манна — Уитни для распределения, отличающегося от нормального. Для выявления взаимозависимости переменных использовали корреляционный анализ по Спирмену. Для анализа отношений вероятностей в группах рассчитывали относительный риск и 95%-ный ДИ.
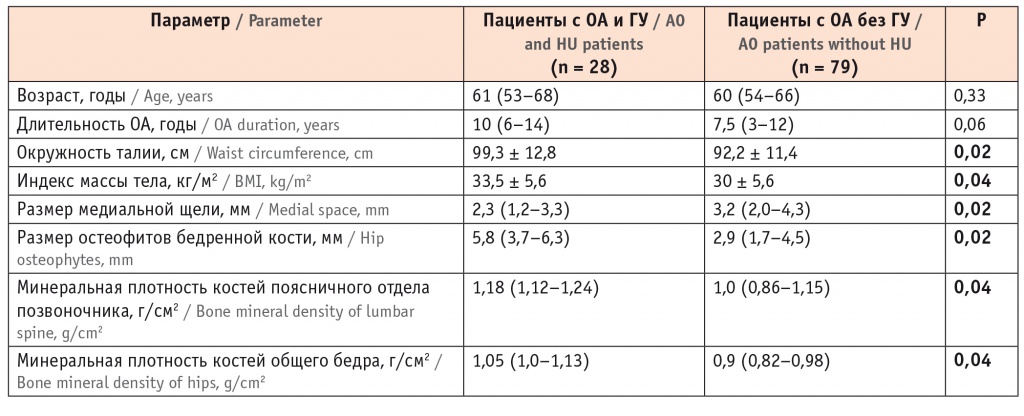
ГУ диагностирована у 26,2% женщин. У пациенток с ГУ (табл. 2) были увеличены ИМТ и окружность талии (p < 0,05). При рентгенологическом обследовании у лиц с ГУ выявлены значимо большие размеры остеофитов (р = 0,02) и меньшие размеры медиальной щели коленного сустава (р = 0,02), при этом пациентки обеих групп были сопоставимы по возрасту и длительности ОА (табл. 2). По данным денситометрии, наличие ГУ связано со статистически значимо более высокими показателями минеральной плотности костей в поясничном отделе позвоночника и в проксимальном отделе бедра (p < 0,05). Метаболический синдром почти в 2 раза чаще диагностировали при повышенных значениях МК (83,3% против 49,2%; относительный риск — 1,71; 95%-ный ДИ: 1,21–2,36). При лабораторном исследовании у пациенток с ГУ по сравнению с пациентками, имевшими нормоурикемию, были зарегистрированы более высокие концентрации СРБ (2,8 (1,9–6,2) против 1,9 (1,2–3,6) мг/л; р = 0,007); СOMP (31,9 (27,6–45) против 24,2 (18,9–38,7); р = 0,05), лептина (46,2 (36,5–72) против 30,5 (19,5–45,6) нг/мл; р = 0,03), триглицеридов (1,97 (1,61–2,41) против 1,26 (0,87–1,63) ммоль/л; р = 0,002), креатинина (79 (74,9–86) против 68 (62–74) ммоль/л; р = 0,0001), АЛТ (26,5 (17,2–32,9) против 17,9 (13,2–21,7) ммоль/л; р = 0,003) и АСТ (22,5 (18,5–27,8) против 18,9 (16,8–21,9) ммоль/л; р = 0,02).
Таблица 2
Сравнительная характеристика пациентов с остеоартритом (ОА) с гиперурикемией (ГУ) и без нее
Анализ корреляций по Спирмену подтвердил взаимосвязь между ГУ и ИМТ (r = 0,22; p = 0,03), окружностью талии (r = 0,26; p = 0,02), метаболическим синдромом (r = 0,29; p = 0,01) и ИБС (r = 0,21; p = 0,04). Кроме того, выявлена связь ГУ с рентгенологической стадией ОА коленных суставов (r = 0,34; p = 0,02), размерами медиальных остеофитов в области бедренной кости (мм) (r = 0,37; p = 0,01) и медиальной щели коленного сустава (мм) (r = -0,27; p = 0,01), с минеральной плотностью костей поясничного отдела позвоночника (r = 0,37; p = 0,03) и общего бедра (r = 0,37; p = 0,04). Отмечены также значимые позитивные ассоциации со следующими лабораторными показателями: с СРБ (r = 0,27; p = 0,007), СOMP (r = 0,25; p = 0,05), лептином (r = 0,29; p = 0,03), креатинином (r = 0,45; p < 0,0001), триглицеридами (r = 0,44; p = 0,0001), АЛТ (r = 0,32; p = 0,002), АСТ (r = 0,25; p = 0,02).
ЗАКЛЮЧЕНИЕ
Таким образом, согласно нашим предварительным данным, ГУ может являться усугубляющим предиктором не только таких ассоциированных с метаболическим синдромом заболеваний, как ожирение, дислипидемия, но и ОА. Так, при высоких значениях МК отмечают более продвинутые рентгенологические стадии ОА, высокие значения МПК осевого скелета и повышенные значения СРБ, СOMP. В связи с этим лечебные интервенции ОА у пациентов с ГУ должны быть направлены также и на снижение концентрации МК, что, возможно, замедлит прогрессирование заболевания. Необходимо дальнейшее изучение этого вопроса. В ФГБНУ «НИИР им. В.А. Насоновой» мы продолжаем изучать эту проблему в рамках длительного проспективного многоцентрового исследования. Расшифровка механизмов, определяющих связь между ГУ и ОА, имеет существенное значение для разработки новых методов профилактики и лечения этих заболеваний.
Поступила: 12.04.2021
Принята к публикации: 26.05.2021








