Системная склеродермия (ССД) — прогрессирующее иммуновоспалительное ревматическое заболевание, которое потенциально может приводить к тяжелому поражению жизненно важных органов, в связи с чем сопровождается снижением качества жизни и имеет неблагоприятный прогноз. Лечение ССД по-прежнему остается трудной задачей, так как применяемые в настоящее время рекомендованные фармакологические препараты не оказывают существенного влияния на течение болезни. Согласно общим принципам, для лечения ССД используют более конкретную органо-специфическую терапию или агенты более общего действия, модифицирующие течение болезни: иммуномодулирующие, иммуносупрессивные, антифиброзные средства и др. [1]. Принципы органо-специфической терапии подробно изложены в рекомендациях European League Against Rheumatism (EULAR), в ряде национальных рекомендаций, включая рекомендации Ассоциации ревматологов России, а также в более поздних международных рекомендациях экспертов [2, 3, 4]. Эта терапия включает применение вазоактивных препаратов при феномене Рейно и его осложнениях (дигитальных язвах, некрозах), ингибиторы протонной помпы при желудочно-пищеводном рефлюксе, ингибиторы АПФ при остром почечном кризе, специфические сосудорасширяющие средства при легочной АГ, противовоспалительные средства при развитии артрита и иммуносупрессивные препараты при интерстициальных пневмониях. Со времени обновления последних рекомендаций EULAR по фармакотерапии ССД прошло около 5 лет [2]. Все это время активно продолжались поиски эффективных методов лечения, направленных на коррекцию патологических иммунорегуляторных нарушений, изучались биологические агенты, воздействующие на иммунные клетки и/или патогенные медиаторы (таргетные препараты) и способствующие улучшению регенерации тканей, поврежденных в процессе иммунного воспаления. В опубликованных в 2016–2020 гг. многочисленных исследованиях, включая рандомизированные контролируемые исследования (РКИ), представлены обнадеживающие результаты применения новых методов и препаратов, ориентированных на главные составляющие патогенеза заболевания — воспаление, иммунорегуляторные нарушения и избыточное фиброзирование. В обзоре основное внимание уделено проблемам, связанным с применением аутологичной трансплантации гемопоэтических клеток костного мозга, а также новым таргетным препаратам, в том числе антифибротическим, еще не вошедшим в клинические рекомендации.
ИММУНОАБЛЯЦИЯ С ПОСЛЕДУЮЩЕЙ АУТОЛОГИЧНОЙ ТРАНСПЛАНТАЦИЕЙ СТВОЛОВЫХ КЛЕТОК КОСТНОГО МОЗГА
Метод высокодозной химиотерапии с последующей аутологичной трансплантацией гемопоэтических стволовых клеток (ауто-ТГСК) относят к эффективным методам лечения тяжелых аутоиммунных заболеваний, включая ССД. В основе метода лежит интенсивная иммуносупрессия с последующим восстановлением иммунной системы с помощью гемопоэтических стволовых клеток, то есть «перезагрузка» иммунной системы [5]. По-видимому, подавление аберрантных аутоиммунных клеток приводит к восстановлению иммунологической толерантности и «неаутореактивной» иммунной системы. При ССД возникающие после ауто-ТГСК изменения в иммунной системе отражают позитивные сдвиги в иммунорегуляторных механизмах и сопровождаются клиническим улучшением или даже ремиссией заболевания. Эффективность ауто-ТГСК при ССД была доказана в двух контролируемых клинических испытаниях [6, 7]. В этих исследованиях было показано, что у пациентов с быстро прогрессирующей ССД и высоким риском развития органной недостаточности ауто-ТГСК более эффективна, чем лечение циклофосфаном, и улучшает прогноз заболевания. Эти очевидные преимущества метода позволили включить ауто-ТГСК в последние рекомендации EULAR по лечению ССД [2]. Более позднее исследование подтвердило хорошие результаты ауто-ТГСК при ССД [8]. Можно считать доказанным, что ауто-ТГСК в настоящее время — единственная болезнь-модифицирующая стратегия лечения диффузной формы ССД, улучшающая кожный счет и легочную функцию, предупреждающая прогрессирование органных поражений и улучшающая долгосрочный прогноз. Однако после появления в рекомендациях перспективного метода стало очевидно, что показания для его использования недостаточно четко определены. Поскольку применение метода сопровождается высокой летальностью, связанной с лечением (3–10%), его нужно использовать с большой осторожностью. Риск смерти, связанный с трансплантацией, в значительной степени объясняется кардиоваскулярными осложнениями. Перед назначением ауто-ТГСК крайне важно правильно оценить работу сердца. Опыт, полученный к настоящему времени, отражен в текущих рекомендациях The European Society for Blood and Marrow Transplantation по корректной и углубленной оценке сердечно-легочной системы перед ауто-ТГСК. В них приведен обязательный комплекс обследований: функциональные легочные тесты, ЭхоКГ, МРТ сердца и другие инвазивные тесты для оценки гемодинамики [9]. Согласно этим рекомендациям, только пациенты без каких-либо признаков легочной гипертензии, что должно подтверждаться катетеризацией правых отделов сердца с нагрузкой, и с хорошей сердечно-легочной функцией могут считаться подходящими кандидатами для ауто-ТГСК. В противном случае у больных ССД есть высокий риск осложнений и смерти на фоне ауто-ТГСК. Этот риск связан также с интенсивностью режимов кондиционирования, токсичность которых определяется исходной тяжестью поражения внутренних органов, стадией и активностью заболевания. Поэтому метод не может применяться широко и противопоказан больным с выраженными или необратимыми органными поражениями (то есть в качестве «терапии отчаяния»). Все вышесказанное объясняет, почему, несмотря на рекомендации, сложно применять ауто-ТГСК в роли стандартной терапии для лечения ССД. Как следует из критериев включения в РКИ, к наиболее перспективным для ауто-ТГСК можно отнести больных на ранней стадии с диффузной формой ССД быстро прогрессирующего течения, с факторами неблагоприятного прогноза. При внедрении этого метода важно учитывать его высокую стоимость, а также то, что ауто-ТГСК возможно применять только в узкоспециализированных экспертных центрах, обладающих достаточным опытом подобного лечения. По данным мультивариантного анализа, риск смерти, сохранявшийся в течение 100 дней, был статистически значимо ниже, а общая выживаемость выше (p < 0,0001) в центрах, где уже есть накопленный опыт трансплантаций [10]. Ауто-ТГСК — важная новая перспектива в лечении ССД, однако ряд трудностей требует разрешения для более широкого применения метода. Актуальные проблемы ауто-ТГСК и пути их разрешения суммированы в таблице [11].
Таблица
Проблемы и перспективы на пути внедрения аутологичных гемопоэтических стволовых клеток (ауто-ТГСК) при системной склеродермии [11]
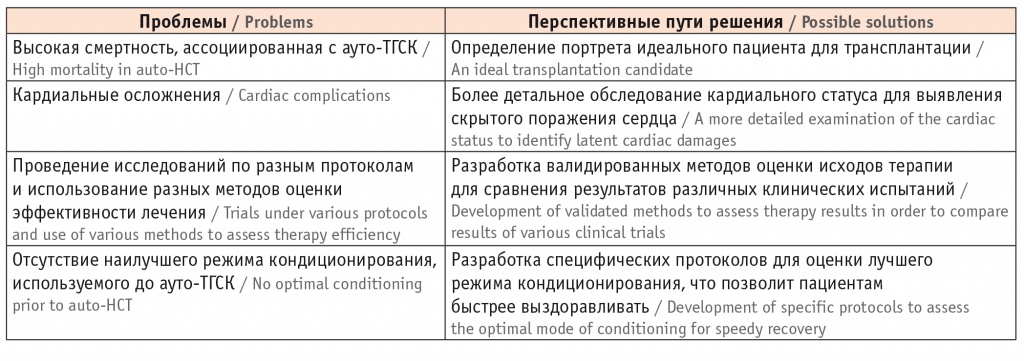
Внедрение ауто-ТГСК тормозится тем, что за пределами проведенных РКИ пока остались важные научные и практические вопросы [12]. Так, пока не найден ответ на фундаментальный вопрос: есть ли «окно возможностей» для перезагрузки иммунной системы? Когда ответ будет получен, то станет понятно, нужно ли назначать ауто-ТГСК как терапию первой линии у пациентов высокого риска или лучше зарезервировать этот метод на случай неэффективности рутинной иммуносупрессии. Если рассматривать ауто-ТГСК как лечение второй линии, то на основании каких критериев и когда следует переходить к ауто-ТГСК после стандартной терапии? В практическом плане нужно определить, как потенциально соответствующие критериям отбора пациенты могут вовремя осуществить ауто-ТГСК? В настоящее время в России не отработан механизм маршрутизации больных, хотя существуют экспертные центры высокого уровня. В реальной практике необходимы специфичные и валидированные критерии отбора для этой терапии, чтобы оптимизировать отбор пациентов и включать тех, кто имеет большие шансы на хороший ответ. Решение назначить ауто-ТГСК требует тщательного обсуждения потенциальных выгод и возможных рисков с пациентами и их семьями и в конечном счете зависит от общего решения и осознанного информированного согласия пациента. По мере накопления опыта безопасность ауто-ТГСК улучшается, а риск смерти снижается благодаря более строгому отбору пациентов на этот вид лечения и улучшению последующей поддерживающей терапии. В перспективе работа специализированных центров с большим опытом трансплантации стволовых клеток и тесное взаимодействие между различными специалистами на всех этапах курации больного смогут уменьшить риск смерти, связанной с лечением, и улучшить исход терапии ССД [13].
ИММУНОСУПРЕССИВНЫЕ ПРЕПАРАТЫ
Применение иммуносупрессантов остается важным стратегическим направлением в лечении ССД, особенно при поражении кожи и внутренних органов, в первую очередь при интерстициальных заболеваниях легких, ассоциированных с ССД (ИЗЛ–ССД) [1, 4, 14]. В настоящее время в качестве иммуносупрессивного препарата первой линии используется микофенолата мофетил — пролекарство микофеноловой кислоты. Проспективные и ретроспективные исследования продемонстрировали, что микофенолата мофетил эффективен при ССД, так как способствует улучшению или стабилизации функции легких [15]. В ретроспективных исследованиях показано улучшение 5-летней выживаемости на фоне приема микофенолата мофетила. В 2016 году были опубликованы данные большого РКИ (n = 142), в котором напрямую сравнивали результаты терапии циклофосфаном (в таблетках в дозе ≤ 2 мг/кг в сутки в течение 12 месяцев, затем плацебо в течение 12 месяцев) и микофенолата мофетилом (в таблетках в дозе 2–3 г/сут в течение 24 месяцев) у больных ИЗЛ–ССД. Итогом оказалось статистически значимое улучшение легочной функции и уменьшение одышки. Уплотнения кожи в обеих группах не имели существенных различий [16]. В то же время у принимающих микофенолата мофетил зарегистрировано меньше побочных реакций (включая лейкопению и тромбоцитопению) и случаев прекращения лечения из-за нежелательных явлений, при этом число нежелательных явлений статистически значимо различалось между обеими группами. При общей благоприятной переносимости в ряде случаев на фоне терапии микофенолата мофетилом наблюдались желудочно-кишечные расстройства, миелосупрессия и повышение риска возникновения инфекций. Результаты этого РКИ не вошли в последние рекомендации EULAR, так как появились после их публикации.
Несмотря на то что циклофосфан перестал рассматриваться как препарат первой линии, он остается на втором месте среди современных средств лечения ССД, имея достаточно прочную доказательную базу. Эта база основана не только на большом предшествующем опыте, но и на результатах двух плацебо-контролируемых РКИ [17, 18]. В одной из недавних работ 148 пациентов, получавших циклофосфан в разных РКИ, были объединены в одну группу. Субанализ терапии убедительно продемонстрировал, что, несмотря на позитивные сдвиги на фоне лечения, после его прекращения эффект не сохранялся и было необходимо продолжение терапии. Длительность курса лечения циклофосфаном определяется его эффективностью и переносимостью и может составлять от 6–12 месяцев до нескольких лет. На фоне лечения циклофосфаном отмечено большое количество побочных эффектов [19]. У пациентов, получающих циклофосфан, повышен риск возникновения инфекционных осложнений, гипофункции половых желез и развития злокачественных опухолей [20]. После окончания курса лечения циклофосфаном, а также в случае его неэффективности или непереносимости возможно применение других иммуносупрессивных препаратов. Однако азатиоприн, циклоспорин А, метотрексат и гидроксихлорохин имеют слабую доказательную базу. По-видимому, поддерживающее лечение этими иммуносупрессантами может сохранить позитивный эффект терапии циклофосфаном, однако между ними не выявлено четких различий [21]. Схемы приема, длительность, комбинации и переключения иммуносупрессивных препаратов определяются эмпирически и не стандартизированы. В целом иммуносупрессанты в большей степени могут стабилизировать легочную функцию или на время незначительно замедлить прогрессирование ИЗЛ–ССД, но не обладают существенным модифицирующим влиянием на течение болезни.
ТАРГЕТНЫЕ ПРЕПАРАТЫ
В связи с ограниченными возможностями иммуносупрессивной терапии в настоящее время ученые активно изучают новые подходы, которые потенциально могут влиять на фундаментальные процессы, лежащие в основе болезни, в частности тормозить активность ключевых клеток или внутриклеточных путей, участвующих в процессах воспаления и фиброзообразования. Полагают, что медиаторы воспаления, клеточной активации, активации фибробластов, сосудистого ремоделирования могут быть потенциальными мишенями, воздействие на которые приведет к подавлению патологических процессов при ССД в целом и при ИЗЛ в частности. На разных этапах клинических испытаний находится множество генно-инженерных биологических и синтетических таргетных препаратов с разными механизмами действия [22]. Некоторые из них уже применяют в клинической практике, например ритуксимаб, тоцилизумаб и абатацепт, хотя ни один из них пока не зарегистрирован для лечения ССД. В этой связи следует отметить, что в настоящее время нет ни одного разрешенного к применению препарата, модифицирующего течение ССД. Учитывая этот факт, а также тяжесть и плохой прогноз больных с прогрессирующим течением, применение потенциально эффективных, но пока незарегистрированных препаратов, представляется этически оправданным при неэффективности или невозможности проведения стандартной терапии.
Ритуксимаб — моноклональные антитела к рецептору В-лимфоцитов CD19. Полученные к настоящему времени результаты свидетельствуют о том, что на фоне лечения ритуксимабом улучшалось общее состояние, уменьшался кожный синдром, купировалось суставное и/или мышечное воспаление и тормозилось прогрессирование фиброза внутренних органов, улучшалась или стабилизировалась легочная функция при хорошем соотношении риск/польза [23, 24, 25]. При сравнении эффективности ритуксимаба и циклофосфана у пациентов с ИЗЛ–ССД было отмечено статистически значимое преимущество первого [26]. Число пациентов, имевших значимое улучшение легочной функции, оцениваемой по ФЖЕЛ, и увеличение ФЖЕЛ > 10% в группе ритуксимаба было в 4 раза больше, чем в группе циклофосфана (р = 0,038). Одновременно статистически значимое улучшение на фоне лечения ритуксимабом зафиксировано при оценке теста 6-минутной ходьбы, кожного счета и счета тяжести. Переносимость ритуксимаба была лучше, а количество всех нежелательных явлений, кроме инфузионных, — меньше, чем в группе пациентов, принимавших циклофосфан. Российский опыт также показал, что через год лечения у больных, получавших ритуксимаб, по сравнению с пациентами, проходившими лечение традиционными методами, функция легких улучшалась или стабилизировалась [27]. По-видимому, при более длительном лечении ритуксимабом результаты могут быть еще лучше. Об этом свидетельствуют данные D. Daoussis и соавт. [24], которые установили, что на фоне лечения ритуксимабом в течение 4-х лет ФЖЕЛ в среднем продолжала медленно нарастать, тогда как в группе сравнения, где больные получали традиционную терапию, этот показатель снижался. В настоящее время проводится РКИ RECITAL, в котором сравниваются эффективность и переносимость ритуксимаба и циклофосфана у пациентов с ИЗЛ, ассоциированными с разными системными ревматическими заболеваниями [28]. Цель этого исследования — подтвердить эффективность внутривенного введения ритуксимаба по сравнению со стандартной терапией циклофосфаном внутривенно, а также оценить возможные экономические преимущества ритуксимаба по сравнению со стандартной терапией. В 2016–2017 гг. большая группа экспертов рассмотрела различные алгоритмы лечения ИЗЛ–ССД и пришла к заключению, что микофенолата мофетил, циклофосфан внутривенно и ритуксимаб должны использоваться в качестве индукционной терапии первой, второй и третьей линий, а микофенолата мофетил, азатиоприн и циклофосфан (внутривенно или в таблетках) — в качестве поддерживающей терапии первой, второй и третьей линий соответственно [4]. Тоцилизумаб — моноклональное антитело к рецептору IL-6, которое успешно применяется для лечения ревматоидного артрита и других аутоиммунных заболеваний. Первый опыт применения тоцилизумаба у некоторых больных ССД показал его эффективность при рефрактерных формах артрита, перекрестных формах ССД с ревматоидным артритом, дерматополимиозитом и васкулитами [29, 30]. Эффективность и переносимость тоцилизумаба у больных с диффузной формой ССД в ранней стадии была изучена в двух клинических испытаниях, в которых первичной точкой оценки эффективности было улучшение кожного счета. В РКИ FaSScinate было продемонстрировано, что прием тоцилизумаба на протяжении 48 недель приводил к клинически значимому уменьшению кожного счета (хотя и статистически незначимому по сравнению с группой плацебо), и в этой группе было значимо меньше больных со снижением ФЖЕЛ > 10% за период наблюдения, чем в группе плацебо [31]. В группе плацебо отмечали снижение ФЖЕЛ, в то время как у получавших тоцилизумаб функция легких оставалась стабильной [32]. Были также показаны относительная безопасность и хорошая переносимость препарата при ССД после 6–12 месяцев лечения, хотя частота серьезных инфекций была статистически значимо выше, чем в группе плацебо. Это РКИ продолжили в открытой фазе, в которой все больные с 48-й по 96-ю неделю получали тоцилизумаб. В совокупности с результатами первых 48-ми недель двойного слепого исследования итоги открытой фазы подтвердили, что тоцилизумаб уменьшает проявления фиброза кожи и легких и улучшает физическую функцию у пациентов с ССД, однако в то же время был отмечен повышенный риск развития серьезных инфекций [33]. В целом имеющиеся результаты позволяют рассматривать тоцилизумаб как перспективный препарат для лечения ССД. В марте 2021 года, после завершения III фазы РКИ, посвященного применению тоцилизумаба при ССД [32], и после того как были получены доказательства его тормозящего влияния на ФЖЕЛ, тоцилизумаб был рекомендован авторитетной организацией Food and Drug Administration для лечения ИЗЛ, ассоциированного с ССД1.
Неадекватный подбор больных для таргетной терапии в РКИ может приводить к неоднозначным или негативным результатам, если у пациента нет точки приложения для воздействия таргетного препарата. Важность адекватного подбора больных, в частности, может быть прослежена на примере изучения эффективности абатацепта в рандомизированном плацебо-контролируемом исследовании II фазы у больных с ранней стадией диффузной ССД [34]. Через год после начала терапии выраженность кожного счета у больных в сравниваемых группах не различалась, хотя у пациентов, получавших абатацепт, было статистически значимое улучшение таких показателей, как Health Assessment Questionnaire for Rheumatoid Arthritis, HAQ-DI, и комбинированный индекс Composite Response Index in Systemic Sclerosis, CRISS, предложенный Американским колледжем ревматологии (American College of Rheumatology) для оценки эффективности терапии при диффузной форме ССД. В этом РКИ, наряду с оценкой кожного счета, определяли присущий этому заболеванию профиль экспрессии генов в кожных биоптатах, взятых до лечения и спустя год после его начала (n = 84). Исходно превалировали воспалительный (у 39% больных) и нормоподобный (у 39% больных) субтипы, и у 21% определился фибропролиферативный субтип. На фоне лечения абатацептом у пациентов с воспалительным и нормоподобным профилями экспрессии генов плотность кожи (кожный счет) статистически значимо снижалась по сравнению с группой плацебо, а у больных с фибропролиферативным субтипом различий с группой плацебо не было. В то же время при фибропролиферативном профиле экспрессии генов была тенденция к увеличению ФЖЕЛ, в отличие от больных с другими субтипами, у которых ФЖЕЛ снижалась. В этом РКИ было показано, что классификация больных по профилю экспрессии генов в кожных биоптатах может предсказать различный ответ на таргетную биологическую терапию. В перспективе это может быть использовано при отборе больных для клинических испытаний и в клинической практике [34].
Значительные достижения в понимании патогенеза ССД в последние годы способствовали созданию и исследованиям большого ряда новых таргетных препаратов для лечения ССД [35]. В качестве интересного примера можно привести in vivo и in vitro изучение рецептора лизофосфатидной кислоты (LPA1), активно участвующего в патогенезе ССД. Возможность использования селективного орального антагониста LPA1 (название продукта — SAR100842) была недавно исследована во второй фазе двойного слепого РКИ, включившего 32 пациента с ССД. По предварительным результатам, выраженность кожного фиброза у пациентов, получавших препарат, и у пациентов из группы плацебо, статистически не различалась. Однако у больных, получавших препарат, экспрессия генов, участвующих в патологических кожных процессах, уменьшилась по сравнению с пациентами из группы плацебо, при этом препарат хорошо переносился. Это исследование свидетельствует о потенциальной роли SAR100842 в лечении кожных проявлений ССД [36].
Ученые исследуют эффективность ряда других молекул и соединений с различными механизмами действия в продолжающихся или недавно закончившихся РКИ II и III фаз, результаты которых носят предварительный характер или еще не опубликованы. Так, в одном из последних обзоров приведены данные по использованию препаратов ланифибранор и ифетробан [37]. В исследовании FASST (включившем 132 больных с диффузной ССД) изучали эффективность ланифибранора — агониста рецепторов, активирующих пролиферацию пероксисом (peroxisome proliferator-activated receptor, PPAR). Эти рецепторы относятся к ядерным транскрипционным факторам и представляют собой группу внутриядерных белков из семейства ядерных гормональных рецепторов. Ифетробан, антагонист тромбоксан-простаноид рецептора (thromboxane-prostanoid receptor, TPr), испытывали на выборке из 34 больных, включая пациентов с легочной АГ. Активация TPr увеличивает транзит кальция в клетку и обладает проаритмическим и профиброзным потенциалами. Предполагается, что антагонист TPr может уменьшить фиброзирование и улучшить, в частности, сердечную функцию у больных ССД. Эффективность и безопасность препарата ленабасум (n = 42) изучали в течение 12 недель в рандомизированном плацебо-контролируемом исследовании II фазы у больных с диффузной формой ССД. Предварительные результаты свидетельствуют о положительной динамике проявлений у лиц, получавших ленабасум [38]. Это малая молекула, которая избирательно связывается в качестве агониста с каннабиноидным рецептором типа 2 (CB2). Молекула была разработана, чтобы подавлять воспаление, ограничивать фиброз и улучшать репарацию тканей. Эффективность и безопасность препарата ленабасум в настоящее время изучается в рамках международного многоцентрового исследования III фазы RESOLVE-1.
Наряду с перечисленными выше развернуты обширные теоретические исследования и пилотные испытания препаратов, действующих на различные потенциально ключевые точки — рецепторы факторов роста, протеасомы, интегрины, онкостатин М, различные IL, рецепторы B- и Т-лимфоцитов [39, 40].
АНТИФИБРОТИЧЕСКИЕ ПРЕПАРАТЫ
В основе патогенетических нарушений и клинических проявлений ССД, наряду с изменениями в микроциркуляторном русле и развитием системного иммунного воспаления, лежит фиброзирующий процесс в коже и внутренних органах. Именно фиброзирование, то есть избыточный синтез коллагена и других внеклеточных матричных белков в соединительной ткани различных органов, является основным прогрессирующим процессом, который приводит к ухудшению функции пораженных органов. В настоящее время стратегии подавления фиброза включают модуляцию иммунного воспаления (иммунологические мишени), вызывающего фиброз, подавление профиброзных ростовых факторов (трансформирующего фактора роста TGF-β, фактора роста фибробластов, тромбоцитарного фактора роста и др.), предупреждение избыточного синтеза белков экстрацеллюлярного матрикса активированными фибробластами, коррекцию нарушений эпигенома и др. [35]. Изучение патогенетических путей фиброгенеза привело к открытию ряда малых молекул, ингибирующих ростовые факторы и эффективно подавляющих легочный фиброз. Одна из этих молекул — нинтеданиб — является тройным ингибитором ангиокиназы, блокирующим рецепторы фактора роста эндотелия сосудов 1–3 (VEGFR 1–3), рецепторы тромбоцитарного фактора роста α и β (PDGFR α и β) и рецепторы фактора роста фибробластов 1–3 (FGFR 1–3), через которые реализуется активность киназы. Нинтеданиб влияет на общие патогенетические черты ИЗЛ — эндогенную и цитокин-индуцированную активацию фибробластов, аккумуляцию миофибробластов и отложение компонентов экстрацеллюлярного матрикса в соединительной ткани легких. Имеющиеся теоретические предпосылки послужили основанием для проведения РКИ SENSCIS с участием больных, у которых было прогрессирование ИЗЛ–ССД. В этом рандомизированном плацебо-контролируемом исследовании III фазы участвовало 576 пациентов из 32 стран [41]. В группе плацебо легочная функция ухудшалась, что определяли по снижению ФЖЕЛ в течение года (на 93,3 ± 13,5 мл/год), а в группе нинтеданиба снижение ФЖЕЛ было менее выраженным — на 52,4 ± 13,8 мл/год (р = 0,04). Эти данные подтвердили, что препарат подавляет прогрессирование ИЗЛ–ССД. Интересно, что самый выраженный эффект был отмечен в подгруппе пациентов, получавших одновременно микофенолата мофетил и нинтеданиб. Заметного влияния нинтеданиба на другие проявления ССД не получено (показатели диффузионной способности легких (ДСЛ) и кожного счета, а также дигитальные язвы оставались практически без изменений), поэтому данное исследование не позволяет пока расценивать нинтеданиб как болезнь-модифицирующий препарат. Желудочно-кишечные проявления (диарея легкой или средней степени тяжести, тошнота, рвота) являются наиболее распространенными неблагоприятными событиями. Реже встречаются повышение уровня трансаминаз, запор, снижение массы тела. Прекратили терапию из-за побочных эффектов (в основном из-за диареи) 16% больных основной группы. Серьезные побочные эффекты в основной группе зарегистрированы у 24% пациентов с ССД, в группе плацебо — у 21,5%. Таким образом, способность нинтеданиба сдерживать прогрессирование ИЗЛ–ССД и относительно неплохая переносимость позволяют рекомендовать его для использования при фиброзирующем прогрессирующем процессе в легких при ССД.
В 2019 году нинтеданиб был зарегистрирован в Российской Федерации для лечения ИЗЛ–ССД, а в 2020 году — для лечения других хронических фиброзирующих ИЗЛ с прогрессирующим фенотипом, в том числе при системных иммуновоспалительных ревматических заболеваниях. Нинтеданиб назначают пациентам с признаками прогрессирующего фиброза легких. Место нинтеданиба в лечении ССД изучается. На основании данных литературы российские эксперты предложили назначать нинтеданиб больным ССД с прогрессирующим течением интерстициальной пневмонии, верифицированной по КТ высокого разрешения, с клиническими проявлениями (одышкой, кашлем) и рестриктивными изменениями (ФЖЕЛ ≤ 70% и/или ДСЛ ≤ 60%) на момент диагностики [42].
В настоящее время ученые продолжают изучать методы воздействия на TGF-β, который является ключевым цитокином в процессах фиброзообразования, и исследуют его эффекты при ССД. Блокирование TGF-β на моделях приводит к предупреждению развития фиброза или к его уменьшению. Проходит испытание II фазы препарат абитузумаб (анти-интегрин αVβ6), который тормозит связывание TGF-β c αβ-гетеродимерами, предупреждая активацию TGF-β2. Мишенью препарата P144 является изоформa TGF-β13, а фрезолимумаб (GC1008) воздействует на все три изоформы: TGF-β1, TGF-β2 и TGF-β3 [43]. К препаратам, которые участвуют в блокаде TGF-β-стимулированного синтеза коллагена, относится пирфенидон — малая молекула, которая снижает уровень TGF-β1 и ингибирует пролиферацию фибробластов и синтез коллагена, уменьшает воспаление путем ингибирования синтеза транслокации рецептора TNF-α и IL-1β и других факторов воспаления. Пирфенидон зарегистрирован в России для лечения идиопатического легочного фиброза, его способность замедлять прогрессирование фиброза легких доказана в трех высококачественных РКИ. Описаны противоречивые результаты применения пирфенидона при ССД. Переносимость и безопасность пирфенидона при ИЗЛ–ССД изучали в 16-недельном открытом рандомизированном исследовании LOTUSS [44]. Общая частота нежелательных явлений была высокой и составила 97%, из них связанных с лечением было 68%, однако отменен препарат был только в 9,5% случаев. Были получены статистически значимые различия в улучшении кожного счета, ФЖЕЛ и ДСЛ у больных, одновременно принимавших пирфенидон и микофенолата мофетил, по сравнению с больными, получавшими монотерапию пирфенидоном. В настоящее время пирфенидон в сочетании с микофенолата мофетилом проходит испытание в новом РКИ, SLS III4. Пирфенидон пока не зарегистрирован в России для лечения ССД.
ТРАНСПЛАНТАЦИЯ ЛЕГКИХ
При неэффективности всех методов терапии, неуклонном прогрессировании легочного фиброза и развитии дыхательной недостаточности показана трансплантация легких при отсутствии выраженной патологии других внутренних органов. Этот пока малодоступный метод остается последним шансом для больных с терминальной стадией заболевания. Постоянно накапливающиеся данные свидетельствуют, что выживаемость у пациентов с ИЗЛ–ССД не отличается от таковой у пациентов с ИЗЛ другой этиологии [45]. К специфическим факторам, ассоциированным с повышенным риском посттрансплантационной смертности при ИЗЛ–ССД, относят более пожилой возраст и увеличенный ИМТ [46]. Полагают, что при ССД выраженная дисфункция пищевода и тяжелый желудочно-пищеводный рефлюкс ухудшают исход трансплантации легких. В то же время установлено, что у больных ИЗЛ–ССД тяжесть пищеводной дисфункции, определенная по морфометрическим или манометрическим критериям, не ассоциируется со снижением выживаемости после трансплантации легких. Острая реакция отторжения и инфекции — это наиболее частые осложнения. Функциональные легочные тесты, как правило, имели стабильные показатели после трансплантации. Медиана выживаемости в одном из исследований составила 2,4 (0,7–3,7) года. Не было найдено различий в выживаемости у пациентов с ИЗЛ–ССД и у пациентов, которым трансплантацию легких проводили в связи с другими причинами [47].
ЗАКЛЮЧЕНИЕ
Современный этап в изучении ССД сопровождается постоянно увеличивающимся числом РКИ, изучающих новые препараты, а также появлением новых перспективных подходов к терапии различных проявлений заболевания. В то же время сохраняется потребность в расширении арсенала методов, улучшающих течение болезни за счет коррекции патологических иммунорегуляторных нарушений. По-прежнему за рамками существующих рекомендаций остается обоснованное применение нефармакологических методов лечения функциональных нарушений и коморбидных состояний (сердечно-сосудистых заболеваний, депрессии, остеопороза, хронической боли и др.). Объединение усилий ученых, врачей и пациентов в международном масштабе, новые РКИ и многоцентровые программы дают основание надеяться на прогресс в курации и на улучшение прогноза ССД.
Поступила: 16.02.2021
Принята к публикации: 06.04.2021








