Цель статьи — определить место рчЭПО в современной тактике терапии АБ на основе анализа литературных данных и собственного опыта.
ПАТОГЕНЕТИЧЕСКОЕ ОБОСНОВАНИЕ ПРИМЕНЕНИЯ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО ЭРИТРОПОЭТИНА ДЛЯ ЛЕЧЕНИЯ АНЕМИИ БЕРЕМЕННЫХ
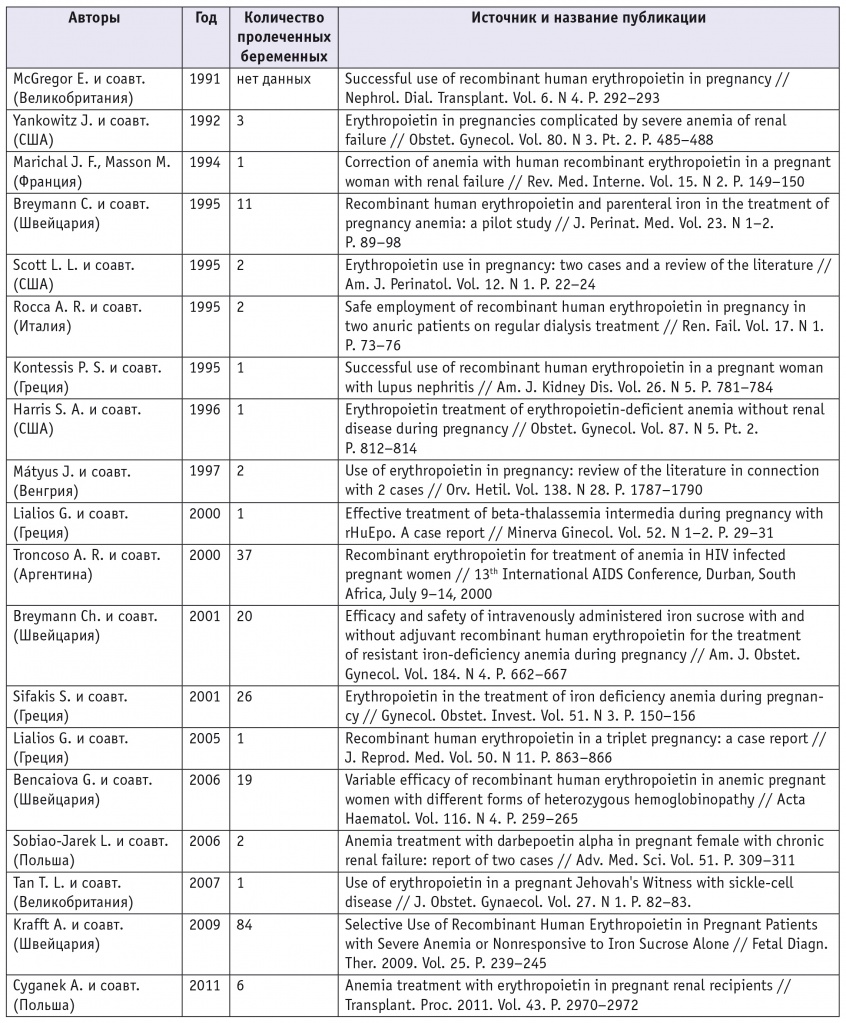
Эритропоэтин (ЭПО) — гормон гликопротеидной природы, основной регулятор эритропоэза. У взрослых ЭПО синтезируется в почках под влиянием гипоксии. В результате взаимодействия с эритропоэтиновым рецептором (ЭПО-Р), расположенным на поверхности эритроидных клеток-предшественников костного мозга, происходят их дифференцировка, пролиферация и созревание [9]. В 1977 г. Miyake и соавт. выделили из мочи пациентов с апластической анемией ЭПО, а в 1983 г. был клонирован ген человеческого ЭПО, что позволило применять рчЭПО в клинической практике. В 1989 г. Food and Drug Administration (Управление по контролю качества пищевых продуктов и лекарственных препаратов США) впервые разрешило применение рчЭПО для лечения анемии у пациентов на гемодиализе. Началась эра клинического использования рчЭПО. Эпоэтин альфа был первым рекомбинантным ЭПО для коммерческих целей; позже многочисленные исследования показали, что рчЭПО можно с успехом применять не только в нефрологии, но и при других анемиях (табл. 1).
Таблица 1
Терапевтические показания к применению препаратов, стимулирующих эритропоэз [11, c дополнениями]

* Показания зарегистрированы в Европе.
В обычных клинических ситуациях, связанных с абсолютным дефицитом железа (ДЖ) у небеременных, ответ на лечение препаратами железа для приема внутрь при адекватной дозе препарата и отсутствии кровопотерь в значительной степени предсказуем. У беременных с анемией резистентность к железосодержащим препаратам для приема внутрь достаточно высока. О резистентности можно говорить при повышении концентрации гемоглобина (Hb) менее чем на 10 г/л через 4 недели с начала лечения препаратами железа или отсутствии ретикулоцитарного криза (повышения количества ретикулоцитов в 2 раза по сравнению с исходным). Наиболее частые причины резистентности к препаратам железа для приема внутрь:
-
ошибочный диагноз железодефицитной анемии (ЖДА);
-
нарушение всасывания железа на фоне воспалительных и других заболеваний ЖКТ (таких как инфекция H. pylori, болезнь Крона, язвенный колит, целиакия);
-
отказ от приема препаратов железа;
-
недостаточная доза препарата или прием железосодержащих средств с другими лекарствами и пищевыми продуктами, значительно снижающими всасывание железа в ЖКТ (антацидами, хинолонами, чаем, кофе, соевыми продуктами, солями Zn и Mg);
-
неконтролируемые кровотечения;
-
наследственные железодефицитные синдромы (например, железорефрактерная ЖДА);
-
неадекватно низкая продукция ЭПО, не соответствующая тяжести анемии.
Помимо абсолютного ДЖ и связанной с ним ЖДА, у беременной возможно развитие и других известных железодефицитных синдромов: функционального ДЖ и депонирования железа [5]. Синдром депонирования железа развивается на фоне системного воспалительного ответа, характерного даже для физиологической беременности, вследствие повышенной продукции гепцидина, снижающего абсорбцию железа в ЖКТ. Он ассоциирован с развитием АБ, имеющей признаки анемии воспаления.
И по современным эпидемиологическим данным ЖДА является частым, но далеко не единственным видом АБ. Согласно нашим исследованиям 2002 г., при обследовании 161 беременной с анемией ЖДА выявлена у 66 (41,0%) пациенток и не ЖДА — у 95 (59,0%) [2]. Динамика частоты АБ в каждом триместре представлена на рисунке 1. Результаты одного из недавних исследований распространенности ДЖ у беременных в США (Camden Study, 2001–2007) аналогичны (рис. 2) [22].
Рис. 1. Динамика численности беременных с железодефицитной анемией и нежелезодефицитной анемией, % от общего числа женщин, обследованных в каждом триместре [5]
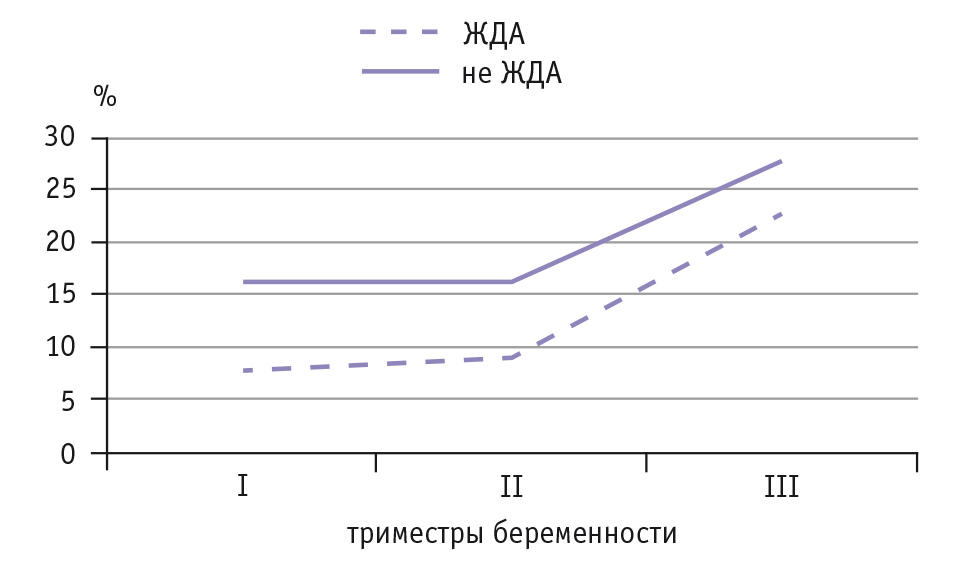
Рис. 2. Распространенность анемий и дефицита железа у беременных в США по данным исследования Camden Study (2001–2007) [22]
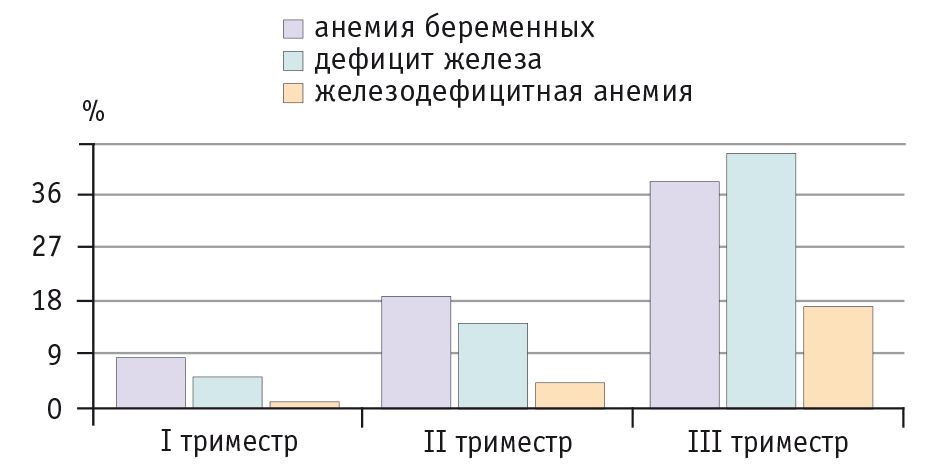
Таким образом, на долю ЖДА приходится менее половины анемий беременности, что служит одним из объяснений частой резистентности к препаратам железа для приема внутрь. Резистентность к железосодержащим препаратам для внутривенного введения может быть такой же высокой. Ответ на внутривенное введение железа (III) гидроксид сахарозного комплекса получен только у 27 (45,8%) пациенток из 59 беременных с ЖДА умеренной степени [19]. У остальных 32 беременных эффект удалось получить только после присоединения к ферротерапии рчЭПО. В группе пациенток, с самого начала получавших комбинированную терапию рчЭПО и железа (III) гидроксид сахарозным комплексом, еще на раннем этапе лечения отмечена отчетливая положительная динамика концентрации Hb.
Наиболее частой и важной причиной резистентности к препаратам железа и в то же время высокой эффективности рчЭПО при АБ служит неадекватно низкая продукция ЭПО, не соответствующая степени тяжести анемии. Вероятно, такое состояние возникает вследствие избыточной продукции провоспалительных цитокинов плацентой и гиперэстрогенемии. Нами впервые продемонстрировано, что неадекватно низкая продукция эндогенного ЭПО, не соответствующая тяжести анемии (гипопролиферативный эритропоэз), является характерной особенностью патогенеза большинства анемий во второй половине беременности [2, 4]. Кроме прямого ингибирования продукции ЭПО в почках, одной из возможных причин развития гипопролиферативного эритропоэза выступает нарушение взаимодействия ЭПО/ЭПО-Р, связанное с редукцией ЭПО-Р на поверхности эритроидных клеток костного мозга вследствие избыточной продукции ИНФ-γ и других провоспалительных цитокинов [6]. Наши результаты послужили патогенетическим обоснованием применения рчЭПО при АБ и поводом для более широкого использования в акушерской практике препаратов, стимулирующих эритропоэз. Помимо этого, согласно современным данным, ЭПО (эндогенный или экзогенный) практически не проходит через плацентарный барьер [15, 17, 21, 26]. Это имеет важное практическое значение, поскольку исключает возможность негативного влияния препарата на плод.
ИСТОРИЯ ПРИМЕНЕНИЯ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО ЭРИТРОПОЭТИНА ДЛЯ ЛЕЧЕНИЯ АНЕМИЙ БЕРЕМЕННЫХ
Вскоре после внедрения рчЭПО в клиническую практику его начали применять при анемиях у беременных и получили обнадеживающие результаты. Первый опыт использования рчЭПО при лечении анемий у беременных с заболеваниями почек (1991–1994) оказался весьма успешным (табл. 2). Введение рчЭПО беременным с анемией приводило к быстрому и значительному повышению уровня Нb. Женщины хорошо переносили рчЭПО, не вызывавший побочных эффектов ни у беременной, ни у плода.
Таблица 2
Литературные сведения о применении рекомбинантного человеческого эритропоэтина при анемиях беременных
С целью лечения АБ у женщин с нормальной функцией почек рчЭПО впервые применили в 1995 г. [13]. В исследовании участвовали 11 беременных с ЖДА и сроком гестации больше 20 недель с исходным уровнем Hb < 100 г/л. Проводили комбинированное лечение: рчЭПО в дозе 300 МЕ/кг внутривенно раз в неделю и железа (III) гидроксид сахарозный комплекс по 200 мг внутривенно раз в неделю. Лечение продолжали до достижения концентрации Hb 110 г/л или до начала родов, но не более 4 недель. У 8 из 11 женщин при введении препарата получен быстрый результат, выраженный в росте числа ретикулоцитов и повышении уровня Hb: еженедельный рост концентрации Hb составил 7 г/л. У 3 беременных ответ на терапию ЭПО был замедлен: содержание Hb у них возрастало на 3 г/л в неделю.
Описан случай гипопролиферативной анемии у 29-летней беременной [16]. При концентрации Hb 85 г/л отмечали низкое содержание сывороточного ЭПО при отсутствии заболевания почек и других возможных причин неадекватно низкой продукции ЭПО, не соответствующей степени тяжести анемии. Лечение рекомбинантным ЭПО было эффективным, и содержание Hb перед родами составило 120 г/л.
По литературным данным, у беременных с ЖДА, не ответивших на прием внутрь железосодержащих препаратов в течение 8 недель, применяли следующую схему лечения: рчЭПО (по 150 МЕ/кг 3 раза в неделю подкожно) вводили в сочетании со 100 мг препарата железа для парентерального введения ежедневно [24]. Продолжительность лечения составляла 4 недели. Быстрый ответ на терапию получен у 19 (73%) из 26 анемичных беременных с исходной концентрацией Hb < 85 г/л. В первые 2 недели терапии средний прирост содержания Hb составил 30 г/л. У 5 пациенток уровень Hb на фоне лечения повысился незначительно, и у 2 женщин отмечено дальнейшее снижение концентрации Hb, потребовавшее гемотрансфузий.
В 1999 г. представлены результаты использования рчЭПО у 20 беременных с анемией, отобранных по следующим критериям: содержание Hb ≤ 110 г/л, концентрация железа в сыворотке крови ≤ 15,0 мкмоль/л, гестационный возраст ≥ 20 недель, отсутствие заболеваний крови и патологии почек [1]. Пациентки получали рчЭПО по схеме: 2000 МЕ подкожно 3 раза в течение первой недели лечения, затем 2000 МЕ подкожно раз в неделю. Одновременно назначали железа фумарат для приема внутрь (по 200 мг элементарного железа в сутки) на все время применения рчЭПО. Контрольная группа из 63 беременных получала монотерапию фумаратом железа. Показано, что применение рчЭПО в сочетании с препаратами железа приводит к достоверному увеличению содержания Hb и количества эритроцитов, а также к улучшению кислородтранспортной функции крови. Улучшалась оксигенация тканей, уменьшалась тканевая гипоксия, чего не наблюдали в контрольной группе. Авторы сделали вывод об обоснованности применения рчЭПО в сочетании с препаратами железа у беременных с анемией.
Наши результаты исследования эффективности рчЭПО при АБ, резистентных к ферротерапии, также продемонстрировали высокую эффективность и безопасность этого метода [3]. Для лечения рчЭПО были отобраны 16 беременных с анемией в возрасте 23 ± 1,2 года и со средним сроком гестации 30,0 ± 1,8 недели, у которых ферротерапия в течение предшествующих 3–4 недель оказалась неэффективной. Курс лечения состоял из 6 подкожных инъекций рчЭПО через день в разовой дозе 100 МЕ/кг. Все женщины дополнительно получали препараты сульфата железа в дозе, эквивалентной 200 мг элементарного железа в сутки. Перед началом терапии и затем еженедельно определяли показатели гемограммы и количество ретикулоцитов.
До лечения средняя концентрация Hb составляла 86,3 ± 2,2 г/л, число ретикулоцитов — 15,2 ± 1,9‰. Четырнадцать женщин из 16 полностью прошли курс лечения. У 12 (85,7%) из 14 беременных после окончания курса терапии уровень Hb повысился до 120,3 ± 1,5 г/л, количество ретикулоцитов через 2 недели терапии рчЭПО составило 38,2 ± 4,0‰. У 2 (14,3%) из 14 беременных, получивших полный курс рчЭПО, статистически значимого увеличения содержания Hb не выявлено, но отмечен статистически значимый прирост количества ретикулоцитов: с 7‰ до 75‰ и с 7‰ до 55‰. Аллергических реакций, повышения АД и увеличения количества тромбоцитов во время лечения не наблюдали.
Вероятно, причиной относительной неэффективности терапии рчЭПО в 2 случаях послужило развитие функционального ДЖ на фоне форсированного эритропоэза вследствие приема рчЭПО. Возможно, в этом случае железосодержащих препаратов для приема внутрь недостаточно для потребностей стимулируемого костномозгового кроветворения и препараты железа следует назначать внутривенно.
В настоящее время самый большой опыт применения рчЭПО при АБ принадлежит акушерской университетской клинике г. Цюриха (Швейцария) [12, 14, 19]. В исследовании (2009) представлены результаты лечения анемий, развившихся у 84 беременных, несмотря на рутинную профилактику сульфатом железа по 80 мг/сут со II триместра беременности [19]. Все 84 женщины были рандомизированы на две группы:
ошибочный диагноз железодефицитной анемии (ЖДА);
нарушение всасывания железа на фоне воспалительных и других заболеваний ЖКТ (таких как инфекция H. pylori, болезнь Крона, язвенный колит, целиакия);
отказ от приема препаратов железа;
недостаточная доза препарата или прием железосодержащих средств с другими лекарствами и пищевыми продуктами, значительно снижающими всасывание железа в ЖКТ (антацидами, хинолонами, чаем, кофе, соевыми продуктами, солями Zn и Mg);
неконтролируемые кровотечения;
наследственные железодефицитные синдромы (например, железорефрактерная ЖДА);
неадекватно низкая продукция ЭПО, не соответствующая тяжести анемии.
-
у 59 беременных лечение начинали с внутривенного введения железосодержащих препаратов (железа (III) гидроксид сахарозный комплекс Венофер в дозе 200 мг (10 мл) 2 раза в неделю);
-
у 25 женщин с Hb < 90 г/л сразу проводили комбинированную терапию железа (III) гидроксид сахарозным комплексом (по 200 мг) и рчЭПО (по 10 000 МЕ) 2 раза в неделю.
К лечению 32 (54,2%) из 59 беременных первой группы из-за низкой эффективности монотерапии железосодержащим препаратом в течение 2 недель был добавлен рчЭПО. Интересно заметить, что средняя концентрация ЭПО у женщин, плохо ответивших на ферротерапию, была значительно ниже, чем у беременных с хорошим ответом на внутривенное введение препарата железа (46,6 ± 29,8 МЕ/л против 69,3 ± 42,8 МЕ/л, р < 0,05). Целевой уровень Hb достигнут у 20 из 25 беременных второй группы, таким образом, эффективность лечения составила 80,0%.
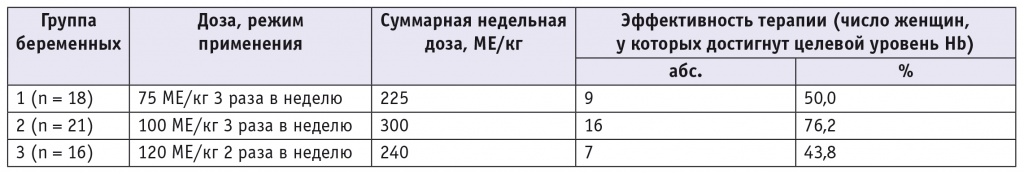
Проведена сравнительная характеристика различных схем применения рчЭПО для лечения АБ [7]. В эксперименте участвовали 55 беременных с анемией, проходивших лечение в отделениях патологии беременности родильных домов, а также находившихся под наблюдением в женских консультациях г. Рязани. Среди них было 27 первобеременных и 28 повторнобеременных; средний возраст женщин составил 23,80 ± 2,42 года (18–38 лет), средний срок гестации перед началом лечения — 29,20 ± 8,54 недели (23–38 недель). В зависимости от степени тяжести анемии были выделены три группы пациенток: у 23 женщин отмечали анемию легкой степени, у 27 беременных — средней степени и у 5 — тяжелую анемию. По дозе и кратности введения рчЭПО все 55 беременных были рандомизированы на три группы:
-
первая (n = 18): 75 МЕ/кг 3 раза в неделю (225 МЕ/кг в неделю);
-
вторая (n = 21): 100 МЕ/кг 3 раза в неделю (300 МЕ/кг в неделю);
-
третья (n = 16): 120 МЕ/кг 2 раза в неделю (240 МЕ/кг в неделю).
Дополнительно всем беременным назначали по 200 мг сульфата железа в сутки внутрь. Продолжительность терапии составляла 2 недели. Все группы были стратифицированы по возрасту, сроку беременности и начальной концентрации Hb.
Согласно результатам эксперимента, статистически значимо более высокая эффективность терапии отмечена у беременных, получавших рчЭПО в суммарной недельной дозе 300 МЕ/кг (76,2% против 50,0% в первой группе; р < 0,05) (табл. 3). Не выявлено ни одного случая побочного действия терапии рчЭПО в виде гриппоподобного синдрома или повышения АД. У одной беременной однократно отмечена незначительная реакция в виде покраснения и зуда в месте инъекции, не потребовавшая отмены препарата.
Таблица 3
Сравнительная эффективность применения рекомбинантного человеческого эритропоэтина у беременных с анемией [7]
Согласно полученным данным, применение рчЭПО при АБ имеет выраженный дозозависимый эффект (рис. 3). Следует отметить, что зависимость эффекта от дозы препарата характерна для клинического применения рчЭПО и при других видах анемий (например, анемии при хронической почечной недостаточности, анемии хронических болезней) [9].
Рис. 3. Динамика средней концентрации гемоглобина на фоне терапии анемии беременных различными дозами рекомбинантного человеческого эритропоэтина
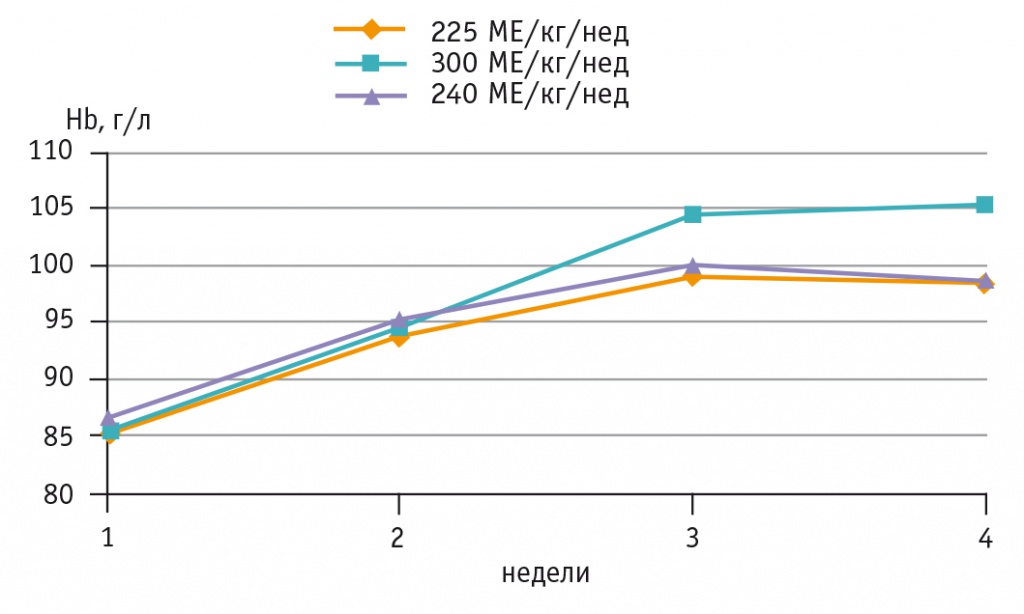
Наиболее высокая (76,2%) эффективность терапии рчЭПО зарегистрирована во второй группе беременных, получавших препарат в суммарной недельной дозе 300 МЕ/кг [7]. Почти такая же эффективность (72,7%) терапии рчЭПО получена в пилотном исследовании (1995), где препарат вводили внутривенно в дозе 300 МЕ/кг раз в неделю [13]. По литературным сведениям, при повышении суммарной недельной дозы рчЭПО до 450 МЕ/кг не удалось добиться увеличения эффективности лечения, которая составила 73% [24]. Эти данные указывают на нецелесообразность повышения дозы рчЭПО более 300 МЕ/кг в неделю при АБ. Согласно нашим результатам, снижение суммарной недельной дозы рчЭПО до 225 МЕ/кг значительно уменьшает действенность терапии АБ. Эффективность применения рчЭПО в дозе 120 МЕ/кг 2 раза в неделю (суммарная недельная доза — 240 МЕ/кг) существенно не отличалась от эффективности терапии в первой группе и была низкой (43,8% против 76,2% во второй группе; р < 0,05). Таким образом, оптимальная и наиболее эффективная доза рчЭПО при лечении АБ составляет 300 МЕ/кг в неделю.
Возможно, повышение дозы рчЭПО необходимо при возникновении у беременной анемии на фоне сопутствующих хронических заболеваний, например ВИЧ-инфекции. В этом случае анемия усугубляется не только инфекцией и избыточной продукцией провоспалительных цитокинов, но и антиретровирусной терапией, необходимой для профилактики вертикальной передачи ВИЧ плоду и часто провоцирующей развитие анемии. В одном из специальных исследований проанализированы результаты применения рчЭПО у 37 беременных с анемией, инфицированных ВИЧ и получавших антиретровирусную терапию [25]. Лечение рчЭПО начинали не ранее 16 недель беременности при уровне Hb < 90 г/л. Препарат вводили подкожно в дозе 150 МЕ/кг 3 раза в неделю в комбинации с препаратами железа и фолиевой кислоты. Если в течение 20 дней терапии уровень Hb не повышался на 20 г/л, то дозу препарата увеличивали пошагово на 50 МЕ/кг (максимально до 300 МЕ/кг 3 раза в неделю). Лечение прекращали при концентрации Hb > 110 г/л. Средняя продолжительность терапии составила 9 недель (от 2 до 12 недель). Если через 12 недель введения рчЭПО не удавалось достичь целевого уровня Hb, то препарат отменяли ввиду его неэффективности. Эффективность рчЭПО-терапии составила 78%: у 29 из 37 беременных удалось добиться повышения концентрации Hb с 72,4 ± 11,2 г/л в начале лечения до 110,0 ± 1,8 г/л в конце терапии. Каких-либо серьезных нежелательных явлений во время приема рчЭПО не отмечено. У 1/3 беременных в начале лечения зарегистрированы незначительное повышение температуры тела и миалгии, не потребовавшие отмены препарата.
Следует заметить, что эффективность рчЭПО-терапии АБ, по-видимому, мало зависит от пути введения препаратов железа. Так, эффективность рчЭПО-терапии АБ, полученная нами при применении железосодержащих препаратов для приема внутрь, и эффективность лечения АБ в университетской клинике г. Цюриха, где использовали препараты железа для внутривенного введения, оказалась практически одинаковой (76,5–85,7% и 72,7–80,0% соответственно) [2, 13, 14, 19]. Объяснение этому мы видим в открытом недавно влиянии ЭПО на продукцию гепцидина. Даже однократная инъекция рчЭПО значительно снижает концентрацию сывороточного гепцидина в течение 24 часов [10]. Как известно, во II–III триместрах беременности всасывание железа в кишечнике значительно повышается. При ЖДА концентрация гепцидина низкая, поэтому уровень абсорбции железа высокий. В случае АБ с признаками анемии воспаления свойственная им повышенная концентрация гепцидина значительно снижается под воздействием рчЭПО, что обеспечивает хорошее всасывание препаратов железа для приема внутрь. Тем не менее современные препараты железа для внутривенного введения отличаются высоким профилем безопасности и обеспечивают более высокую комплаентность по сравнению с препаратами железа для приема внутрь.
НЕЖЕЛАТЕЛЬНЫЕ ЭФФЕКТЫ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО ЭРИТРОПОЭТИНА ПРИ ТЕРАПИИ АНЕМИЙ БЕРЕМЕННЫХ
Ни в одном из опубликованных исследований по применению рчЭПО при АБ не сообщали о таких серьезных побочных явлениях терапии, как тромбоэмболические осложнения и чистая красноклеточная аплазия. Наиболее часто авторы отмечали боль в месте инъекции, незначительное повышение температуры тела и миалгии, не требовавшие отмены препарата. Аллергические реакции в виде кожной сыпи и зуда наблюдали у 2,5% женщин, получавших рчЭПО [24]. По данным зарубежных авторов, до 30% беременных с анемией и патологией почек, получавших рчЭПО, отвечали повышением АД, которое нормализовалось после гипотензивной терапии [18]. При анемиях у беременных без сопутствующей почечной патологии применение рчЭПО крайне редко приводит к развитию артериальной гипертензии.
ЗАКЛЮЧЕНИЕ
Наши исследования позволили патогенетически обосновать целесообразность применения препаратов рекомбинантного человеческого эритропоэтина (рчЭПО) при анемиях беременных (АБ), резистентных к ферротерапии. Анализ литературных данных и собственный опыт применения рчЭПО позволяют считать его эффективным и безопасным средством для лечения анемий во второй половине беременности. В 2012 г. препараты рчЭПО включены в Российский клинический протокол по лечению железодефицитных состояний у беременных [8]. В настоящее время большой положительный опыт применения рчЭПО при АБ накоплен в Швейцарии, Греции, а также в научно-клинических центрах Рязани, Москвы и Санкт-Петербурга. Однако пока применение рчЭПО при АБ выходит за рамки международных клинических рекомендаций [23]. Необходимы мультицентровые рандомизированные клинические исследования этого вида терапии АБ.








