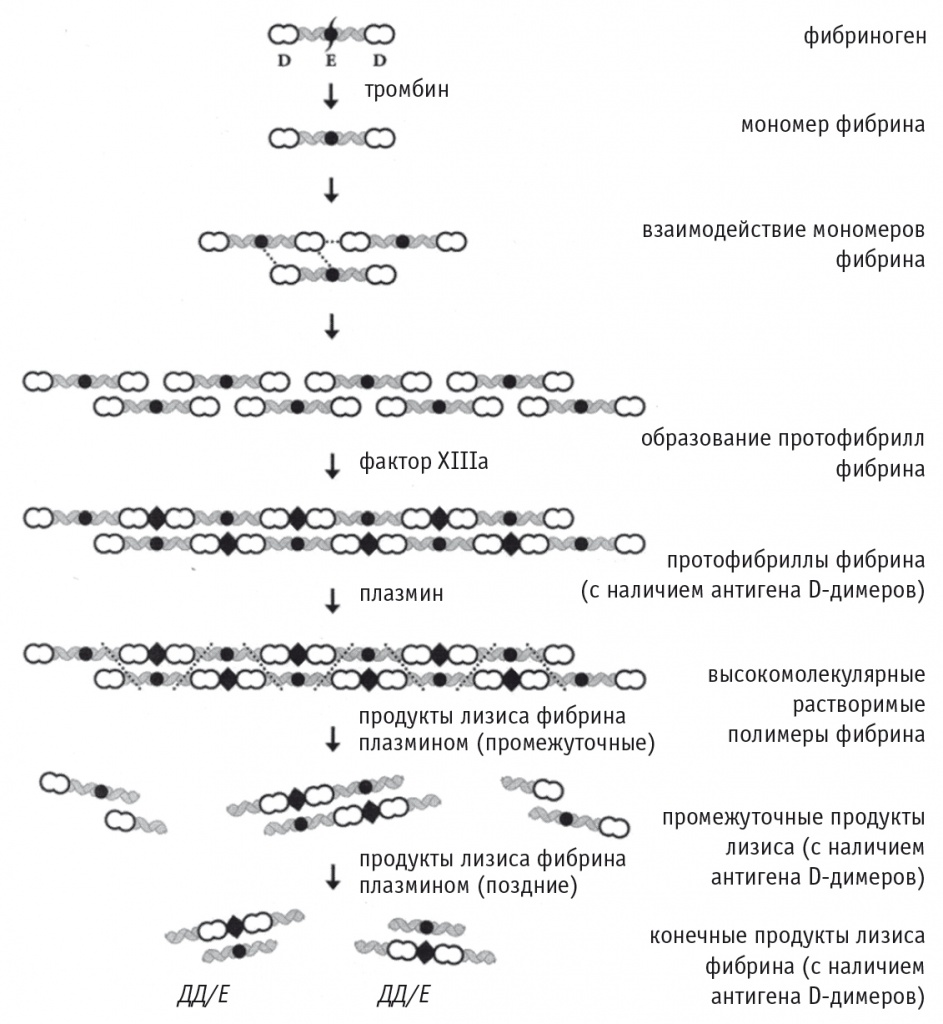
Высокий уровень D-димеров — признанный лабораторный маркер тромбинемии и внутрисосудистого свертывания крови при таких патологических состояниях, как синдром диссеминированного внутрисосудистого свертывания крови (ДВС-синдром) [11, 51], тромбоз глубоких вен нижних конечностей и тромбоэмболия легочной артерии [13, 20]. Концентрацию D-димеров учитывают при диагностике острого расслоения аорты [48]. Общая информация о структуре и образовании D-димеров представлена на рисунке 1.
Рис. 1. Схема образования фибрина и его растворения под действием плазмина ([20]).
Примечание. Показана последовательность формирования производных фибриногена, обладающих неоантигенами, свойственными D-димерам. D и E — домены молекулы фибриногена
Нарастание концентрации D-димеров в плазме крови беременных продемонстрировано многими исследованиями [12, 30, 31, 38, 49], в том числе проведенными в нашем центре (рис. 2А) [7].
Рис. 2. Динамика содержания D-димеров в плазме крови (А), активности тканевого фактора (Б), отношения активности тканевого фактора к ингибитору пути тканевого фактора (В), а также эндогенного тромбинового потенциала (Г) в плазме крови беременных и небеременных женщин.
Примечание. Здесь и на рисунках 4, 5: медиана — горизонтальная линия внутри прямоугольника, включающего 50% полученных значений; значения, соответствующие 2,5 и 97,5 перцентиля, — нижний и верхний вертикальные бары; 6–8, 12–13, 22–24, 34–36 — недели беременности
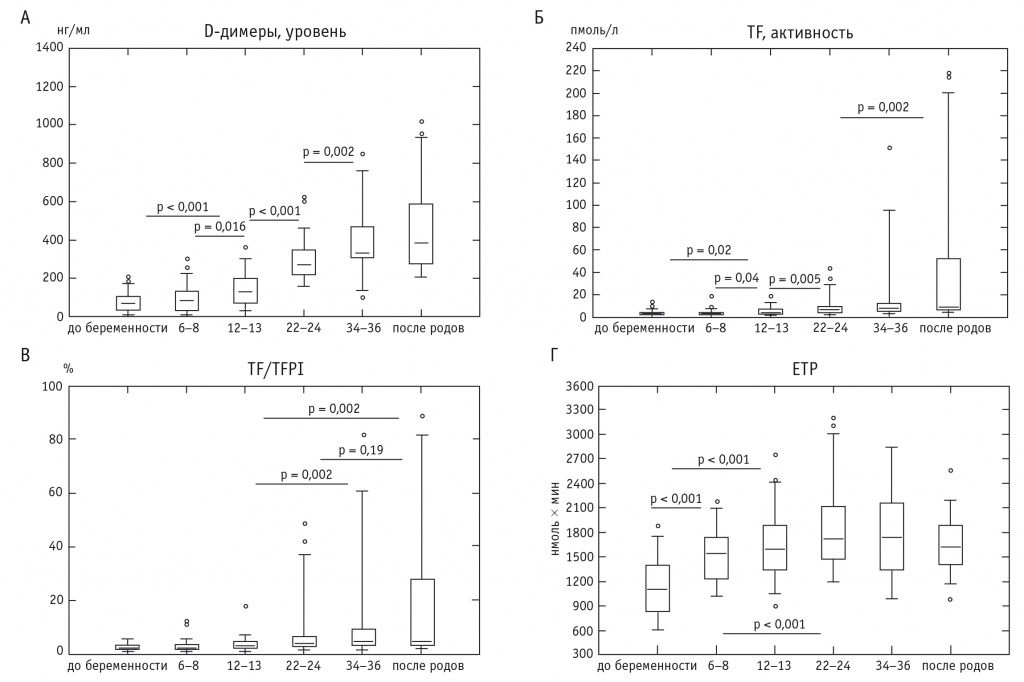
Зафиксировано увеличение уровня D-димеров (по медиане) в сравнении с прегравидарным периодом: на 6–8-й неделе беременности — на 18%, на 12–13-й — на 86%, на 22–24-й неделе — в 3,84 раза и в конце срока беременности — в 4,68 раза, что соответствует литературным сведениям [12, 30, 31, 38, 49].
Гиперпродукция D-димеров в крови неразрывно связана с образованием тромбина, занимающего центральное место в реакциях системы гемостаза. Функциями тромбина являются [4]:
-
активация тромбоцитов (тромбин — наиболее мощный стимулятор активности этих клеток);
-
активация факторов свертывания крови V, VIII, VII, XI и XIII (фибринстабилизирующего фактора);
-
ограниченный протеолиз фибриногена до фибрин-мономера;
-
активация протеина С комплексом «тромбин — тромбомодулин»;
-
стимуляция выброса из эндотелиоцитов тканевого активатора плазминогена (tissue plasminogen activator — t-PA);
-
ограниченный протеолиз плазматической карбоксипептидазы В до активной формы — активируемого тромбином ингибитора фибринолиза (thrombin-activatable fibrinolysis inhibitor — TAFI).
При взаимодействии с сосудистой стенкой тромбин способствует экспрессии тканевого фактора (tissue factor — TF), фактора Виллебранда, ингибитора активатора плазминогена тканевого типа (plasminogen activator inhibitor type 1 — PAI-1) и Р-селектина, синтезу провоспалительных цитокинов, простациклина и оксида азота. Кроме того, он участвует в адгезии лейкоцитов, повышает проницаемость эндотелия и стимулирует пролиферацию гладкомышечных клеток сосудов, т. е. является важным связующим звеном гемостатических, фибринолитических и воспалительных реакций [4, 14, 17].
При этом ведущей функцией тромбина специалистами единодушно признан ограниченный протеолиз фибриногена в фибрин-мономер. Последний, пройдя стадию полимеризации (соединения с аналогичными молекулами) и стабилизации фактором XIIIа, формирует нерастворимый фибрин (fibrin insoluble), способный останавливать кровотечение в сосудах достаточно крупного калибра. Отметим, что в случае беременности эта функция тромбина приобретает особое значение для обеспечения гемостаза при преждевременной отслойке нормально расположенной плаценты, а также в ходе родоразрешения, когда для снижения объема кровопотери необходимо тромбирование большого числа «зияющих» сосудов матки. Тем не менее при беременности избыточное образование тромбина потенциально опасно в связи с возможностью сосудистой ишемии и осложнений беременности: ранних выкидышей, задержки внутриутробного развития плода, преэклампсии, антенатальной гибели плода, преждевременных родов и мертворождения [15, 32, 50].
В последние годы развитие клеточной модели свертывания крови in vivo позволило определить, что TF является единственным инициатором образования тромбина, попадающим в кровоток при повреждении эндотелия кровеносных сосудов под воздействием травмы, провоспалительных цитокинов, эндотоксина, адреналина, гипоксии или значительной кровопотери [34, 47]. ТF входит в число интегральных мембраносвязанных гликопротеинов и экспрессируется на клетках крови и эндотелия, а также взаимодействует с присутствующим в крови фактором VII с образованием комплекса «ТF — FVIIa» (так называемая фаза инициации свертывания крови). Данный комплекс способствует образованию небольшого количества фактора IIa (тромбина), затем участвующего в активации тромбоцитов. В течение следующей фазы свертывания крови — «усиления» — тромбин приводит к высвобождению фактора Виллебранда из эндотелия кровеносных сосудов и создает условия для образования активированных факторов V, VIII и XI. На следующей стадии, в фазе «распространения», различные факторы и ферменты объединяются на поверхности активированных тромбоцитов для формирования комплекса теназы и фактора Ха, вслед за чем происходит интенсивное образование тромбина в количестве, достаточном для превращения фибриногена в фибрин.
Согласно результатам исследования [9], активность TF повышается начиная с ранних сроков беременности (рис. 2Б). По мере развития беременности активность TF увеличивается: на 12–13-й, 22–24-й и 34–36-й неделях беременности ее значение по медиане превышает исходное (в прегравидарном периоде) в 1,26, 2,32 и 2,75 раза соответственно. Травма, связанная с самопроизвольными родами, сочетается с наибольшей активностью этого ключевого активатора свертывания крови, достигшего у трех из 44 женщин (6,8% наблюдений) уровня более 200 пмоль/л.
Отмеченный факт выброса TF в системный кровоток беременных соответствует литературным данным, согласно которым коагулирующая активность крови женщин максимально повышена в период изгнания плаценты [32]. Как сильный инициатор коагуляции TF быстро приводит к тромбированию сосудов, способствуя остановке кровотечения у матери во время родов. Это представляется весьма важным, поскольку при плацентарном токе крови 700 мл/мин возможно сильное кровотечение, если система коагуляции не справится со своей задачей [25, 41].
TF может терять активность при связывании с ингибитором пути TF (tissue factor pathway inhibitor — TFPI). Последний способен инактивировать не только комплекс «TF — FVIIa», но и фактор Ха, что усиливается присутствием в крови низкомолекулярных гепаринов при профилактических воздействиях [26, 36]. Нами зафиксировано умеренное повышение активности TFPI в поздние сроки физиологической беременности и в первые 2–3 дня после родов [9], что соответствует литературным данным [32, 54]. Тем не менее такой активности TFPI во второй половине беременности недостаточно для преодоления активности TF (см. рис. 2Б, рис. 2В).
Как отмечено выше, присутствие в крови TF приводит к усилению образования в ней тромбина. В соответствии с нашими данными [8], наступление и течение беременности закономерно сопровождаются увеличением эндогенного тромбинового потенциала (endogenous thrombin potential — ETP), измеренного по технологии калиброванной тромбографии [35], предусматривающей использование TF в качестве активатора (рис. 2Г).
Показано, что уже с ранних сроков беременности (6–8 недель) ETP резко возрастает (на 39,6% по медиане по сравнению с прегравидарным этапом). Усиление генерации тромбина наблюдали не только вплоть до поздних сроков беременности, но и в первые 2–3 суток после родоразрешения, когда интенсивность этой реакции была максимальной (повышение ETP в 1,47 раза по сравнению с прегравидарным этапом). Данный факт хорошо объясним с позиций подготовки организма матери к минимизации кровопотери при родоразрешении, но не вполне понятно, почему эта подготовка начинается так рано, ведь роды и, соответственно, ограничение объема кровопотери в первой половине беременности не запрограммированы природой. Подобные результаты получены и другими исследователями [29, 41], использовавшими близкие по составу реагенты и сходные методы.
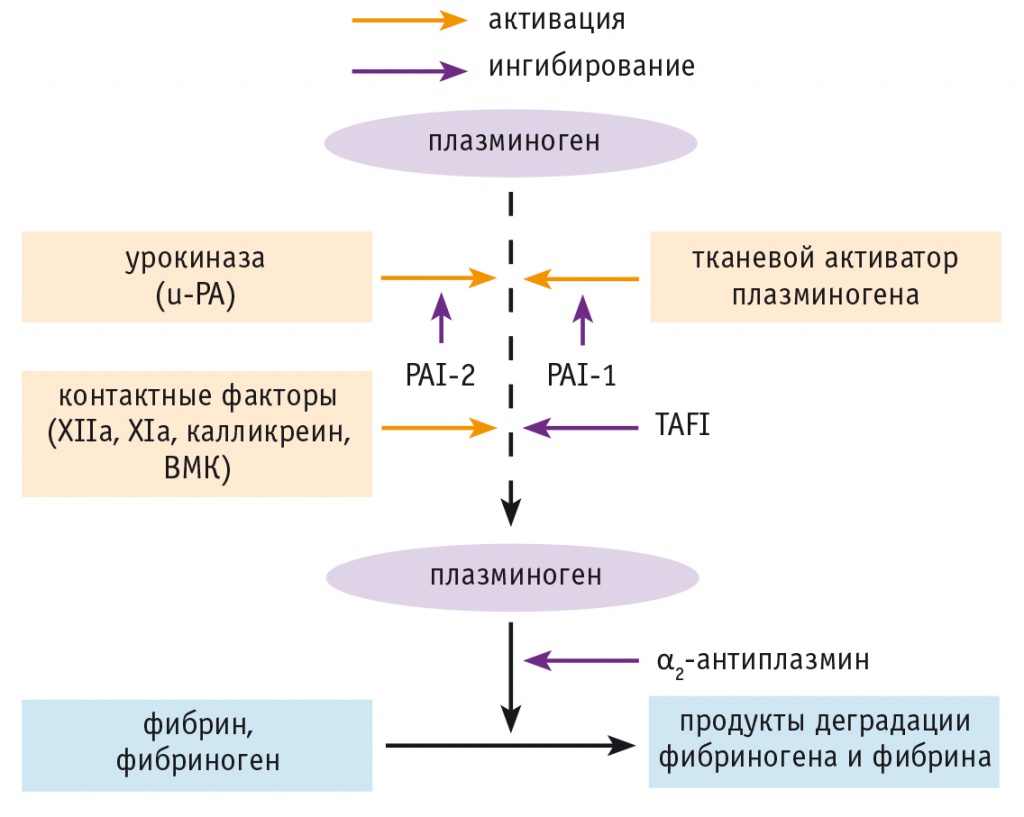
В целом представленные литературные данные свидетельствуют о высокой готовности крови беременных к образованию тромбина, внутрисосудистому свертыванию крови и фибринообразованию, особенно с приближением к родоразрешению. Следовательно, закономерен вопрос: как связать многократное повышение концентрации D-димеров в поздние сроки физиологической беременности с отсутствием тромботических осложнений? Ведь по современным представлениям активация свертывания крови и фибринолиза, D-димеры и тромбозы — события одного порядка. Чтобы попытаться решить этот вопрос, мы оценили динамику уровней плазминогена и основных регуляторов фибринолитической активности крови в этот период жизни женщины: α2-антиплазмина (α2-АP), t-PA, урокиназного активатора плазминогена (urokinase-type plasminogen activator — u-PA), PAI-1 и TAFI [6, 10] (рис. 3). Ниже представлены полученные результаты в сравнении с данными других авторов.
Рис. 3. Схема фибринолитических реакций.
Примечание. ВМК — высокомолекулярный кининоген; PAI-1 и PAI-2 — ингибиторы активатора плазминогена 1-го и 2-го типа соответственно; TAFI — тромбин-активируемый ингибитор фибринолиза
Определено, что во время беременности уровень плазминогена заметно увеличивается, причем статистически значимые отличия отмечены уже в ранние сроки беременности (6–8 недель), а с 12–13-й недели изучаемый показатель был максимально высоким вплоть до 34–36-й недели (рис. 4А). После этого, в первые 2–3 дня после родоразрешения, концентрация плазминогена снижается на 17,8% (по медиане), что объясняется известной тропностью плазминогена к фибрину, интенсивно формирующемуся в сосудах, поврежденных в процессе родов.
Рис. 4. Динамика содержания плазминогена (А), уровней тканевого активатора плазминогена (Б) и ингибитора активатора плазминогена 1-го типа (В), а также отношения концентрации тканевого активатора плазминогена к величине ингибитора активатора плазминогена 1-го типа (Г) в плазме крови беременных и небеременных женщин
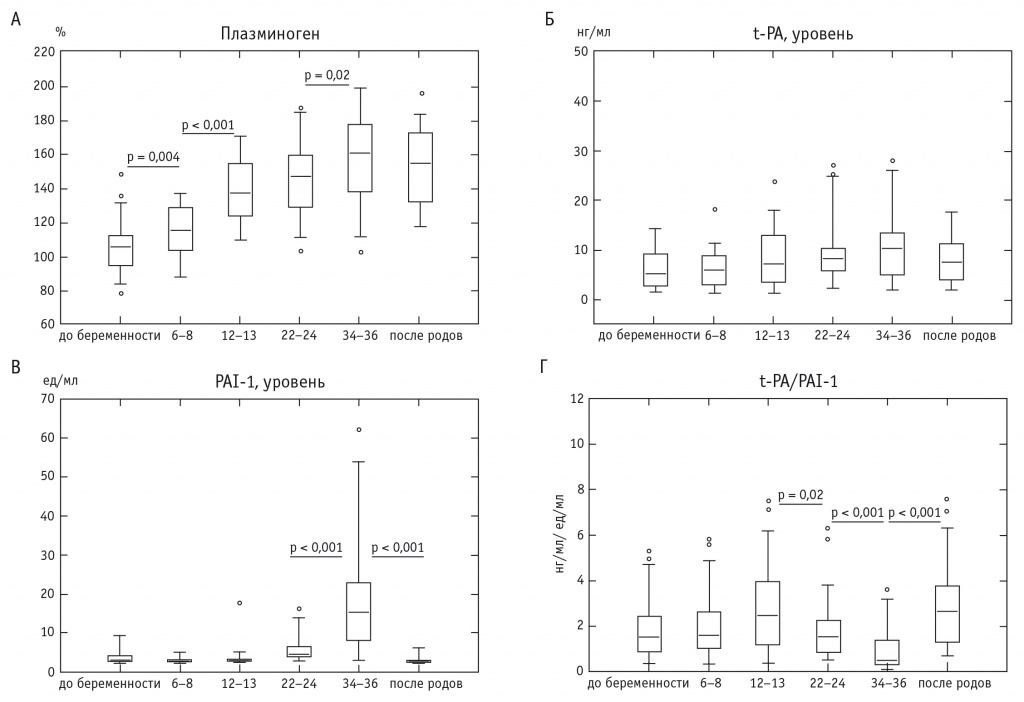
Увеличение концентрации плазминогена при беременности известно [52] и связано с необходимостью усиления фибринолитической активности крови в противовес нарастающей тромбогенности крови.
Плазминоген является предшественником плазмина — фибринолитически активного фермента [56], и его превращение в плазмин происходит посредством известных механизмов. В число основных активаторов плазминогена входит t-PA, имеющий эндотелиальное происхождение и секретируемый в кровоток при воздействии таких стимулов, как десмопрессин, венозная окклюзия (в том числе при проведении манжеточной пробы) или физическая нагрузка [1, 22]. Этот активатор также уникален, поскольку его действие высокоспецифично по отношению к фибрину. В частности, трансформация плазминогена в плазмин под воздействием t-PA при отсутствии фибрина идет крайне медленно и только на фибрине t-PA привлекается к превращению Glu-плазминогена в протеолитически активный плазмин [4]. В то же время в наших исследованиях уровень t-PA практически не менялся на протяжении всей беременности (рис. 4Б), хотя некоторые авторы сообщают об умеренном увеличении этого показателя в плазме крови беременных без какой-либо клинически значимой патологии [28].
Прямым ингибитором t-PA является PAI-1, относящийся к семейству серпинов [55]. Подобно t-PA, этот ингибитор преимущественно эндотелиального происхождения. Как известно, PAI-1 проникает в сгустки фибрина в концентрации, в 500 раз превышающей его уровень в плазме крови, что приводит к стабилизации тромба и увеличивает его устойчивость к растворению [16, 55].
В соответствии с нашими данными, уровень PAI-1 во время физиологической беременности вплоть до 12–13 недель стабилен и не отличается от такового в прегравидарном периоде (рис. 4В). Однако во второй половине беременности отмечен взрывной рост концентрации PAI-1: в 1,5 и 5,0 раза на 22–24-й и 34–36-й неделях соответственно (по медиане, в сравнении с уровнем до беременности).
Интересно, что на 2–3-и сутки после родоразрешения уровень этого ингибитора возвращался к исходному (до беременности), достоверно снижаясь по медиане на 82% по сравнению с таковым на 34–36-й неделе беременности. Приведенные результаты вполне согласуются с литературными данными об увеличении уровня PAI-1 в поздние сроки беременности [24].
Кроме того, нами рассчитано отношение концентрации t-PА к величине PAI-1, учитывая их конкуренцию за активацию плазминогена в пристеночных отложениях фибрина. Как показано на рисунке 4Г, в поздние сроки беременности рост концентрации PAI-1 явно преобладает над ростом t-PA, вследствие чего снижается эффективность пристеночных реакций фибринолиза.
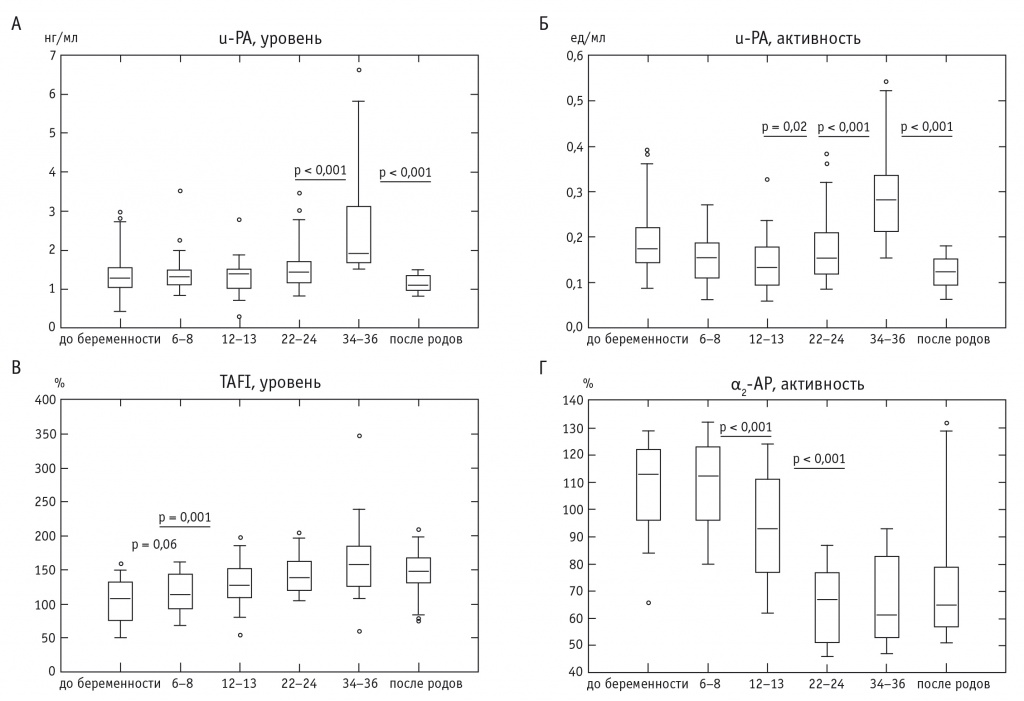
Наряду с t-PA, к физиологическим активаторам плазминогена относится u-PA, на долю которого в обычных условиях приходится около 15% всего активирующего фибринолиз потенциала крови и стенок кровеносных сосудов [33]. Как известно, u-PA синтезируется юкстагломерулярным аппаратом почек, эндотелиоцитами, фибробластами, эпителиальными клетками, а также децидуальными клетками плаценты, но, в отличие от t-PA, этот активатор не имеет сродства к фибрину, связывается с u-PA-рецепторами клеток и реализует свое действие преимущественно в системном кровотоке [22]. Согласно нашим результатам уровень и активность u-PA значительно увеличивались начиная с 22–24-й недели беременности и достигали максимума перед родоразрешением, после чего снижались до исходных значений (прегравидарного периода) на 2–3-и сутки после самопроизвольных родов (рис. 5А, Б).
Рис. 5. Динамика уровня урокиназного активатора плазминогена (А), активности урокиназного активатора плазминогена (Б), содержания тромбинактивируемого ингибитора фибринолиза (В) и активности α2-антиплазмина (Г) в плазме крови беременных и небеременных женщин
В целом эти данные соответствуют опубликованным материалам других авторов [45]. Сообщают также о содержании в крови беременных PAI-2, имеющего, в отличие от PAI-1, преимущественно плацентарное происхождение. Мишенью его действия служит как u-PA, так и t-PA. Как принято считать, концентрация PAI-2 увеличивается по мере роста плаценты и соотносится с размером плода.
Прежде чем подвести итоги обсуждения реагирования системы фибринолиза на усиление коагуляционной активности крови при беременности, остановимся еще на двух принципиально значимых ингибиторах фибринолитических реакций. Первый — TAFI эндотелиального происхождения, способный разрушать каталитическую поверхность фибрина (лизинсвязывающий сайт), необходимую для активации плазминогена при посредстве t-PA. Его неактивная форма — прокарбоксипептидаза Y — активируется тромбином, связанным с тромбомодулином, и рядом других агентов до активной карбоксипептидазы Y. Таким образом, TAFI, как и PAI-1, играет значительную роль преимущественно в пристеночных реакциях фибринолиза, содействуя упрочению фибринового сгустка и предотвращая его преждевременное растворение [53].
По нашим данным, содержание TAFI в плазме крови увеличивается уже с ранних сроков беременности: на 6–8-й неделе — на 5,9% (по медиане, по сравнению с данными до беременности), на 12–13-й неделе — на 18,8%, на 22–24-й неделе — на 29,2% и в поздние сроки беременности — на 47,4% (рис. 5В). Подобная тенденция к увеличению уровня TAFI по мере развития беременности отмечена и другими учеными [43, 50].
Последний рассматриваемый в настоящей публикации ингибитор фибринолиза — α2-АP, бесспорно, играет не последнюю роль в течении фибринолитических реакций. Этот представитель семейства серпинов [21] является основным биологическим ингибитором плазмина, и на его долю приходится около 90% антиплазминовой активности [40]. В частности, α2-АP связывает свободно циркулирующий в крови плазмин с образованием неактивного комплекса «плазмин — α2-АP» [23, 44, 46]. По некоторым сообщениям, плазмин, связанный с фибрином, эффективно защищен от α2-AP [39]. Интересно отметить, что наследственная или приобретенная недостаточность α2-AP ассоциирована с тяжелыми кровотечениями вследствие неконтролируемого гиперфибринолиза [27].
Согласно нашим данным, активность α2-АP стабильна в ранние сроки беременности, но снижается начиная с 12–13 недель и резко уменьшается во второй половине беременности (рис. 5Г). Так, на 12–13-й неделе беременности активность α2-АP снижена на 17,7% (по медиане, по сравнению с прегравидарным этапом), на 22–24-й неделе — на 40,7% и на 34–36-й неделе — на 45,6%.
Отметим также, что через 2–3 дня после срочных самопроизвольных родов выявлена тенденция к нарастанию активности α2-АP, несмотря на широкий разброс данных в выборке.
Литературные сведения об изменении активности α2-АP при физиологической беременности противоречивы. В одних работах отмечено увеличение этого показателя на 10–17% в период беременности [18, 52]. В то же время другие исследования свидетельствуют о динамичном уменьшении активности α2-АP по мере приближения к родам [37], что соответствует нашим результатам.
Возвращаясь к вопросу о происхождении высокого уровня D-димеров при беременности без тромботических осложнений, можно констатировать, что на поздних сроках гестации (34–36 недель) происходит, по всей видимости, четкое разделение функций фибринолитической системы по направленности воздействий. Пристеночные (внутрисосудистые) реакции фибринолиза ингибируются, что иллюстрируется преобладанием роста концентрации PAI-1 над ростом t-PA, а также увеличением уровня TAFI. При этом плазминоген, имеющий афинность к фибрину, в значительной мере теряет способность превращения в протеолитически активный фермент, что повышает стабильность фибриновых образований в поврежденных родами сосудах. Отмеченный механизм может иметь решающее значение для снижения объема кровопотери в ситуации, когда необходимо тромбирование большого числа «зияющих» сосудов матки. Очевидно, нарушение этого механизма может приводить к так называемым гиперфибринолитическим кровотечениям в родах и раннем послеродовом периоде. Вероятно, описанные события позволили многим авторам прийти к заключению о значительном подавлении фибринолиза в период беременности и, особенно, во время родов [44, 50].
С другой стороны, в поздние сроки беременности создаются оптимальные условия для эффективного преобразования плазминогена в плазмин в циркулирующей крови. Этому способствуют рост уровня плазминогена, концентрации и активности u-PA и значительное падение активности основного ингибитора плазмина — α2-АP.
Так что же служит субстратом для плазмина и источником образования D-димеров в поздние сроки беременности, учитывая отсутствие тромбоза? По результатам некоторых исследований [42], исходно повышенная концентрация D-димеров в плазме крови госпитализированных больных может отражать один из патологических процессов, которые инициируют внутрисосудистое образование фибрина, но не обязательно приводят к явному тромбозу. Помимо этого, предположительно, фибрин усилен ковалентными связями с фактором XIIIа до его преобразования в гель (сгусток), а антигены D-димеров способны циркулировать в плазме крови при отсутствии явного тромбоза [5]. Следовательно, вероятным источником образования D-димеров служит не только фибрин (гель), но и его растворимые предшественники (рис. 6). Молекулярная масса фрагментов растворимого фибрина, обладающих антигенами D-димеров, может достигать 5 млн Да, и в одной такой молекуле возможно до 15 чередований последовательностей D–D–E.
Рис. 6. Процесс образования D-димеров (по [20] с дополнениями)
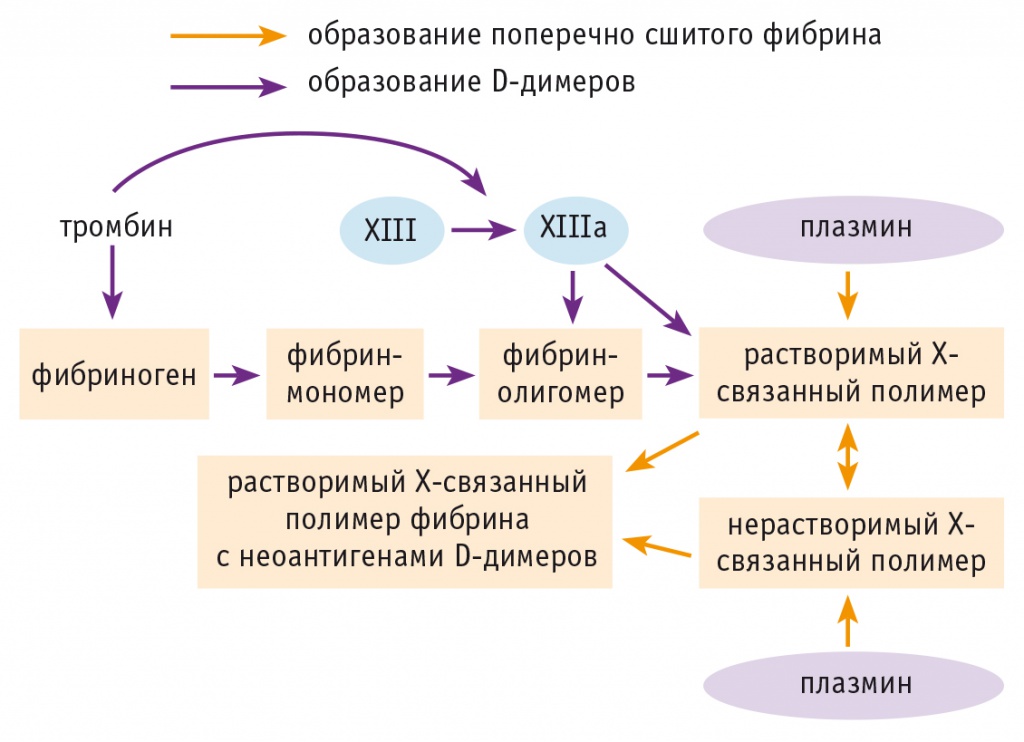
С учетом изложенного нами выдвинута следующая гипотеза увеличения концентрации D-димеров в поздние сроки физиологической беременности. Несмотря на значительное возрастание гемостатического потенциала с усилением генерации тромбина, в период, предшествующий родам, растворимые формы стабилизированного фибрина также способны подвергаться протеолизу плазмином, что нарушает классический путь преобразования фибриногена в сгусток фибрина. При этом высокий уровень D-димеров может свидетельствовать об эффективности защитных механизмов, предохраняющих от внутрисосудистого свертывания крови и тромбообразования перед родоразрешением. Можно также полагать, что снижение фибринолитического потенциала плазмина в циркулирующей крови, зависящего прежде всего от α2-АP, усиливает вероятность венозных тромбоэмболических осложнений у рожениц и родильниц.
ЗАКЛЮЧЕНИЕ
Физиологически протекающая беременность сопровождается активацией свертывания крови, достигающей максимума в преддверии родов. Этот феномен связан с инициацией свертывания крови тканевым фактором и соответствующим усилением генерации тромбина, о чем обычно свидетельствует нарастание в плазме крови концентрации D-димеров, традиционно рассматриваемых в качестве маркеров растворения (лизиса) стабилизированного фибрина. В то же время остаются неясными причина и физиологическое значение значительного увеличения содержания D-димеров в плазме крови в поздние сроки беременности, протекающей без тромбозов и каких-либо клинически выраженных патологических состояний. Литературные и собственные данные, представленные в обзоре, свидетельствуют о подавлении пристеночных интраваскулярных фибринолитических реакций в период, предшествующий родам. В то же время системный (в общей циркуляции) фибринолиз активирован вследствие резкого роста активности урокиназного активатора плазминогена в сочетании со снижением концентрации основного ингибитора плазмина — α2-антиплазмина. Предположительно, концентрация D-димеров в плазме крови в поздние сроки беременности повышена вследствие лизиса растворимого фибрина, не достигшего состояния фибринового сгустка. Таким образом, высокий уровень D-димеров перед родоразрешением может указывать на наличие эффективных защитных механизмов, препятствующих тромбообразованию в этот период жизни женщины.







