ВВЕДЕНИЕ
Для большинства пациентов, получающих лечение программным гемодиализом (ГД), характерна специфическая картина изменений АД в течение интрадиализного и междиализного периодов. Так, АД прогрессивно увеличивается между процедурами заместительной почечной терапии и стремительно снижается во время сеанса ультрафильтрации[1]. Тем не менее около 8–13% пациентов на ГД имеют аномальный гемодинамический ответ с повышением АД во время или сразу после сеанса ГД[2, 3]. Описанное явление получило название интрадиализной гипертензии (ИДГ).
ИДГ не только усложняет контроль АД, способствуя прогрессированию гипертрофии ЛЖ[4] и снижая эффективность заместительной почечной терапии у пациентов на ГД, но и является самостоятельным фактором риска общей летальности и смертности от сердечно-сосудистых причин[5, 6]. Так, в исследовании C.Y. Yang и соавт. повышение интрадиализного систолического АД (САД) более чем на 5 мм рт. ст. было ассоциировано с почти четырехкратным увеличением риска общей смертности (ОР = 3,93; 95%-ный ДИ: 1,42–10,85)[7]. В более крупном исследовании, основанном на ретроспективном анализе амбулаторных карт 37 094 пациентов на ГД, наличие ИДГ отражалось не только на смертности больных, но и на возросшем риске их госпитализации (ОР = 1,42; 95%-ный ДИ: 1,26–1,62).
Практическая значимость профилактики данного осложнения очевидна, но патофизиологические механизмы ИДГ остаются предметом дискуссий. В качестве потенциальных причин ИДГ рассматриваются процессы макрососудистого ремоделирования артерий и эндотелиальная дисфункция, лежащие в основе высокой артериальной ригидности[8].
Цель исследования — уточнить прогностическое значение параметров артериальной ригидности в развитии ИДГ у пациентов на программном ГД.
МАТЕРИАЛЫ И МЕТОДЫ
В соответствии с поставленной целью в период с января 2019 г. по февраль 2020 г. на базе отделения диализа и гравитационной хирургии крови ГБУЗ НО «НОКБ им. Н.А. Семашко» обследованы 45 пациентов в возрасте 24–68 лет. Все пациенты получали заместительную почечную терапию методом программного ГД: по 3 сеанса в неделю, каждый сеанс длительностью 4,0–4,5 ч в день в бикарбонатном режиме, сосудистый доступ — артериовенозная фистула. Из исследования исключались пациенты со стажем ГД менее 3 мес, а также с величиной eKt/V1 < 1,2. В качестве критерия ИДГ служило повышение САД > 10 мм рт. ст. после процедуры ГД более чем в 4 из 6 сеансов в период, предшествующий проведению суточного мониторирования АД (СМАД).
Показатели артериальной ригидности определяли с помощью прибора СМАД с использованием программного комплекса Vasotens-24 BPLab (ООО «Петр Телегин», Россия). Оценивали индекс аугментации (augmentation index, AIx), оценочную скорость пульсовой волны в аорте (aortic pulse wave velocity, PWVao), время распространения отраженной волны (reflection wave transmission time, RWTT), индекс ригидности артерий (arterial stiffness index, ASI). Фиксировали демографические данные пациентов и данные объективного обследования, ряд лабораторных показателей, стаж ГД, сопутствующие сердечно-сосудистые заболевания, проводимую лекарственную терапию с акцентом на диализируемость лекарственных препаратов. С учетом влияния повышенного уровня АД на показатели ригидности сосудистой стенки дополнительно рассчитывали величины, приведенные к САД 100 мм рт. ст. и ЧСС 60 уд/мин: RWTT100–60, PWVao100–60, ASI100–60. Была также унифицирована величина AIx с помощью показателя AIx75, приведенного к ЧСС 75 уд/мин.
Для оценки способности препаратов проходить через диализные мембраны использовали официальные инструкции к лекарственным веществам, а также специализированные рекомендации по диализируемости лекарственных препаратов[9].
Анализ полученных данных выполнен с использованием пакета прикладных программ Statistics 26 (IBM SPSS). Нормальность распределения переменных оценивали с помощью теста Шапиро — Уилка. Для проверки статистической значимости различий данных номинативного характера применяли точный критерий Фишера, количественных данных — U-критерий Манна — Уитни. Проводился анализ с оценкой силы связи между показателями с помощью корреляционного коэффициента Пирсона для количественных данных и коэффициента Спирмена для данных, представленных в ранговой шкале; ОР в многофакторной логистической регрессии рассчитывали с учетом 95%-ного ДИ. При значении р < 0,05 различия считали статистически значимыми.
РЕЗУЛЬТАТЫ
Средний возраст пациентов составил 51 [41; 61] год, стаж ГД — 4,5 [1,1; 7,8] года. Соотношение полов было почти равным: 23 мужчины и 22 женщины. ИДГ встречалась у 20 пациентов на ГД, которые составили основную группу. Группа контроля — 25 больных с адекватным интрадиализным гемодинамическим профилем. Обе группы были сопоставимы по полу, показателям эффективности ГД, сопутствующим сердечно-сосудистым заболеваниям, объему ультрафильтрации, стажу ГД. Препараты с высоким диализным клиренсом применялись у 42% пациентов (в 62% случаев — β-адреноблокаторы, в 38% — ингибиторы ангиотензинпревращающего фермента).
По данным однофакторного корреляционного анализа, больные с ИДГ были старше, чаще получали высокодиализируемые лекарственные препараты, имели более высокие показатели PWVao100–60, ASI, AIx и AIx75. В то же время наблюдалась обратная корреляция между развитием ИДГ и остаточным диурезом, уровнем альбумина, наличием диабетической нефропатии, показателями RWTT и RWTT100–60. Значимость влияния каждого фактора на развитие ИДГ представлена в таблице.
Таблица
Качественные и количественные признаки, имеющие значимые корреляции с развитием интрадиализной гипертензии (ИДГ), по результатам однофакторного анализа
Примечание. Здесь и в рисунках 1 и 2: AIx — индекс аугментации, ASI — индекс ригидности артерий, PWVao — оценочная скорость пульсовой волны в аорте, RWTT — время распространения отраженной волны.
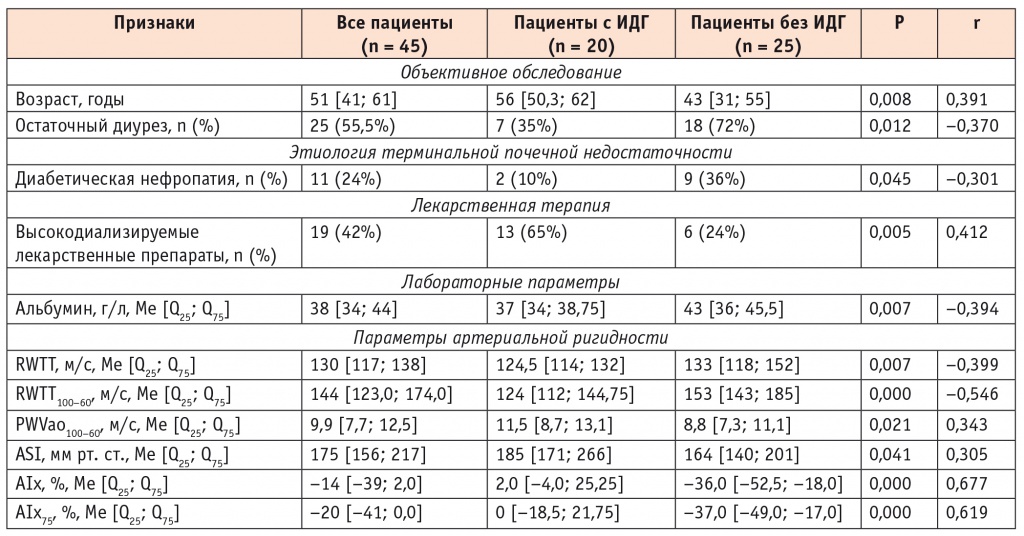
С помощью ROC-анализа (receiver operating characteristic) были определены пороговые значения количественных признаков с целью их последующего включения в многофакторную логистическую регрессию (рис. 1). Наиболее значимыми факторами, связанными с развитием ИДГ, оказались возраст ≥ 48 лет, анурия, отсутствие диабетической нефропатии, уровень альбумина ≤ 42,5 г/л, прием лекарственных препаратов с высоким диализным клиренсом, значения RWTT100–60 ≤ 134,5 м/с, PWVao100–60 ≥ 9,5 м/с, ASI ≥ 160 мм рт. ст., AIx ≥ –6,5%. Показатели AIx75 и RWTT были исключены из дальнейшего анализа по причине меньшей силы корреляции.
Рис. 1. Пороговые значения количественных признаков, по данным ROC-анализа
С использованием выявленных предикторов построены прогностические модели для оценки вероятности развития ИДГ, включающие и не включающие в себя показатели артериальной ригидности. С учетом возможности негативного влияния корреляции между предикторами на качество модели многофакторный анализ выполнен с применением обратного метода пошагового исключения переменных.
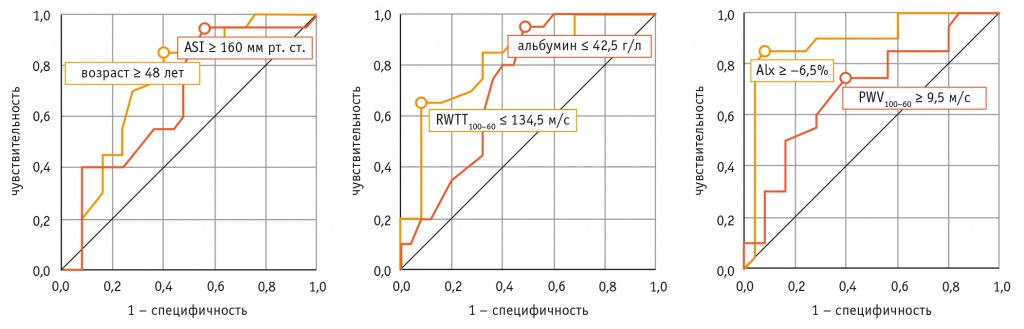
Для определения чувствительности и специфичности полученных математических моделей проведен ROC-анализ c построением ROC-кривой и указанием площади под кривой (area under the curve — AUC) для уравнений логистической регрессии, включающих переменные возраста, диабетической нефропатии и альбумина; RWTT100-60 и AIx; а также совокупную модель, учитывающую показатели RWTT100-60, AIx и диуреза (рис. 2).
Рис. 2. Значения ROC-кривых моделей логистической регрессии в оценке риска развития интрадиализной гипертензии у пациентов на гемодиализе. А — уравнение логистической регрессии включает переменные возраста, диабетической нефропатии и альбумина; В — RWTT100-60 и AIx; А+В — RWTT100-60, AIx и диурез
ИДГ была ассоциирована с возрастом пациента (ОР = 3,78; 95%-ный ДИ: 1,29–11,04) и таким показателем артериальной ригидности, как AIx (ОР = 7,75; 95%-ный ДИ: 2,65–22,7). Обратная корреляция наблюдалась между развитием ИДГ и RWTT100-60 (ОР = 0,27; 95%-ный ДИ: 0,14–0,53), наличием диабетической нефропатии (ОР = 0,34; 95%-ный ДИ: 0,094–1,251), остаточным диурезом (ОР = 0,43; 95%-ный ДИ: 0,21–0,87) и уровнем альбумина (ОР = 0,12; 95%-ный ДИ: 0,02–0,79).
Каждый из вариантов математической модели имеет достаточные показатели чувствительности и специфичности, однако включение параметров артериальной ригидности повышает ее предиктивную мощность с AUC = 0,886 до AUC = 0,978.
ОБСУЖДЕНИЕ
В последние годы наблюдается неуклонный рост числа пациентов с терминальной почечной недостаточностью, требующей проведения заместительной почечной терапии. Количество этих пациентов, преимущественно за счет получающих лечение программным ГД, постоянно увеличивается — в среднем на 10% в год[10, 11]. Эта тенденция нашла свое отражение в возросшем интересе научного сообщества к изучению больных на ГД (рис. 3).
Рис. 3. Динамика количества научных работ, посвященных пациентам на гемодиализе (по данным NSBI)
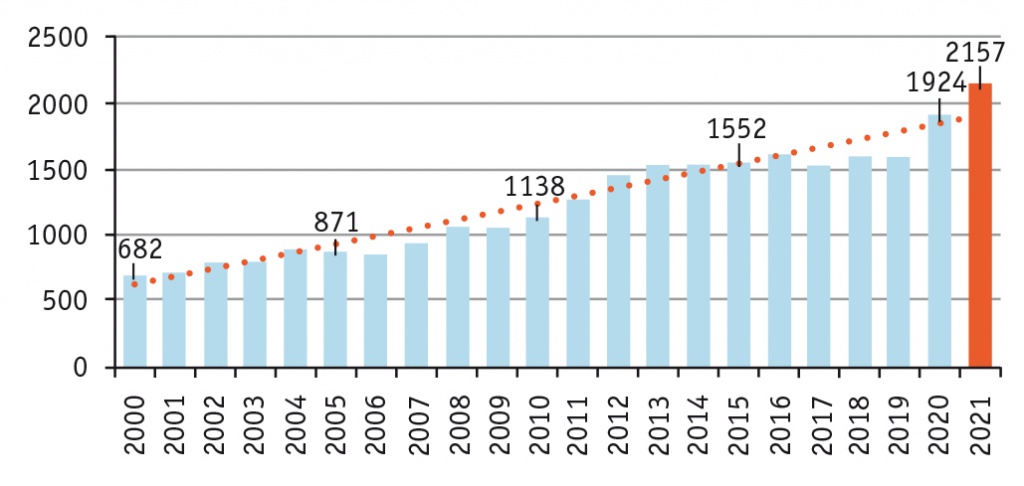
Вследствие прогресса медицинской науки и техники программного ГД среди причин летальности таких больных вместо уремически-ассоциированных состояний стала преобладать сердечно-сосудистая патология. Несмотря на это, многие аспекты патогенеза гемодинамических особенностей данной популяции, роль и место отдельных факторов риска остаются недостаточно изученными, а имеющиеся по этому вопросу данные весьма противоречивы.
По мере прогрессирования хронической болезни почек развиваются грубые нарушения кальций-фосфорного обмена, которые приводят к кальцификации аорты и артерий эластического типа. В условиях уремического окружения активизируется эндотелиальная дисфункция и растет общее периферическое сопротивление, что при наличии минеральных и костных нарушений заканчивается формированием атеросклероза. Введение пациента в программу заместительной почечной терапии также приводит к росту концентрации провоспалительных цитокинов[12]. Например, состав диализата, проникая через мембраны, вызывает повышенную продукцию ИЛ-6, а полимерные материалы (центральные венозные катетеры, артериовенозные графты) сами могут стать источниками хронического воспалительного ответа[13]. Таким образом, под действием повышенных уровней провоспалительных цитокинов снижается активность оксида азота и прогрессирует эндотелиальная дисфункция, приводя к ремоделированию артерий крупного и среднего калибра, обусловливающему повышение показателей артериальной ригидности.
Патофизиологические механизмы ИДГ остаются предметом дискуссий. Повышение интрадиализного АД может быть связано с неспособностью достичь оптимального «сухого веса» в условиях хронической объемной перегрузки, падением концентрации высокодиализируемых гипотензивных препаратов во время сеанса ГД, избыточной активностью ренин-ангиотензин-альдостероновой и симпатико-адреналовой систем, повышением уровня эндотелина 1 и уменьшением выработки оксида азота[14, 15].
Более глубокое понимание феномена ИДГ у пациентов на ГД позволит проводить своевременную профилактику и патогенетическое лечение данного осложнения, что в дальнейшем приведет к снижению летальности и повышению качества жизни пациентов на программном ГД.
ЗАКЛЮЧЕНИЕ
Показатели артериальной ригидности: индекс аугментации ≥ –6,5% и время распространения отраженной волны100–60 ≤ 134,5 м/с — были ассоциированы с большей частотой интрадиализной гипертензии (ИДГ), что может свидетельствовать о ведущей роли прогрессирующей артериальной ригидности в развитии интрадиализных сердечно-сосудистых осложнений. Высокое качество предложенной математической модели прогноза развития ИДГ (AUC = 0,978; 95%-ный ДИ: 0,945–1,00; p < 0,0001) позволяет использовать ее в клинической практике.
Поступила: 08.02.2022
Принята к публикации: 01.03.2022
________
1 Эквилибрированный показатель коэффициента очищения Kt/V по мочевине.







