Вопрос смертности от ССЗ для России чрезвычайно актуален. По данным Росстата, в 2013 г. смертность населения от болезней системы кровообращения составила 698,1 на 100 000 человек. На сегодняшний день ССЗ являются первой причиной смерти россиян и составляют 56,8% случаев.
Значительное число больных, у которых развилась сосудистая катастрофа, погибают в течение первых суток в результате шока или острой гипоксии мозга. Однако не менее значительна доля лиц, у которых констатируют смерть через несколько дней в связи с прогрессирующим ухудшением состояния и присоединением других патологических процессов, несмотря на оказываемую им специализированную медицинскую помощь. Есть веские основания предполагать, что в таких случаях существенную роль в танатогенезе играет развитие госпитальной и аспирационной пневмонии. В Российской Федерации в 2010 г. зарегистрировано 25 617 случаев внутрибольничных инфекций. Заболеваемость составила 0,8 на 1000 госпитализированных лиц.
Нозокомиальная пневмония (НП) — инфекционное заболевание, которое является одним из наиболее часто встречающихся в стационаре (оно второе по распространенности среди всех нозокомиальных инфекций, составляет 13–18% случаев) и самым частым у пациентов отделений реанимации и интенсивной терапии (> 45%). За последние 5 лет позитивных изменений в работе по учету больных НП не произошло. Регистрация заболеваний в большинстве лечебно-профилактических учреждениях остается на низком уровне, вместе с тем, по данным Роспотребнадзора, НП в России ежегодно переносят до 8% пациентов, или около 2 млн человек[1]. Особая категория НП у пациентов, находящихся на ИВЛ, так называемая вентилятор-ассоциированная пневмония, которая развивается у 9–27% от общего числа пациентов с интубацией трахеи.
Актуальность проблемы НП заключается в том, что, помимо высокой частоты встречаемости, данное заболевание характеризуется высокой летальностью, которая достигает 30–70%. Это может быть обусловлено тяжестью основного заболевания и наличием сопутствующих болезней, при этом определить так называемую атрибутивную летальность, т. е. непосредственно связанную с НП, бывает очень сложно. Тем не менее, согласно имеющимся данным, среди пациентов с НП она составляет от 10 до 50%.
На Международной конференции по проблемам инсультов (International Stroke Conference) (февраль 2009 г.) были представлены результаты крупного международного исследования, в котором сравнивались уровни выживаемости после инсультов в разных странах. Согласно этому анализу, среди изученных 192 стран на первом месте по уровню смертности от инсультов находится Россия (251 человек на 100 000 населения). Данная тенденция сохраняется в настоящее время: за 10 месяцев 2014 г. показатель составил 203,7 на 100 000 населения.
Пациенты с инсультом в острой фазе имеют повышенный риск развития инфекций, но, по данным разных авторов, частота инфекционных осложнений значительно варьируется (5–65% случаев). Это связано с различиями между выборками больных, дизайном исследований, методами определения инфекции[4, 5, 12], поэтому статистически значимые данные о частоте развития инфекций у пациентов после инсультов отсутствуют.
В исследовании, которое включало 14 293 пациента, пневмония являлась наиболее частой постинсультной инфекцией, связанной с ОР смертности (3,0)[5]. Учитывая значение инфекции в исходах инсультов, в настоящее время ученые исследуют новые лечебные подходы к инфекционным осложнениям, такие как профилактическое назначение антибиотиков[10].
W. F. Westendorp и соавт. провели системный обзор и метаанализ постинсультных инфекций[14]. Они изучили когортные и рандомизированные клинические исследования, в которых сообщалось о частоте возникновения таких инфекций. Всего было проанализировано 87 работ с общим числом пациентов 137 817. Изучение такого количества случаев позволило вывести статистически значимую оценку инфекций, развивающихся после инсульта. По данным обзора, частота возникновения пневмоний составляла 10% (95%-ный ДИ: 9–10%), в отделениях интенсивной терапии — 45% (95%-ный ДИ: 38–52%). Авторами не было найдено связи между возрастом или дисфагией и частотой развития пневмонии. Было показано, что данное заболевание является независимым фактором риска (ФР) неблагоприятного исхода и смерти после инсульта.
В работе других ученых было выявлено, что частыми возбудителями инфекционных осложнений являются Staphylococcus aureus и грамотрицательные бактерии, такие как Klebsiella pneumoniae, Pseudomonas aeruginosa, Escherichia coli или Enterobacter spp., реже штаммы Streptococcus species. Известно, что грамотрицательные бактерии и St. Aureus, которые находятся в содержимом ротоглотки, вызывают аспирационную пневмонию. Они часто провоцируют нозокомиальные инфекции. Штаммы стрептококка являются наиболее распространенными возбудителями внебольничной пневмонии. У инсультных пациентов они могут стать причиной внебольничной аспирационной пневмонии в случаях, когда аспирация возникает в момент развития инсульта[4]. Часто при постинсультной пневмонии не удается определить ее возбудитель. Количество культур у пациентов с пневмонией обычно невысокое; сбор материала затруднен у больных с инсультом из-за неврологического дефицита или нарушенного сознания. В некоторых случаях при подозрении на пневмонию выявляют неинфекционный аспирационный пневмонит или анаэробную инфекцию, определение которой требует специальных техник посева[7].
Частота развития инфекции связана также с клиническим состоянием пациентов. Исследования больных с более тяжелой формой инсульта и более низким уровнем сознания выявляют среди них широкую распространенность инфекций, в особенности пневмонии. Эти данные совпадают с более ранними исследованиями, в которых сообщается о ФР развития пневмонии[6]. Риск аспирации возрастает у этих пациентов из-за отсутствия у них защитных рефлексов и связан с уровнем нарушения сознания. В системном обзоре R. Martino и соавт. показано, что дисфагия возникает у 37–78% инсультных больных и повышает риск развития пневмонии в 3–11 раз у лиц с подтвержденной аспирацией[8]. Однако около половины пациентов с инсультом не имеют аспирации, что свидетельствует о наличии у них других механизмов, например вызванной инсультом иммуносупрессии[5].
Было выявлено, что частота развития инфекции выше у больных, находящихся в отделениях интенсивной терапии. Пациенты, которые поступают в реанимационное отделение, как правило, чаще подвергаются инвазивным процедурам и имеют более тяжелые формы инсультов. Инвазивные методы лечения, такие как ИВЛ, повышают риск развития инфекции за счет создания для нее входных ворот[13, 15].
В обзоре D. van de Beek и соавт. также показаны возможные стратегии, направленные на предупреждение инфекции у больных, перенесших инсульт. Некоторые из таких мероприятий, например профилактику аспирации, проводят в неврологических отделениях, что снижает летальность. Авторы показали, что инфекция может быть предупреждена за счет профилактического назначения антибиотиков. Сокращения летальности выявлено не было, однако исследования, рассмотренные в работе, были малочисленными и гетерогенными и функциональные исходы не изучались[11].
Ежегодно в России фиксируют более 600 000 случаев острого коронарного синдрома[2]. Пациенты с острым инфарктом миокарда (ОИМ) имеют ФР и сопутствующие болезни, предрасполагающие к развитию внутрибольничной инфекции. Анализу последствий инфекции в этой группе больных, ее распространенности и предикторам развития посвящено небольшое количество исследований. В работе M. C. Nash и соавт. частота пневмоний при ОИМ составляла 15% и значительно увеличивала летальность[9]. К ФР развития внутрибольничной инфекции относили женский пол, наличие сопутствующих заболеваний, проведение инвазивных процедур, в том числе ИВЛ.
Использование ИВЛ при ОИМ статистически значимо связано с развитием пневмонии[3]. Было показано, что риск ее возникновения возрастал при употреблении алкоголя, хроническом бронхите, ХОБЛ и не был связан с социально-демографическими характеристиками. Пневмония часто осложнялась острой почечной и сердечной недостаточностью.
Пациенты с развившимся инфарктом или острым нарушением мозгового кровоснабжения нуждаются в активной терапии на базе отделения интенсивной терапии или реанимации, так как у них имеются предпосылки для формирования пневмонии. Среди таких предпосылок можно выделить изменение биомеханики дыхания вследствие болевых ограничений и нарушений нервной регуляции, аспирацию (особенно часто при бульбарных нарушениях, а также синкопе), интубацию, нарушение механизмов защиты (вегетативной регуляции, мукоцилиарного клиренса, центральных механизмов регуляции иммунного ответа и др.) от колонизации и инвазии инфекционных агентов.
Развитие пневмонии у пациентов с сосудистыми катастрофами существенно ухудшает их состояние вследствие интоксикации, а также нарастания нагрузки на сердечно-сосудистую систему из-за усугубления вентиляционно-перфузионной диссоциации и истощения компенсаторных механизмов.
Ввиду определенных сложностей и сложившейся практики, пневмония редко рассматривается как причина смерти, но несколько чаще как смертельное осложнение. В известной мере это искажает истинное значение пневмонии как фактора танатогенеза при сосудистых катастрофах. Важно определить истинную роль пневмонии как смертельного осложнения или сочетанного заболевания при сосудистых катастрофах не только со статистических, но и с клинических позиций, что позволит разрабатывать эффективные способы профилактики, рекомендации по своевременной диагностике и лечению заболевания.
Цель исследования: оценить роль пневмонии в танатогенезе у больных с инфарктом миокарда и инсультом.
МАТЕРИАЛЫ И МЕТОДЫ
Для оценки роли пневмонии в танатогенезе у пациентов с сердечно-сосудистыми катастрофами мы изучили 140 протоколов патологоанатомических вскрытий и архивный материал историй болезни пациентов, умерших в отделениях Городской клинической больницы № 33 имени проф. А. А. Остроумова г. Москвы. Среди них было 54 (38,6%) мужчины и 86 (61,4%) женщин. Средний возраст пациентов на момент госпитализации составлял 76,6 лет. При анализе структуры основного клинического диагноза выявлено, что ишемический инсульт был у 84 (60,0%) пациентов, геморрагический — у 33 (23,6%), инфаркт миокарда — у 23 (16,4%). Средняя длительность госпитализации по медиане составляла 10 дней (5; 20). Изучали анамнез пациентов, данные объективных осмотров и клинических обследований, результаты лабораторно-инструментальных исследований, вскрытий и гистохимических исследований препаратов легких. Все данные кодировали и заносили в программу Microsoft Excel (Microsoft Corporation, США), статистическую обработку осуществляли с помощью программы SPSS Statistics (Statistical Package for the Social Sciences, США).
Для оценки прогностической значимости предикторов пневмонии у умерших пациентов с ССЗ применяли метод множественного логистического регрессионного анализа. Развитие пневмонии представлено в виде бинарной переменной, где 0 — отсутствие пневмонии, 1 — ее наличие.
В качестве возможных предикторных переменных рассматривали возраст, пол, длительность течения заболевания, основной и сопутствующие диагнозы, наличие клинических симптомов пневмонии, применение и длительность ИВЛ. Математически модель логистической регрессии выражает зависимость логарифма шанса (логита) от линейной комбинации факторных переменных. Соответственно, вероятность прогнозируемого события может быть выражена через следующее уравнение:
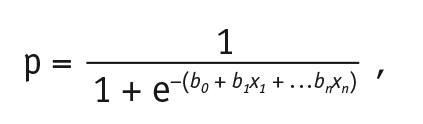
где:
р — вероятность прогнозируемого события;
е — математическая константа 2,72 (основание натурального логарифма);
b0 — константа модели;
b1 — коэффициент при предикторной переменной х1, показывающий изменение логарифмических шансов, вызванное единичным изменением независимой переменной;
n — порядковый номер предиктора, включенного в уравнение.
Предикторы, включенные в уравнение, прошли проверку на наличие коллинеарности и автокорреляции.
Построение логистической регрессионной модели осуществляли методом пошагового включения прогностических факторов с определением минимального набора предикторов и использовали коэффициент детерминации Нейджелкерка (значения R2, показывающего долю влияния всех предикторов модели на дисперсию зависимой переменной).
Проверку статистической значимости модели осуществляли при помощи критерия χ2. При значении р < 0,05 нулевая гипотеза о незначимости модели отвергалась. Соответствие модели использованным данным оценивали с помощью критерия согласия Хосмера — Лемешева. При р > 0,05 принималась гипотеза о согласованности модели. Интерпретацию параметров логистической регрессии производили на основе величины exp(b): если коэффициент b являлся положительным, то exp(b) > 1, и шансы наступления прогнозируемого события возрастали, отрицательное значение коэффициента b указывало на снижение шансов (exp(b) < 1). Чувствительность и специфичность полученной модели с включением отобранных предикторов оценивали при помощи ROC-анализа (ROC — receiver operating characteristic). Количественную интерпретацию результатов проводили по форме ROC-кривых с оценкой показателя AUC (area under ROC curve) — площади под ROC-кривой.
Диагноз пневмонии устанавливали на основании анализа клинических данных (появления или изменения характера кашля, появления тахипноэ, локально выслушиваемой инспираторной крепитации, влажных хрипов, бронхиального дыхания, бронхиальной гиперсекреции, лихорадки более 38,2 С°), лабораторных показателей (лейкопении < 4,0 × 109/л или лейкоцитоза > 12,0 × 109/л, палочкоядерного сдвига более чем на 10% от нормы, CРБ, гнойной мокроты), рентгенологических признаков (появления «свежих» очагово-инфильтративных изменений в легких), заключения патоморфологического исследования легочной ткани. Диагноз пневмонии устанавливали при совокупности двух и более клинических признаков, изменении одного из лабораторных показателей, а также данных рентгенологических исследований и патоморфологических заключений. Пневмония была верифицирована в 96 (68,6%) случаях.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате проведенного анализа было выявлено, что диагноз пневмонии за время стационарного лечения был документально зарегистрирован у 79 (56,4%) пациентов, а при направлении на патологоанатомическое вскрытие указывался у 123 (87,9%).
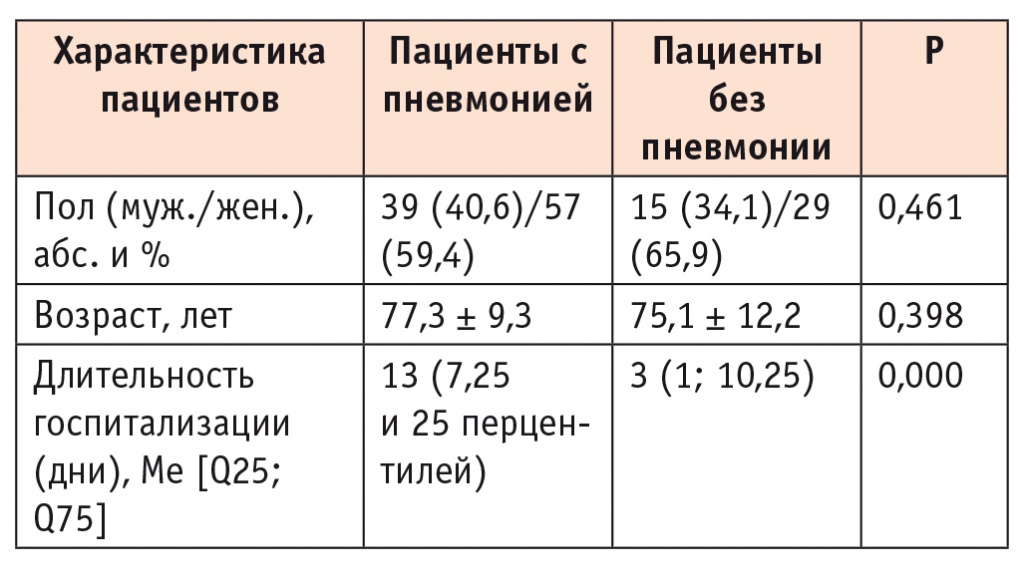
По результатам вскрытий, патоморфологические признаки пневмонии выявлены в 75 (53,6%) случаях, а как основная причина смерти пневмония указана в 21 (15,0%) патологоанатомическом протоколе, среди которых в 7 (33,3%) случаях это заболевание явилось непосредственной причиной смерти, но не регистрировалось в истории болезни за время стационарного лечения пациентов (т. е. не было диагностировано при жизни). Статистически значимых различий по полу и возрасту у пациентов с пневмонией и без таковой выявлено не было (табл. 1).
Таблица 1
Сравнительная характеристика пациентов с пневмонией и без таковой по полу, возрасту и длительности госпитализации
Из общего количества пациентов пневмония развилась у 96 (68,6%). При анализе выборки по основному клиническому диагнозу было выявлено, что в 65 (67,7 ± 4,8%) случаях внутрибольничная пневмония возникла у пациентов с диагнозом ишемический инсульт и у 24 (23 ± 4,4%) с геморрагическим инсультом. При этом среди пациентов с установленной пневмонией ишемический инсульт встречался статистически значимо чаще, чем среди пациентов, у которых пневмония отсутствовала: 65 (67,7 ± 4,8%) против 19 (43,2 ± 7,5%) (р < 0,001). У больных без пневмонии статистически значимо чаще основным клиническим диагнозом был инфаркт миокарда: 15 (34,1 ± 8,3%) случаев против 8 (8,3 ± 2,8%) (р < 0,001), когда пневмония развилась у пациентов с основным клиническим диагнозом инфаркт миокарда. Данная закономерность характеризуется средней силой связи по критерию φ (0,33; р < 0,001).
Частота развития заболевания повышалась с увеличением продолжительности госпитализации (r = 0,498; р < 0,001). Клиническими признаками, коррелирующими с развитием пневмонии, были гипертермия (r = 0,414; p < 0,001), лейкоцитоз (r = 0,450; p < 0,001), аускультативные изменения (r = 0,289; p = 0,001), рентгенологические изменения (r = 0,346; p < 0,001).
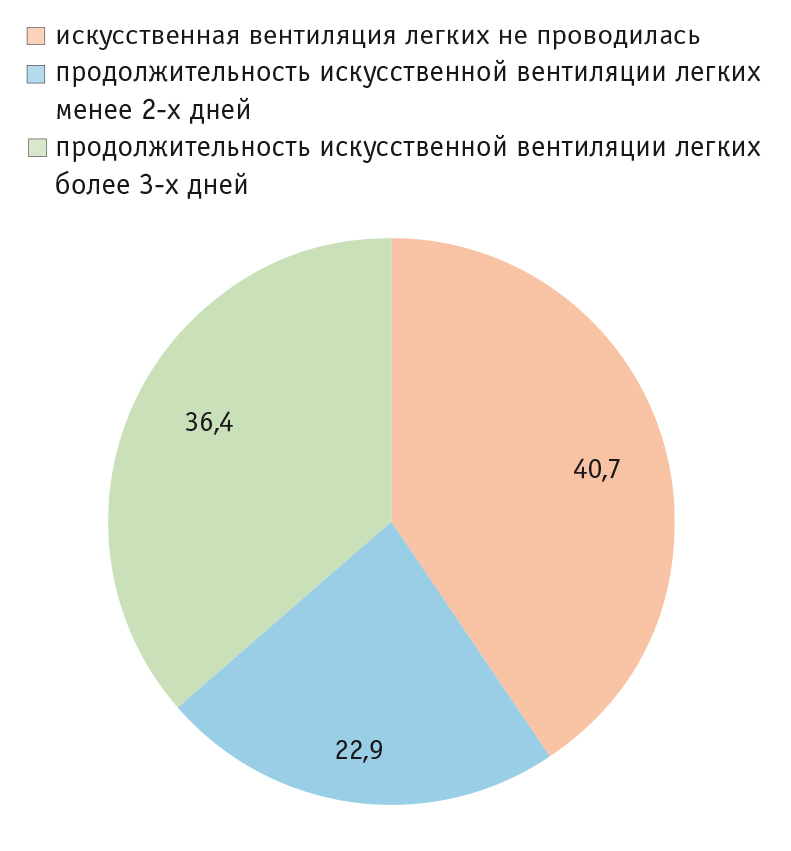
Из-за риска развития вентилятор-ассоциированной пневмонии пациенты были разделены на группы. Больных, которым не проводили ИВЛ, было 57 (40,7%), пациентов, получавших терапию менее 3-х суток, — 32 (22,9%), лиц, которым вентиляционную поддержку оказывали более 3-х суток, — 51 (36,4%).
В 44 (45,8 ± 5,1%) случаях пневмония развилась у пациентов с длительностью ИВЛ более 3-х суток, и только у 7 (15,9 ± 2,7%) пациентов этой группы пневмония отсутствовала. Данная закономерность характеризуется средней силой связи по критерию φ (0,36; р < 0,001). У больных с длительностью ИВЛ менее 3-х суток пневмония чаще не развивалась (рис. 1).
Рис. 1. Пневмония и длительность искусственной вентиляции легких, %
Корреляционный анализ выявил, что риск развития пневмонии выше у пациентов, находящихся на ИВЛ более 3-х суток (r = 0,289; p = 0,001).
Логистическая регрессионная модель, оценивающая значимость предикторов пневмонии у умерших пациентов с болезнями системы кровообращения, выражена следующим уравнением:
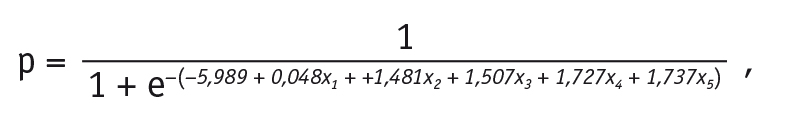
где:
р — вероятность наличия пневмонии;
х1 — возраст, лет (b1 = 0,045);
х2 — наличие гипертермии (есть — 1, нет — 0) (b2
= 1,481);
х3 — наличие лейкоцитоза (есть — 1, нет — 0) (b2
= 1,501);
х4 — наличие аускультативных признаков: крепитации, влажных хрипов (есть — 1, нет — 0) (b3 = 1,727);
х5 — основной клинический диагноз (инфаркт миокарда — 0, острое нарушение мозгового кровообращения — 1) (b4 = 1,737);
константа b0 = - 5,989.
Данная модель является статистически значимой. Значимость модели на 5-м шаге включения предикторов соответствовала р < 0,001. Согласно критерию Хосмера — Лемешева, модель является согласованной (р = 0,812). Результаты построения регрессионной модели с включением выбранных предикторов на 5-м шаге представлены в таблице 2.
Таблица 2
Сводные данные по регрессионной модели прогнозирования пневмонии у пациентов, умерших от болезней системы кровообращения
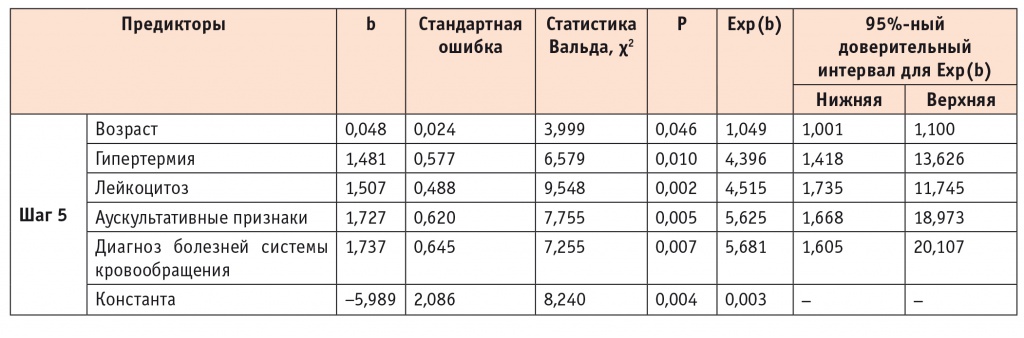
Таким образом, значимыми предикторами развития пневмонии у пациентов, умерших от БСК, являются возраст, гипертермия, лейкоцитоз, аускультативные признаки и диагноз острого нарушения мозгового кровообращения. При этом для данной модели коэффициент детерминации R2 составил 0,476, что показывает статистически значимое объяснение данными ФР развития пневмонии у пациентов исследуемой группы на 47,6%.
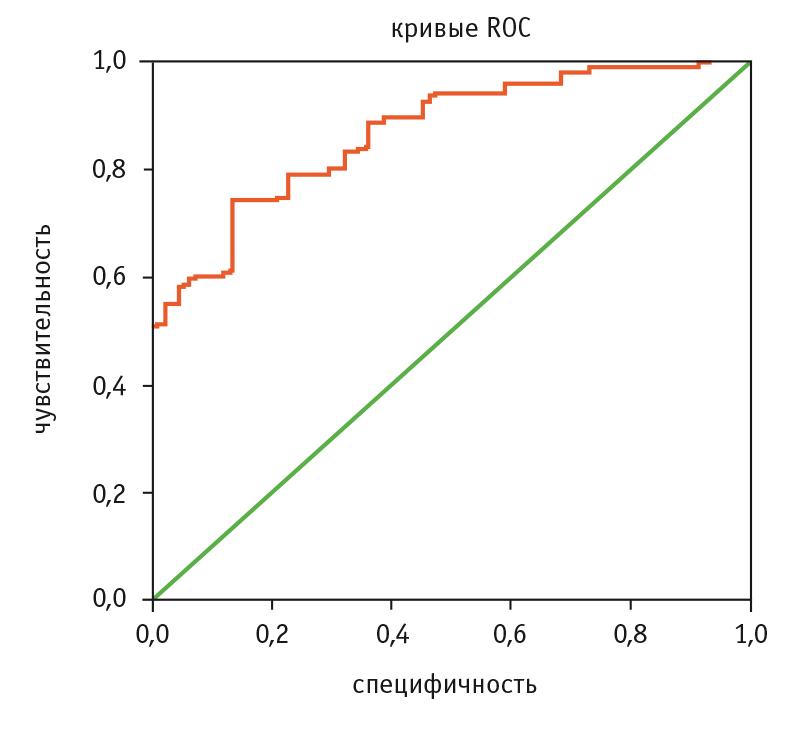
Доля корректных предсказаний об отсутствии пневмонии в исследуемой выборке (специфичность) составила 65,9%, о наличии пневмонии (чувствительность) — 83,3%. Общий процент корректных предсказаний составил 77,9%. По результатам построения ROC-кривой показатель AUC составил 0,868 ± 0,030 (95%-ный ДИ: 0,810–0,926; р < 0,001), что определяет качество прогностической модели выше среднего среднего (рис. 2).
Рис. 2. ROC-кривая логистической регрессионной модели прогнозирования пневмонии у пациентов, умерших от болезней системы кровообращения, %
ЗАКЛЮЧЕНИЕ
В результате проведенного анализа было выявлено, что нозокомиальная пневмония развилась в 96 (68,6%) случаях и у 21 (15%) пациента явилась непосредственной причиной смерти. Наряду с гиподиагностикой, выявлена гипердиагностика (диагноз пневмонии, выставленный при направлении на вскрытие, неподтвержденный клиническими и патоморфологическими данными). Оценка профилактики и своевременности диагностики пневмонии, а также адекватности ее терапии анализируется и будет представлена в последующих публикациях.








