ВВЕДЕНИЕ
В последние десятилетия в клиническую практику активно внедряются генно-инженерные биопрепараты. Одним из первых появился ритуксимаб — химерное моноклональное антитело, обладающее специфиичностью к антигену CD20, который экспрессируется на клеточной мембране пре-В- и зрелых В-лимфоцитов. Сначала его стали использовать для лечения неходжкинских лимфом. В дальнейшем показания к применению расширились. В настоящее время он официально разрешен для лечения ревматоидного артрита, гранулематозного и микроскопического полиангиита, вульгарной пузырчатки. Кроме того, накапливается опыт его применения и при других иммуновоспалительных ревматических заболеваниях: системной красной волчанке, системной склеродермии, синдроме/болезни Шёгрена[1].
В процессе лечения происходит истощение пула зрелых В-лимфоцитов на периферии (как циркулирующих, так и связанных с лимфоидной тканью). Продолжительность эффекта деплеции составляет 24 недели и более, а восстановление периферического пула происходит через 6–12 месяцев после завершения курса лечения[2].
Ранее считалось, что ритуксимаб не влияет или слабо влияет на зрелые плазматические клетки, секретирующие иммуноглобулины[3]. В дальнейшем оказалось, что на фоне лечения может развиваться транзиторная гипоиммуноглобулинемия, и более того, появились данные, что дефицит антител в ряде случаев возникает уже после завершения курса лечения[4–6]. О распространенности данного феномена и сроках его развития судить сложно, так как сведений в литературе не так уж много, а в рутинной практике при лечении генно-инженерными биопрепаратами мониторинг уровней сывороточных иммуноглобулинов, к сожалению, проводится нечасто[7].
Ниже приводится клиническое наблюдение, которое иллюстрирует возможность развития селективного дефицита IgA через несколько лет после завершения курса лечения ритуксимабом.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Больная Г., 56 лет, с 2005 г. стала отмечать боли в лучезапястных, локтевых суставах, сухость во рту, ощущение рези в глазах. В общем анализе крови периодически отмечалась лейкопения до 2,9 × 109/л. В 2006 г. у нее выявлен рак правой молочной железы T1N1M0, проведена правосторонняя радикальная мастэктомия с последующей лучевой терапией и полихимиотерапей (4 курса: доксорубицин + фторурацил + циклофосфан).
В 2008 г. из-за нарастания интенсивности артралгий и «сухого синдрома», появления припухлости в области околоушных слюнных желез больная была госпитализирована в ЦРБ по месту жительства, установлен диагноз болезни Шёгрена, осложненной В-клеточной MALT-лимфомой околоушных слюнных желез. Диагноз лимфомы поставлен на основании данных УЗИ слюнных желез, морфологического и иммуноморфологического исследования биоптатов околоушных и малых слюнных желез.
Пациентка получала терапию ритуксимабом 500 мг в/в капельно и преднизолоном 500 мг в/в капельно, выписана с улучшением состояния (уменьшились артралгии и проявления «сухого синдрома»).
В дальнейшем больная наблюдалась в ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского» и ФГБНУ «НИИР им. В.А. Насоновой», прошла 4 курса R-CHOP, затем продолжалась монотерапия ритуксимабом по 500 мг 1 раз в 4 месяца до марта 2013 г., потом был перерыв в течение 1 года из-за отсутствия препарата, в этот период пациентка по назначению ревматолога получала 4 мг метилпреднизолона через день.
В 2014 г., по данным гистологического и иммуногистохимического исследования, опухолевая лимфоидная пролиферация отсутствовала, но ревматолог принял решение снова назначить ритуксимаб для продолжения лечения болезни Шёгрена.
В августе 2015 г. из-за частых ОРВИ (до 8 раз в год), затяжных риносинуситов и выраженного снижения уровня сывороточного IgA курс был прекращен, больная продолжала получать 4 мг метилпреднизолона через день.
В декабре 2017 г. в связи с жалобами на нарастание болевого синдрома, сухости во рту и рези в глазах ее направили к аллергологу-иммунологу для исследования иммунного статуса и решения вопроса о возможности возобновления терапии ритуксимабом.
При осмотре состояние удовлетворительное. Кожные покровы и видимые слизистые обычной окраски, умеренно влажные. Периферические лимфоузлы не пальпировались. Суставы визуально не изменены, движения в полном объеме. В легких дыхание везикулярное, хрипы не выслушивались. ЧСС — 76 в мин. Язык влажный, обложен белым налетом. Живот мягкий, безболезненный. Нижняя граница печени — по краю реберной дуги. Селезенка не пальпировалась. Физиологические отправления в норме.
УЗИ: лимфатические узлы шеи и подчелюстные не увеличены, патологические образования мягких тканей передне-боковых отделов шеи не визуализировались, диффузные невыраженные изменения слюнных желез, диффузные изменения щитовидной железы по типу аутоиммунного тиреоидита.
Биопсия малой слюнной железы: признаки опухолевого роста не обнаружены.
Консультация гематолога: MALT-лимфома слюнных желез, состояние после монотерапии ритуксимабом, ремиссия. В настоящее время в специфической терапии не нуждается.
Лабораторные исследования. Результаты общих анализов крови и мочи в пределах нормы. Уровень СРБ тоже в норме, антиядерные антитела положительные, анти-SS-A — 90,7 ЕД/мл (норма: 0–15 ЕД/мл), анти-SS-B — 1,8 ЕД/мл (норма: 0–15 ЕД/мл), ревматоидный фактор — 61,5 ЕД/мл (норма: 0–30 ЕД/мл). Субпопуляции лимфоцитов: CD3+ — 81% (норма: 55–85%), CD3+CD4+ — 29% (норма: 31–49%), CD3+CD8+ — 51% (норма: 19–37%), CD3–CD16/56+ — 11% (норма: 6–20%), CD19+ — 5% (норма: 5–19%). Уровень IgG — 11,8 г/л (норма: 7,5–18,0 г/л), IgM — 3,2 г/л (норма: 0,5–2,5 г/л), концентрация IgA существенно снижена — до 0,035 г/л (норма: 0,7–3,5 г/л).
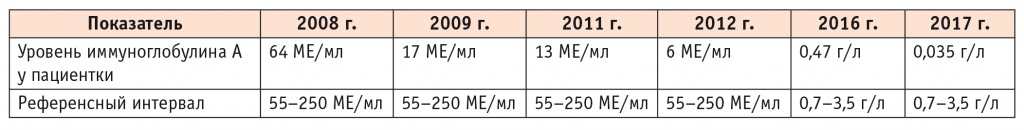
На консультации у иммунолога больная предъявила результаты ранее проведенных исследований содержания иммуноглобулинов классов А, М, G в сыворотке крови. Уровни IgG и IgM все время были в пределах нормы. Результаты лабораторного мониторинга содержания IgA представлены в таблице.
Таблица
Содержание иммуноглобулина A в сыворотке крови у пациентки Г. в динамике
С учетом низкой активности болезни Шёгрена, отсутствия прогрессирования MALT-лимфомы и риска возобновления инфекционных осложнений на фоне терапии ритуксимабом рекомендовано от лечения данным препаратом воздержаться. Больной увеличили дозу метилпреднизолона до 4 мг ежедневно, отмечался положительный эффект.
В дальнейшем у нее регулярно проводили мониторинг уровней иммуноглобулинов в сыворотке крови, содержание IgA оставалось критически низким, что подтверждает необратимость изменения его продукции.
В декабре 2019 г. в связи с нарастанием сухости во рту и рези в глазах принято решение о возобновлении курсовой терапии ритуксимабом (инфекционный синдром уже в течение 2 лет отсутствовал), но из-за пандемии COVID-19 лечение пришлось отложить. С августа 2020 г. пациентка получает ритуксимаб (первый курс — 1000 мг, затем по 500 мг 1 раз в 6 месяцев), наблюдается положительная клиническая динамика, за этот период зафиксированы лишь 2 легких эпизода острых респираторных инфекций, что позволяет продолжать лечение.
ОБСУЖДЕНИЕ
Пациентка Г. в течение нескольких лет получала ритуксимаб. Следует отметить, что если неходжкинские лимфомы считаются прямым показанием к применению данного препарата, то его назначение при болезни Шёгрена до сих пор остается off lable, является предметом дискуссий, а результаты лечения весьма неоднозначны[1, 8, 9]. В частности, мало данных о долгосрочных (более 1 года) результатах терапии ритуксимабом и результатах его назначения при наличии лимфомы.
Развитие гипоиммуноглобулинемии в процессе курсового лечения ритуксимабом — достаточно распространенное явление, особенно при длительной терапии. Чаще наблюдается снижение уровня IgG, несколько реже — IgM, существенно реже — IgA[5, 10]. Вопрос, почему чаще встречается снижение содержания именно IgG, до сих пор остается открытым. Если появление дефицита антител на фоне лечения ритуксимабом объяснимо, то конкретные механизмы развития вторичной гипоиммуноглобулинемии в отдаленные сроки после завершения лечения ритуксимабом до сих пор не выяснены. Вероятно, имеют значение такие факторы, как доза препарата, количество инфузий и интервалы между ними, а также особенности течения самого аутоиммунного заболевания[6, 10, 11].
Вполне возможно, что ритуксимаб каким-то образом у генетически предрасположенных пациентов запускает механизмы, аналогичные развитию первичных иммунодефицитов («врожденных ошибок иммунитета»). В итоге это может приводить к нарушению переключения лимфоцитов на синтез того или иного класса иммуноглобулинов (в данном случае IgA) или к нарушению созревания Ig-продуцирующих лимфоцитов.
Безусловно, всегда следует проводить дифференциальный диагноз с первичными иммунодефицитами. Нередко подобные пациенты годами наблюдаются у врачей других специальностей, прежде чем им поставят правильный диагноз[12]. Такой вариант первичного иммунодефицита, как селективный дефицит IgА, в 80–90% случаев протекает бессимптомно, а в остальных случаях может носить разные клинические «маски»: инфекции респираторного тракта или ЖКТ, аллергопатология, аутоиммунные заболевания, реже — лимфопролиферативные заболевания.
Существует мнение, что у этих больных выше риск неопластической трансформации[13].
В данном случае сочетание болезни Шёгрена с MALT-лимфомой и наличие рака молочной железы в анамнезе вполне могли бы уложиться в указанный диагноз. Однако у пациентки исходный уровень IgA (2008) был нормальным. Это свидетельствует в пользу того, что его дефицит развился вторично. Обращает на себя внимание, что через год после отмены препарата (в 2016 г.) наметилась отчетливая тенденция к повышению содержания IgA, но в 2017 г. (то есть более чем через 2 года после отмены препарата) можно было констатировать, что развился селективный дефицит IgA. В то же время содержание В-лимфоцитов полностью восстановилось.
Хорошо известно, что у многих пациентов c дефицитом антител могут возникать инфекционные осложнения, увеличивается частота летальных исходов. Однако наряду с работами, в которых показано, что наличие и степень гипогаммаглобулинемии при терапии ритуксимабом коррелируют с риском и тяжестью инфекционного синдрома и летальностью[6, 11, 14, 15], есть и сообщения об отсутствии такой взаимосвязи[10, 16, 17]. Нередко даже при выраженном дефиците антител инфекционный синдром длительное время отсутствует[4].
Четких инструкций по тактике ведения больных со вторичным дефицитом антител (кого и как лечить) на сегодняшний день не существует. Безусловно, при развитии тяжелых инфекционных осложнений необходима заместительная терапия иммуноглобулином человека нормальным, а продолжительность антимикробной терапии должна быть больше. При снижении уровня IgG и отсутствии инфекционного синдрома профилактическое введение иммуноглобулинов является спорным, нет четких критериев, при каком уровне IgG следует их назначать, хотя есть данные, что это снижает риск тяжелой инфекционной патологии[7].
При селективном дефиците IgA (и первичном, и вторичном), как правило, тяжелые инфекционные осложнения не наблюдаются, поэтому заместительная терапия иммуноглобулинами не проводится.
Надо еще учитывать, что у некоторых пациентов могут вырабатываться антитела к собственному IgA, поэтому при переливании цельной крови или плазмы, а также применении препаратов иммуноглобулинов (особенно при лечении Пентаглобином, препаратом с достаточно высоким содержанием IgA) могут возникать анафилактические реакции.
К сожалению, зарегистрированных диагностических наборов для определения антител к IgA на сегодняшний день нет. Кроме того, нельзя исключить, что в дальнейшем могут уменьшаться уровни иммуноглобулинов других классов, и тогда встанет вопрос о проведении заместительной терапии, поэтому мониторинг концентраций иммуноглобулинов в сыворотке крови крайне важен.
ЗАКЛЮЧЕНИЕ
Данное клиническое наблюдение подтверждает, что, выбирая ритуксимаб или другие антиВ-клеточные препараты в качестве средств базисной терапии, нужно помнить о возможном развитии гипоиммуноглобулинемии как в процессе лечения, так и в отдаленном периоде. Перед началом лечения ритуксимабом следует обязательно определять исходные уровни сывороточных иммуноглобулинов для оценки риска инфекционных осложнений и выявления первичных иммунодефицитов и проводить их мониторинг даже после отмены препарата, особенно при развитии инфекционной патологии.
Поступила: 11.08.2022
Принята к публикации: 14.09.2022








