Классические симптомы АДБ включают макроцитарную (реже нормоцитарную) анемию с ретикулоцитопенией, дебютирующую на первом году жизни (в половине случаев — до 3 месяцев), при относительно нормальном числе нейтрофилов и тромбоцитов. Для таких пациентов характерен нормоклеточный костный мозг с аплазией эритроидного ростка кроветворения, сохранным миелопоэзом и адекватным числом мегакариоцитов. Нередко увеличена активность аденозиндезаминазы эритроцитов, повышена концентрация фетального гемоглобина (Hb) [4, 13, 20].
С появлением молекулярно-биологической диагностики выявлено значительное число случаев АДБ с «неклассическими» проявлениями. У таких пациентов возможны незначительные гематологические изменения или даже их полное отсутствие в сочетании с врожденными аномалиями, характерными для АДБ [26, 28].
Более чем у половины больных АДБ присутствуют врожденные аномалии развития (краниоцефальные аномалии, аномалии кистей рук, особенно большого пальца), встречаются врожденные пороки сердца (дефект межжелудочковой или межпредсердной перегородки, коарктация аорты, тетрада Фалло) и мочеполовой системы (подковообразная почка, удвоение мочевыводящих путей, гипоспадия). Примерно у трети пациентов с АДБ отмечают низкий рост, обусловленный, однако, не только конституциональными особенностями, но и побочными эффектами терапии (перегрузкой железом вследствие постоянных гемотрансфузий, длительным приемом ГК) [4, 20, 26, 28].
АДБ выделили в самостоятельную нозологическую единицу в 1938 г. [10]. Однако первый успешный шаг к пониманию патогенеза заболевания был сделан только в 1999 г., когда у 10 из 40 обследованных пациентов обнаружили мутации в гене, кодирующем RPS19 — структурный белок малой субъединицы рибосом [12]. Дальнейшие исследования подтвердили наличие различных вариантов мутаций в одном из аллелей гена RPS19 приблизительно у 25% больных [18, 22].
Позднее у пациентов с АДБ были обнаружены более редкие мутации еще в 9 генах, кодирующих рибосомные белки. Пять из этих белков относятся к малой субъединице рибосом (RPS7, RPS10, RPS17, PPS24 и RPS26) и еще четыре — к большой (RPL5, RPL11, RPL26 и RPL35A) [6, 8, 9, 11, 14–17]. Мутации в генах рибосомных белков обнаруживают более чем у 60% пациентов с АДБ [25–27]. Недавно описаны мутации в гене GATA1 — эритроидного фактора транскрипции [24].
Около половины случаев заболевания АДБ спорадические, остальные — семейные, наследуются по аутосомно-доминантному типу с неполной пенетрантностью и различной экспрессивностью даже в пределах одной семьи [6].
В основе терапии АДБ лежит применение глюкокортикоидов (ГК), при отсутствии ответа на них или в возрасте менее года — трансфузии эритроцитной массы с последующей хелацией железа и, реже, трансплантация гемопоэтических стволовых клеток [1, 26]. Согласно данным Североамериканского регистра больных АДБ, около 80% пациентов инициально отвечают на терапию ГК, однако более половины из них впоследствии прекращают прием ГК из-за утраты ответа или неприемлемых побочных эффектов [27].
Регулярные трансфузии эритроцитной массы служат второй линией терапии АДБ. Основное и закономерное осложнение регулярных трансфузий — перегрузка организма железом, вследствие чего необходимо раннее начало адекватной хелаторной терапии [1, 26]. Согласно некоторым литературным данным, пациенты с АДБ более предрасположены к быстрому развитию тяжелой перегрузки железом по сравнению с другими трансфузионно-зависимыми больными (в частности, с большой формой β-талассемии) [5, 23].
Ниже приведено описание клинического наблюдения за ребенком, длительно получавшим заместительные трансфузии эритроцитной массы после утраты первоначального ответа на ГК и продолжительно испытывавшим посттрансфузионную перегрузку железом.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Пациентка Б., 1997 г. р., находилась под наблюдением гематолога с 1999 года.
С первых суток жизни у девочки отмечена глубокая анемия (концентрация Hb при рождении — 93 г/л), первая заместительная трансфузия эритроцитной массы проведена в родильном доме. Диагноз АБД установлен в возрасте 4 месяцев на основании характерной клинической картины, данных общего анализа крови и миелограммы.
До 3-летнего возраста пациентка получала ежемесячные трансфузии эритроцитной взвеси. В ноябре 2000 г. начата терапия ГК: проведен недельный курс метилпреднизолона в дозе 5 мг/кг в сутки с дальнейшим снижением дозы. На фоне приема метилпреднизолона достигнута трансфузионная независимость — с января 2001 г. девочка не нуждалась в заместительной терапии. Для сохранения медикаментозной компенсации гемопоэза девочке продолжена терапия метилпреднизолоном в дозе 1 мг/кг в сутки в альтернирующем режиме. Дальнейшее снижение дозы происходило медленно, к августу 2005 г. удалось снизить дозу препарата до 0,57 мг/кг в сутки через день. На фоне терапии уровень Hb стойко сохранялся выше 100 г/л.
Однако в июне 2006 г., после перенесенного острого бронхита, у ребенка отмечено резкое падение концентрации Hb до 83 г/л, повлекшее за собой необходимость увеличения дозы метилпреднизолона до 1 мг/кг в сутки через день. Вновь был достигнут гематологический ответ, однако после еще одного инфекционного заболевания в декабре 2006 г. уровень Hb снова снизился до 80 г/л. Дозу метилпреднизолона увеличили до 1,2 мг/кг в сутки через день — вновь с положительным эффектом, но развившиеся многочисленные побочные эффекты терапии ГК (отставание в физическом развитии, экзогенный синдром Кушинга, остеопороз, лекарственная катаракта обоих глаз) потребовали отмены метилпреднизолона с апреля 2007 г. После нее отмечено неуклонное снижение концентрации Hb. С ноября 2007 г. (возраст ребенка — 10 лет) была возобновлена регулярная ежемесячная заместительная терапия эритроцитной взвесью.
Повышение концентрации ферритина сыворотки крови (до 1480 мгк/л) впервые выявлено в ноябре 2008 г. Через год, в октябре 2009 г., концентрация ферритина составила 2950 мкг/л, начата хелаторная терапия препаратом деферазирокс в дозе 1000 мг/сут (< 30 мг/кг в сутки). Через 1,5 месяца после начала приема препарат был отменен в связи с развитием токсического гепатита (повышения активности печеночных трансаминаз до 2000 Ед/л). С июня 2010 г. по февраль 2012 г. девочка получала дефероксамин в дозе 2000 мг в сутки подкожно капельно. В связи с техническими сложностями хелаторную терапию проводили нерегулярно.
В августе 2013 г. ребенок проходил обследование в ФНКЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева. При осмотре обращали на себя внимание стигмы дизэмбриогенеза (двусторонний эпикант, низкая линия роста волос на лбу, крыловидная шея), отставание в физическом развитии. В возрасте 15 с половиной лет рост девочки составлял 136 см (менее 3-го центиля).
Отмечалась нормохромная нормоцитарная гипорегенераторная анемия (концентрация Hb — 79 г/л, MCV — 85 фл, MCH — 29 пг, Ret 1‰) при сохранном числе тромбоцитов и лейкоцитов (число тромбоцитов — 192 тыс/мкл, лейкоцитов — 5 тыс/мкл). Обнаружены выраженная гиперферритинемия (4277 мкг/л), умеренное повышение активности печеночных трансаминаз (АЛТ — 112 Ед/л, АСТ — 62 Ед/л), остальные показатели находились в пределах нормы.
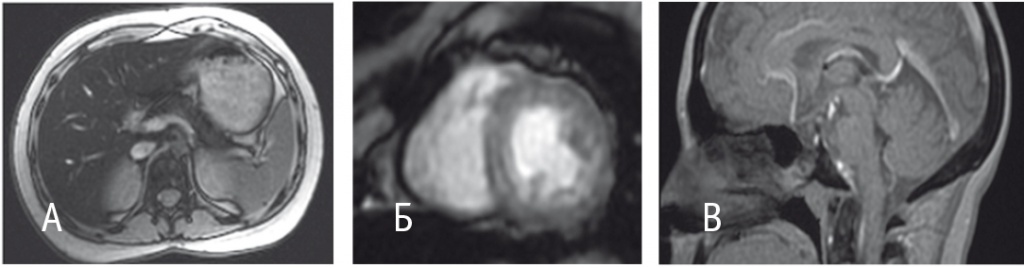
Для оценки степени перегрузки железом и выявления осложнений проведено комплексное обследование: чрезкожная пункционная биопсия печени, МРТ сердца, гипофиза и органов брюшной полости в режиме Т2*, ЭхоКГ, УЗИ органов брюшной полости с ARFI-эластографией, исследование гормонального профиля. Гистологическое исследование ткани печени показало хронический гепатит средней выраженности (индекс гистологической активности по Кноделю — 4 балла, степень фиброза по METAVIR — 1 балл), гемосидероз печени 4 степени (рис. 1). Содержание железа в печеночной ткани составило 18,6 мг/г сухого вещества печени (норма — менее 2 мг/г сухого вещества). При МРТ в режиме Т2* отмечено значительное накопление железа в печени с соответствующим уменьшением времени релаксации МР-сигнала (1,4 мс при норме более 11,4 мс), в поджелудочной железе (23,8 мс при норме более 33,3 мс) и гипофизе (8,9 мс при норме более 9 мс), кроме того, выявлено уменьшение гипофиза (55,44 мм3) (рис. 2). В миокарде накопления железа не выявлено (33 мс, норма — более 20 мс). Диагностирован остеопороз поясничного отдела позвоночника. Эндокринологическое обследование показало гипогонадотропный гипогонадизм и вторичную аменорею. Пациентке и ее матери выполнено генетическое исследование мутаций в генах рибосомных белков (RPS19, RPS10, RPS24, RPS26, RPL11, RPL5, RPL35a) и гене GATA1, однако мутации не обнаружены, что не исключает диагноз АДБ (у трети больных не удается выявить генетические нарушения).
Рис. 1. Гистологическая картина печени.
А. Минимальная перипортальная лимфоидная инфильтрация. Депозиты коричневого пигмента (окраска гематоксилином и эозином, 100-кратное увеличение). Б. Нежный перипортальный фиброз без септ (трехцветная окраска по Массон, 200-кратное увеличение). В. Массивные депозиты гемосидерина в гепатоцитах и вне клеток (окраска по Перлсу, 100-кратное увеличение)
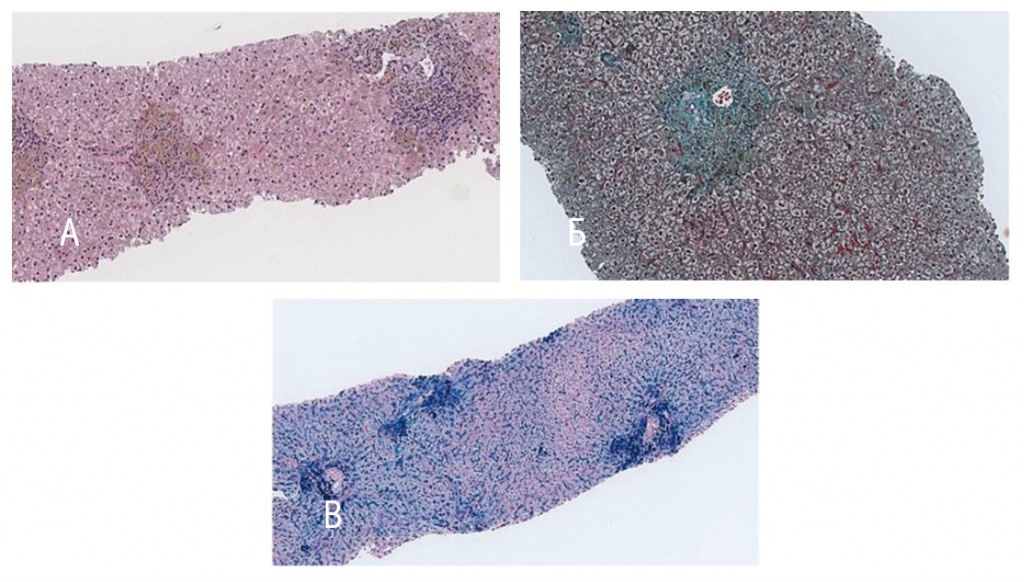
Рис. 2. Оценка накопления железа в печени, поджелудочной железе, гипофизе и миокарде с помощью магнитно-резонансной томографии в режиме Т2*
В связи с тяжелой перегрузкой организма железом принято решение о возобновлении хелаторной терапии. Поскольку дефероксамин в России отсутствует, то препаратом выбора стал деферазирокс в дозе 1000 мг/сут (25 мг/кг в сутки). Кроме того, начата заместительная гормональная терапия препаратом, содержащим 2 мг эстрадиола и 10 мг дидрогестерона. С учетом костного возраста (15 лет, по результатам рентгенографии кисти) ростостимулирующая терапия признана нецелесообразной.
Хелаторную терапию пациентка переносила удовлетворительно, без признаков печеночной токсичности. По результатам контрольного обследования в декабре 2013 г. отмечены значительное снижение концентрации ферритина сыворотки крови (до 1840 мкг/л), нормализация активности трансаминаз (АЛТ — 45 Ед/л, АСТ — 28 Ед/л). Вместе с тем, по данным МРТ в режиме Т2*, наблюдалось дальнейшее усугубление перегрузки организма железом: время отклика магнитного поля в печени — 0,65 мс, в миокарде — 10,05 мс, в гипофизе — 6,88 мс. Дополнительно выявлены нарушение гликемии натощак, нормоинсулинемическая инсулинорезистентность. Пациентка жаловалась на ухудшение зрения, при офтальмологическом осмотре зафиксировано прогрессирование катаракты в обоих глазах. Девочке проведено оперативное лечение — факоэмульсия хрусталиков с имплантацией интраокулярных линз.
ОБСУЖДЕНИЕ
Приведенное клиническое наблюдение демонстрирует сложность ведения пациентов с АДБ, обусловленную практически неизбежным развитием серьезных побочных эффектов терапии, а также необходимостью привлечения врачей многих специальностей.
АДБ — уникальное заболевание, при котором некоторые больные с раннего возраста непрерывно получают ГК в течение многих лет, иногда всю жизнь. Максимально допустимая поддерживающая доза препарата составляет 0,5 мг/кг в сутки, в случае невозможности поддержания ответа на такой дозе терапию ГК рекомендуют прервать и перевести пациента на регулярную заместительную терапию с адекватной хелацией [26, 28]. В описанном случае поддерживающая терапия в течение продолжительного времени включала более высокие дозы ГК, что связано со сложностью регулярной трансфузионной и хелаторной терапии по месту жительства пациентки.
У больных АДБ перегрузка железом развивается быстрее, чем у пациентов с другими заболеваниями, получающими эквивалентный объем трансфузионной поддержки [5, 23]. Это делает очень важным своевременное начало хелаторной терапии и адекватный мониторинг ее эффективности.
Из доступных сегодня препаратов-хелаторов железа для пациентов с АДБ разрешено применение дефероксамина и деферазирокса. Прием деферипрона больными АДБ ассоциирован с развитием агранулоцитоза [26]. Применение дефероксамина предполагает подкожное введение препарата в течение 8–12 часов не менее 5 дней в неделю [3]. Подобный режим создает определенные технические сложности, значительно ограничивая образ жизни пациента и его семьи. В нашем случае невозможность поддержания адекватной схемы введения дефероксамина привела к существенному усугублению перегрузки железом в течение 2 лет.
«Золотым стандартом» выявления перегрузки организма железом служит пункционная биопсия печени с определением содержания железа в сухом веществе печени. В последние годы альтернативой этой инвазивной методике стала МРТ органов-мишеней в режиме T2* [2, 7, 30]. Основными органами-мишенями эндокринной системы при перегрузке железом являются гипофиз и поджелудочная железа. Гипогонадотропный гипогонадизм — наиболее частое эндокринное осложнение перегрузки железом гипофиза, диагностируемое более чем у половины пациентов (60%). Согласно некоторым зарубежным работам, степень снижения интенсивности МР-сигнала T2* и уменьшение объема гипофиза соотносятся с тяжестью поражения гипофиза вследствие перегрузки железом. Накопление железа в гипофизе происходит в первые 10 лет жизни, в связи с чем МРТ головного мозга (гипофиза) целесообразна в допубертатном возрасте для выявления ранних признаков перегрузки гипофиза железом [21]. Своевременное назначение хелаторной терапии либо ее интенсификация на этом этапе позволяет избежать необратимых поражений гипофиза. Нарушение толерантности к глюкозе у пациентов с перегрузкой железом обусловлено в первую очередь развитием инсулинорезистентности вследствие поражения печени. В дальнейшем при накоплении железа в поджелудочной железе снижается секреция инсулина и развивается сахарный диабет. Средний возраст манифестации углеводных нарушений у пациентов с избытком железа — 10 лет, поэтому всем больным старше этого возраста рекомендован ежегодный оральный глюкозо-толерантный тест [28].
У нашей пациентки гипогонадотропный гипогонадизм и инсулинорезистентность развились в возрасте 15 лет. Была назначена заместительная терапия половыми стероидами, рекомендована диетотерапия с ограничением легкоусвояемых углеводов и жиров животного происхождения.
Определение концентрации ферритина сыворотки крови широко применяют для рутинного мониторинга эффективности хелаторной терапии, однако уровень ферритина не всегда строго коррелирует с истинным количеством железа в организме, особенно в тканях миокарда [29]. В описанном клиническом случае следует отметить явное несоответствие динамики концентрации ферритина и результатов МРТ после возобновления приема деферазирокса. Так, при снижении концентрации ферритина сыворотки более чем в 2 раза (с 4277 до 1840 мкг/л) по данным МРТ было выявлено дальнейшее усугубление перегрузки железом тканей печени, миокарда и гипофиза.
ЗАКЛЮЧЕНИЕ
Большинство пациентов с анемией Даймонда — Блекфена (АДБ) получают всю жизнь лечение глюкокортикоидами (ГК) или регулярную заместительную терапию. Критически важно раннее начало адекватной хелаторной терапии наряду с мониторингом ее эффективности.
Побочные эффекты приема ГК и перегрузки железом затрагивают различные ткани и органы [3, 26, 29], поэтому в ведении пациентов с АДБ исключительно важен мультидисциплинарный подход с привлечением не только гематолога, но и эндокринолога, кардиолога, ортопеда, офтальмолога и врачей других специальностей. Только комплексный подход может обеспечить приемлемое качество жизни таких больных.








