ВВЕДЕНИЕ
Известно, что нарушения нутритивного (трофологического) статуса являются самостоятельным негативным фактором, определяющим исход различных заболеваний внутренних органов, в том числе протекающих с дыхательной недостаточностью[1]. Снижение ИМТ — независимый фактор неблагоприятного прогноза и риска смерти больных, так как прямо пропорционально падению тощей массы тела уменьшаются и сила, и выносливость скелетной мускулатуры, а также сократимость диафрагмы.
Единое представление о патогенезе нутритивной (трофологической) недостаточности при заболеваниях органов дыхания в настоящее время не сформировано. При этом большинство авторов единодушны во мнении, что нарушение пищевого поведения в виде недостаточного потребления пищи играет незначительную роль, и отводят приоритет системному воспалению, увеличению базального метаболического уровня и сдвигу гомеостаза в сторону катаболических процессов[1–3].
Известно, что нутритивный (трофологический) статус является самостоятельным фактором, определяющим исход ХОБЛ. Распространенность дефицита массы тела при ХОБЛ повышается вместе с нарастанием тяжести заболевания[4, 5]. Доказано, что у пациентов с ХОБЛ и ИМТ менее 18 кг/м2 пятилетняя выживаемость в 2 раза ниже, чем у пациентов с ИМТ более 29 кг/м2[6].
Течение ХОБЛ характеризуется наличием хронического оксидативного стресса с повышением концентрации активных форм кислорода и циклооксигеназы, которые угнетают деятельность Na+/K+-насоса, внутриклеточных структур и ферментов, участвующих в энергетическом метаболизме и функционировании мышечных клеток[7]. Таким образом, несмотря на адекватный пищевой рацион, пациенты попадают в ситуацию метаболически обусловленного энергетического дефицита на фоне гиперпродукции аммиака.
В условиях повышенной катаболической активности происходят дезаминирование аминокислот, биогенных аминов, распад азотистых компонентов углеводов и липидов, пуриновых и пиримидиновых производных, что приводит к повышению концентрации аммиака в сыворотке крови[8].
Аммиак в нормальных концентрациях — это естественный компонент всех жидких сред организма[9]. Основным органом, утилизирующим аммиак посредством биосинтеза мочевины, выделяемой почками, является печень, поэтому до 90% случаев гипераммониемии обусловлено различными заболеваниями печени, как правило, на стадии цирроза (ЦП)[10]. Лечение многих из них, в частности ЦП, остается глобальной медико-социальной и экономической проблемой, несмотря на стремительный прогресс в современных методах терапии[11].
Известно, что одним из самых частых осложнений ЦП является саркопения. Саркопения и гипераммониемия, по предположению ряда авторов, взаимообусловлены и неразрывно связаны с осью «печень — мышцы»[12–16].
ЦП и гипераммониемия, ускоряя катаболизм аминокислот, усиливают образование в скелетных мышцах аммония, что приводит к дальнейшему нарушению белкового синтеза, даже при благоприятном действии современных методов нутритивной поддержки в отношении саркопении[17, 18].
Представления о патогенезе гипераммониемии расширяются, и сегодня известны не связанные с ЦП причины повышения уровня аммиака в системном кровотоке. В этих случаях, по-видимому, следует применять термин «нецирротическая гипераммониемия». В процессы метаболизма аммиака и гипераммониемии, кроме печени, включаются и другие органы и ткани (скелетная мускулатура, головной мозг, почки, сетчатка глаза и др.) посредством превращения глутамата в глутамин с участием фермента глутаминсинтетазы[19]. И хотя в скелетной мускулатуре активность этого фермента низкая, в условиях гипераммониемии роль глутаминсинтетазы становится крайне важной[20].
По данным ряда авторов[21–23], все состояния, сопровождающиеся нецирротической гипераммониемией, можно разделить на две группы. Первая группа включает патологии, причины которых сопряжены с нарастанием продукции аммиака: инфицирование аммиак-продуцирующими микроорганизмами или увеличение их числа, онкологические заболевания, трансплантация органов, белковая нагрузка или усиление катаболических процессов (тяжелые физические нагрузки, голодание, судороги, ожоги и травмы, полное парентеральное питание, гастроинтестинальные кровотечения, использование стероидов). Вторая группа связана с ухудшением процессов утилизации и выведения аммиака и включает уретростому, портальные шунты, прием некоторых лекарств (вальпроевой кислоты, глицина, карбамазепина, рибавирина, сульфасалазина и др.), нарушения метаболизма[21].
Цель исследования: оценить частоту встречаемости гипераммониемии при заболеваниях органов дыхания.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании приняли участие 36 пациентов с заболеваниями органов дыхания, госпитализированных в терапевтическое отделение клиники им. Петра Великого ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» в 2019 г. Диагноз ХОБЛ был у 21 (58,3%) человека, хронического бронхита — у 5 (13,9%), пневмонии — у 10 (27,8%). Заболевания гепатобилиарной системы являлись критерием исключения.
Средний возраст пациентов составил 66,8 ± 11,8 года; из них 9 (25,0%) женщин и 27 (75,0%) мужчин. С целью оценки нутритивного статуса у всех больных определялись основные соматометрические показатели: рост, вес, ИМТ, окружность плеча нерабочей руки, окружность талии, толщина кожно-жировой складки над бицепсом, над трицепсом, ниже угла лопатки, в паховой области[24].
Для расчета частоты табакокурения использовался индекс курения.
Диагностика и ведение больных ХОБЛ проводились в соответствии с клиническими рекомендациями Минздрава России[25] (табл. 1).
Таблица 1
Распределение пациентов в зависимости от тяжести хронической обструктивной болезни легких, n (%)
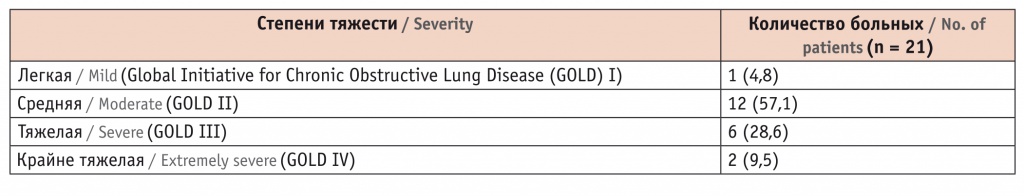
Хронический бронхит определяли при наличии кашля с выделением мокроты на протяжении не менее 3 месяцев за 2 года.
Диагностика и ведение больных пневмонией проводились в соответствии с клиническими рекомендациями РФ 2014 года[26].
У каждого пациента произведено измерение уровня аммиака в капиллярной крови методом микродиффузии на аппарате PocketChem BA PA-4140, Arkray, Япония (референсные значения — 15–60 нмоль/л).
Статистическая обработка результатов исследования выполнялась с применением пакета прикладных программ Statistica 12 for Windows с определением средних значений, среднего квадратичного отклонения, вариационного размаха, максимальных и минимальных значений. Количественные показатели представлены как М ± σ, где М — среднее значение, σ — стандартное отклонение.
Статистическая значимость различий двух относительных величин оценивалась по t-критерию (t > 2). Критический уровень достоверности (р) нулевой статистической гипотезы принимали равным 0,05. Для изучения взаимосвязи между качественными признаками был применен точный критерий Фишера, для количественных — коэффициент ранговой корреляции Спирмена (Rs).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
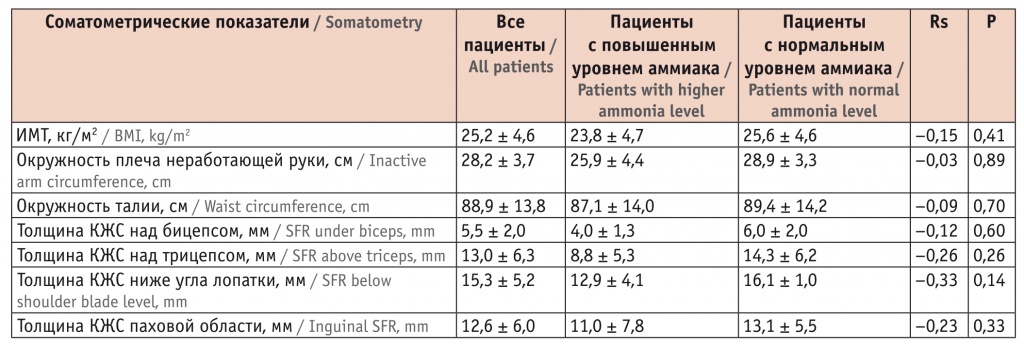
Среди 36 пациентов выделены две группы: первая — 9 (25,0%) человек с повышенным уровнем аммиака (74,0 ± 7,1 нмоль/л), средний возраст — 62,3 ± 18,2 года; вторая — 27 (75,0%) человек с нормальным уровнем аммиака (44,4 ± 9,6 нмоль/л), средний возраст — 68,3 ± 8,8 года. В обеих группах было большинство мужчин: 7 (77,8%) в первой, 20 (74,1%) во второй. Группы были сопоставимы по полу и возрасту (t = 0,22 p > 0,05 и t = 0,90 p = 0,38 соответственно). Пациентов с нормальным показателем ИМТ было 16 (44,5%), с избыточной массой тела — 12 (33,3%), с ожирением — 5 (13,9%), с недостаточной массой тела — 3 (8,3%). При анализе соматометрических показателей значимых различий между группами не было (табл. 2).
Таблица 2
Сравнение соматометрических показателей у обследованных больных
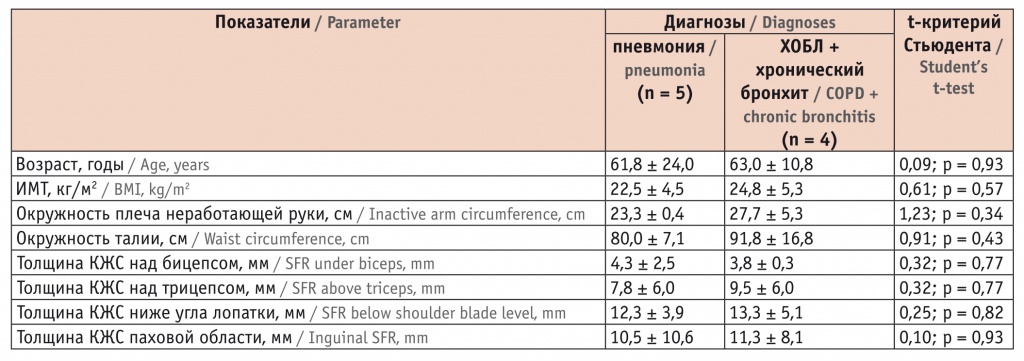
Характеристики больных с повышенным уровнем аммиака приведены в таблице 3. Среди пациентов с пневмонией 5 (50,0%) человек имели повышенный уровень аммиака, а в группе ХОБЛ/хронического бронхита — 4 (15,4%) человека (различия статистически незначимы, t = 1,91 p > 0,05). Все они были сопоставимы по возрастным и соматометрическим показателям. Среднее значение ИМТ составило 25,2 ± 4,6 кг/м2.
Таблица 3
Характеристика пациентов с повышенным уровнем аммиака
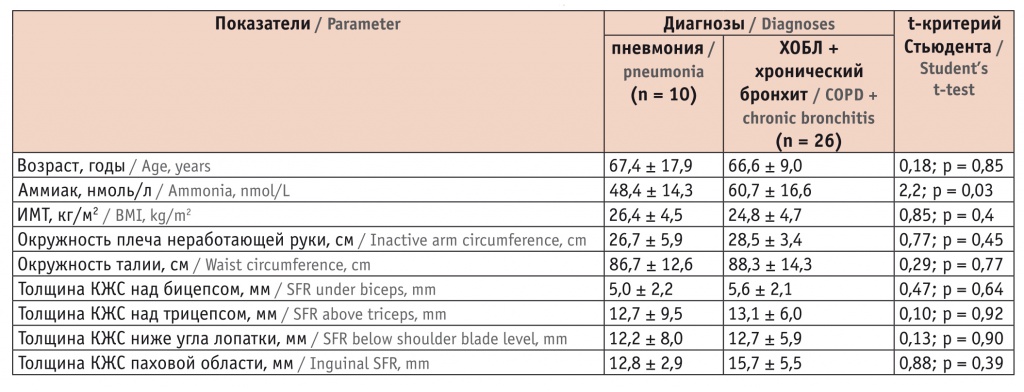
При анализе уровня аммиака обращают на себя внимание выявленные значимые различия. Так, у больных ХОБЛ/хроническим бронхитом уровень аммиака был значимо выше, чем при пневмонии (табл. 4).
Таблица 4
Характеристики обследованных больных
При проведении сравнительного анализа у больных ХОБЛ найдены значимые различия по содержанию аммиака в зависимости от длительности заболевания. В группе с повышенным содержанием аммиака длительность ХОБЛ была существенно больше (табл. 5).
Таблица 5
Характеристики больных хронической обструктивной болезнью легких в зависимости от уровня аммиака
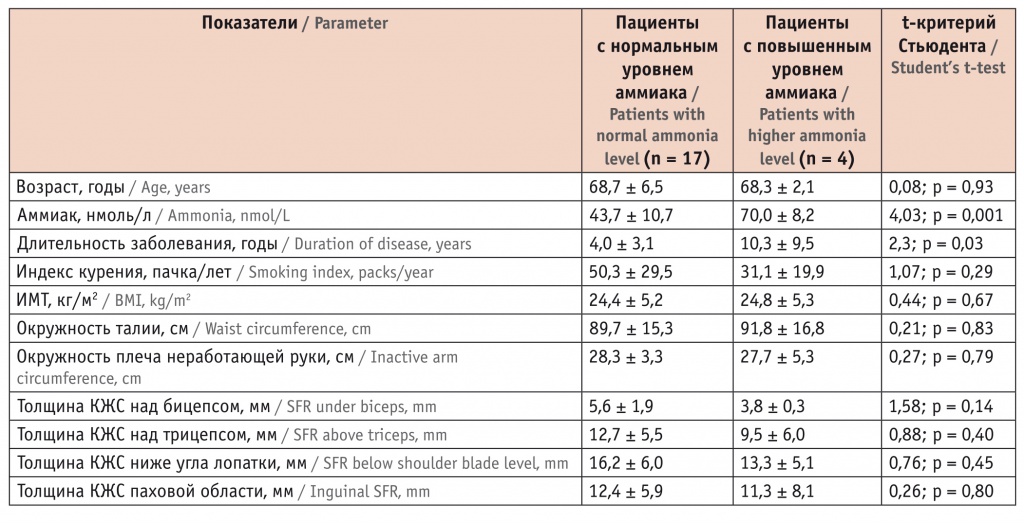
Значимой корреляции между показателями нутритивного (трофологического) статуса и концентрации аммиака у больных с заболеваниями органов дыхания не было (t < 2, p > 0,05).
ЗАКЛЮЧЕНИЕ
В 25% случаев при заболеваниях органов дыхания выявлена гипераммониемия, которую можно расценивать как нецирротическую, так как наличие патологии гепатобилиарной системы у данной группы пациентов являлось критерием невключения в исследование. Несмотря на то что в нашей работе не обнаружена статистически значимая корреляция между нецирротической гипераммониемией и нутритивным (трофологическим) статусом, наличие патогенетической взаимосвязи между ними отвергать нельзя. Вопрос о том, является ли дефицит массы тела определяющим фактором нецирротической гипераммониемии, остается неопределенным и требует дальнейшего изучения с бо́льшим количеством наблюдений.
Поступила: 07.04.2020
Принята к публикации: 28.05.2020








