ВВЕДЕНИЕ
Мировые тенденции последнего десятилетия свидетельствуют о неуклонном росте числа женщин репродуктивного возраста, страдающих различными нарушениями углеводного обмена. Известно, что более 20 млн беременностей по всему миру протекает на фоне сахарного диабета (СД). На долю гестационного сахарного диабета (ГСД) приходится 2–14% случаев беременности, в то время как прегестационный СД (1 и 2 типа) имеет меньшую распространенность (до 2%)[1]. Важнейшее значение имеет увеличение длительности течения СД, что ведет к развитию макро- и микрососудистых осложнений с сопутствующим риском формирования плацентарной недостаточности[1]. Прегестационные типы диабета связаны с высокой перинатальной заболеваемостью, включая врожденные аномалии развития, макросомию плода, респираторный дистресс-синдром (РДС) и неонатальную гипогликемию[2]. Одним из самых неблагоприятных и трагичных исходов гестационного процесса является гибель плода или новорожденного.
Показатель перинатальной смертности среди женщин с СД в ранее проведенных исследованиях составил от 16,1 до 31,8 на 1000 родов, превысив таковой в общей популяции беременных почти в 4 раза; при этом 80% летальных исходов приходилось на долю мертворождения[3, 4]. ВОЗ определяет мертворождение как гибель плода после 22 недель беременности1. К вероятным причинам мертворождения можно отнести нарушения темпов роста плода, преэклампсию, патологию пуповины, острую асфиксию, отслойку плаценты, внутриутробную инфекцию и аномалии развития плода. При этом более чем в половине случаев причины гибели плода остаются неизвестными[5].
Наличие избыточной массы тела или ожирения до беременности, хроническая артериальная гипертензия, курение и недостаточный контроль гликемии являются значимыми и — что важно — модифицируемыми факторами риска перинатальных осложнений[1].
M. Balsells и соавт. в метаанализе 33 исследований, включавших 7966 беременных с СД 1 и 2 типа, продемонстрировали, что оба заболевания ассоциированы с высоким риском неблагоприятных исходов беременности[6]. Патофизиология гибели плода при беременности, протекающей на фоне СД, является мультифакторной. Согласно A.M. Al-Nemri и соавт., такие перинатальные осложнения, как макросомия плода, ранняя неонатальная гипогликемия, РДС и потребность новорожденного в интенсивной терапии, связаны с недостаточным гликемическим контролем во время беременности (HbA1c > 6,5%)[7]. Длительная материнская гипергликемия приводит к гипергликемии плода, вызывая у него выраженную гиперинсулинемию вследствие чрезмерной стимуляции бета-клеток поджелудочной железы. Эти процессы влекут за собой ускоренный рост плода, избыток подкожного жира и увеличение запаса гликогена в печени[1]. Материнская гипергликемия также связана с хронической гипоксией плода, которая является основным стимулом синтеза эритропоэтина, на что указывает обратная корреляция между концентрацией последнего в амниотической жидкости и гликемическим контролем[8].
J. Lauenborg и соавт. сообщили о 25 случаях мертворождения на фоне СД 1 типа у беременных, когда недостаточный гликемический контроль выступал в качестве основной причины гибели плода[9]. Установлено, что беременность, протекающая на фоне СД, связана с повышением маркеров оксидативного стресса (8-изопростан, нитротирозин) и эндотелиальной дисфункцией, ведущей к плацентарной недостаточности, хронической гипоксии и ацидемии плода[10].
Взаимосвязь между ГСД и мертворождением менее очевидна. Тем не менее беременные с ГСД находятся в группе повышенного риска развития неблагоприятных перинатальных исходов, связанных с макросомией и дистоцией плечиков плода. В исследовании T. Stacey и соавт. установлено, что в отсутствие скрининга у женщин, подверженных риску ГСД, риск позднего мертворождения на 44% выше, чем у беременных, не входящих в группу риска[11]. Аналогично женщины без установленного диагноза ГСД, но с повышенным уровнем гликемии натощак (≥ 5,1 ммоль/л) имели в 4 раза больший риск позднего мертворождения по сравнению с беременными, у которых этот показатель находился в пределах нормы[11].
Приведенные данные свидетельствуют о том, что вне зависимости от типа диабета недостаточный гликемический контроль представляет собой наиболее важный модифицируемый фактор риска перинатальной смерти.
Другим значимым фактором риска является срок родоразрешения. Общепринятые рекомендации по стратегии родоразрешения беременных с прегестационными типами СД в настоящее время отсутствуют. Срок родоразрешения женщин с СД определяется индивидуально. Согласно рекомендациям британского Национального института охраны здоровья и совершенствования медицинской помощи (англ. National Institute for Health and Care Excellence, NICE), женщинам с СД 1 и 2 типа следует выполнять элективное родоразрешение между 37 неделями и 38 неделями 6 днями при отсутствии осложнений беременности и удовлетворительном состоянии матери и плода2.
Срок родоразрешения женщин с ГСД остается дискуссионным. Данные, которые подтверждали бы преимущества досрочного родоразрешения у таких пациенток, отсутствуют. M.G. Rosenstein и соавт. показали, что у женщин с ГСД на сроке 36 недель в случае выбора выжидательной тактики риск мертворождения ниже, чем при спонтанных и индуцированных родах (17,4 против 19,3 на 10 000; ОР = 0,89; 95%-ный ДИ: 0,52–1,50), в то время как к 39 неделям при выборе выжидательной тактики риск мертворождения выше, чем при родах (15,2 против 8,7 на 10 000; ОР = 1,80; 95%-ный ДИ: 1,20–2,60). Родоразрешение на 39-й неделе может быть наилучшим выбором у пациенток с ГСД с целью снижения перинатальной смертности[12]. Важно отметить, что изолированный СД у матери не является показанием к оперативному родоразрешению, а кесарево сечение при этом проводится по общепринятым акушерским показаниям.
Несмотря на имеющиеся исследования, анализ структуры перинатальной смертности при СД и изучение возможных путей профилактики летальных исходов по-прежнему актуальны. Субоптимальные уровни глюкозы в крови матери, наличие микрососудистых осложнений и отсутствие прегравидарной подготовки напрямую связаны с повышенным риском мертворождения. ФГБНУ «Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта» («НИИ АГиР им. Д.О. Отта») занимается проблемами СД и беременности на протяжении 50 лет и является одним из лидеров в области «акушерской диабетологии».
Целью исследования являлся анализ факторов риска и структуры перинатальных потерь у женщин с различными типами СД за последние 30 лет в условиях специализированного центра ФГБНУ «НИИ АГиР им. Д.О. Отта».
МАТЕРИАЛЫ И МЕТОДЫ
Проведено ретроспективное одноцентровое когортное исследование на базе ФГБНУ «НИИ АГиР им. Д.О. Отта». Период анализа составил 30 лет (1988–2018 гг.). За это время произошло 42 случая гибели плода или новорожденного у женщин с различными типами СД. Все случаи были разделены на 3 группы: 1-я группа — у женщин с СД 1 типа (n = 20); 2-я группа — с СД 2 типа (n = 10); 3-я группа — с ГСД (n = 12). Все беременности были одноплодными.
Статистическую обработку проводили с использованием программы SPSS Statistics 23.0 (IBM, США). Параметры распределения выборки оценивались при помощи критерия Колмогорова — Смирнова. В целях определения статистической значимости различий количественных параметров при нормальном распределении данных использовался однофакторный дисперсионный анализ (ANOVA) с поправкой Бонферрони для множественных сравнений и расчетом 95%-ного ДИ, при распределении данных, отличном от нормального, — критерий множественных сравнений групп Краскела — Уоллиса с расчетом медианы (Me) и квартилей [Q1; Q3]. Рассчитывался апостериорный критерий Данна. Статистическое сравнение распределения качественных признаков проводилось с применением критерия хи-квадрат (χ2) Пирсона, количественных — с применением точного критерия Фишера (F-критерий). Гипотезу о равенстве средних значений в исследуемых группах отвергали при уровне значимости p < 0,05.
РЕЗУЛЬТАТЫ
Характеристика исследуемых групп представлена в таблице 1. Стаж СД был закономерно бо́льшим у беременных с СД 1 типа (1-я группа, p = 0,001). Наиболее высокие уровни HbA1c как до беременности, так и в каждом триместре также определены у пациенток 1-й группы. Микрососудистые осложнения наблюдались у 80,0% женщин с СД 1 типа и у 60,0% — с СД 2 типа (p = 0,001). Прегравидарная подготовка не позднее чем за 6 месяцев до зачатия проводилась только одной женщине (5,0%) 1-й группы (HbA1c к моменту наступления беременности < 6,5%).
Таблица 1
Характеристика исследуемых групп (n = 42)
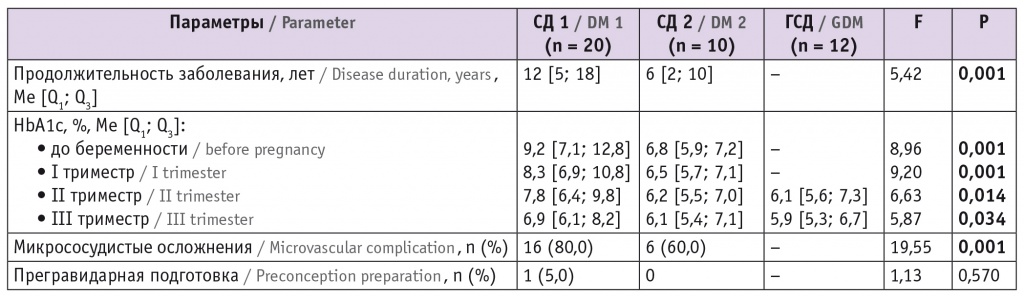
Примечание. В таблицах 1–5: ГСД — гестационный сахарный диабет; СД — сахарный диабет.
При оценке распространенности осложнений беременности и родов в исследуемых группах было выявлено, что преэклампсия и хроническая плацентарная недостаточность с задержкой роста плода (ЗРП) чаще встречались среди пациенток с СД 2 типа (70,0% и 60,0% соответственно). Крупный плод и слабость родовой деятельности чаще наблюдались в группе ГСД (по 25,0% в каждом случае). В этой же группе более часто встречались преждевременная отслойка нормально расположенной плаценты (16,7%) и дистоция плечиков (8,3%). Хориоамнионит и эмболия околоплодными водами являлись редкими патологиями: было зарегистрировано только по одному случаю каждого осложнения у пациенток с СД 1 типа. С учетом малого количества наблюдений вышеописанные различия, представленные в таблице 2, нельзя считать статистически значимыми.
Таблица 2
Осложнения беременности и родов (n = 42)
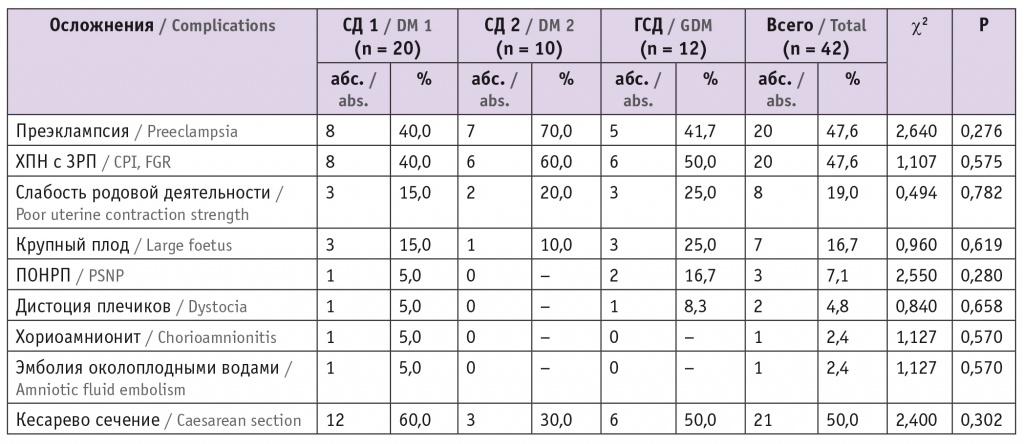
Примечание: ЗРП — задержка роста плода; ПОНРП — преждевременная отслойка нормально расположенной плаценты; ХПН — хроническая плацентарная недостаточность.
В целом в исследуемых группах в 50,0% случаев (n = 21) родоразрешение проводилось через естественные родовые пути. Наибольшая частота абдоминального родоразрешения (60,0%) зафиксирована в группе СД 1 типа. В группе ГСД половина, а среди беременных с СД 2 типа — около одной трети пациенток были родоразрешены путем операции кесарева сечения (см. табл. 2).
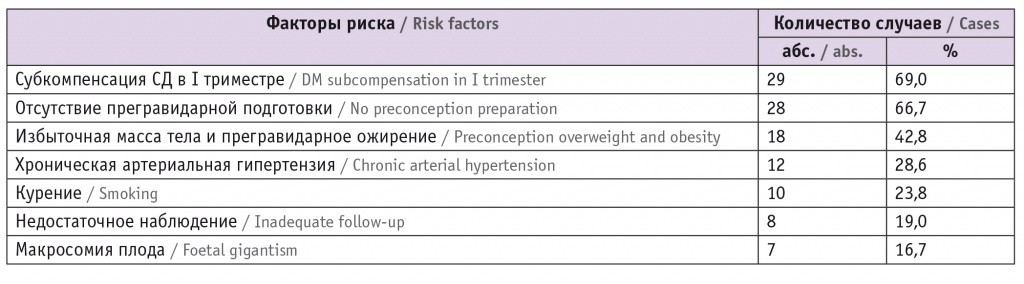
В таблице 3 представлены факторы риска, повлиявшие на перинатальные исходы у женщин с СД. Наиболее частыми из них были недостаточный гликемический контроль в I триместре (69,0%), отсутствие прегравидарной подготовки (66,7%), избыточная масса тела и ожирение до беременности (42,8%) и хроническая артериальная гипертензия (28,6%).
Таблица 3
Факторы риска перинатальной смерти (n = 42)
Структура перинатальной смертности при различных типах СД у матери по данным ФГБНУ «НИИ АГиР им. Д.О. Отта» представлена в таблице 4. В группе СД 1 типа наибольшее число (60,0%) смертей произошло в первые 7 дней после родов, на долю летальных исходов в анте- и интранатальном периодах пришлось 25,0% и 15,0% соответственно. В группах СД 2 типа и ГСД половину случаев составили смерти в антенатальном периоде, одну треть — в постнатальном, по 2 случая отмечено в интранатальном периоде.
Таблица 4
Структура перинатальной смертности (n = 42)
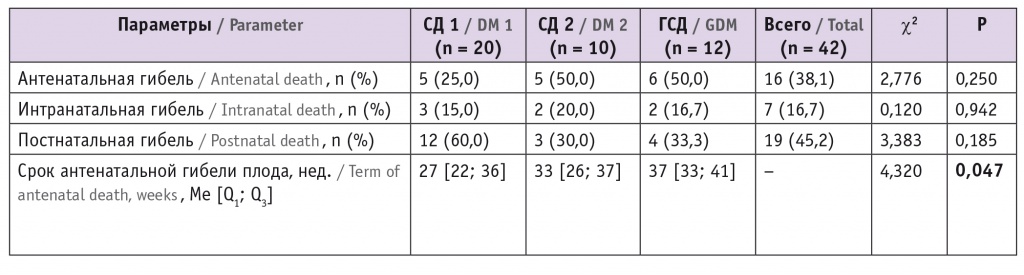
Самый ранний срок антенатальной гибели плода установлен в группе СД 1 типа, медиана гестационного срока составила 27 недель. В группах СД 2 типа и ГСД смерть плода происходила на более поздних сроках беременности (p < 0,05) (см. табл. 4).
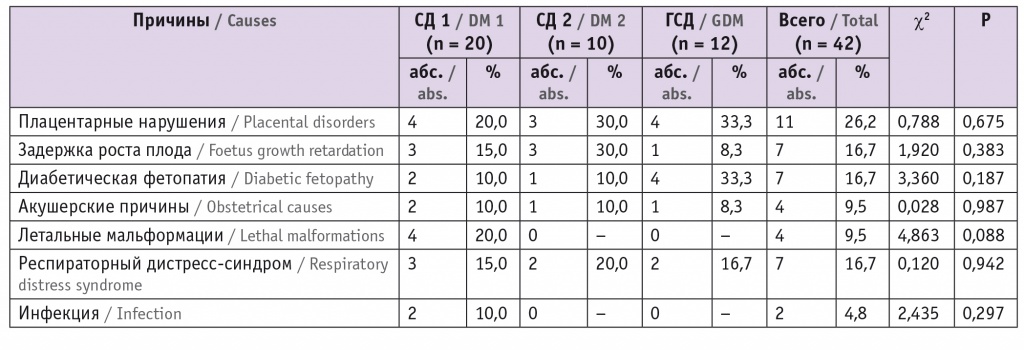
Основными причинами гибели плода или новорожденного являлись плацентарные нарушения, которые были выявлены в 26,2% случаев. На долю ЗРП, диабетической фетопатии и РДС пришлось по 16,7% случаев, на долю летальных мальформаций и акушерских причин — по 4 случая. С инфекциями были связаны 2 летальных исхода (табл. 5).
Таблица 5
Основные причины перинатальной смерти (n = 42)
ОБСУЖДЕНИЕ
Риск перинатальных потерь при различных типах СД за последние десятилетия не перестал быть акушерской проблемой. Несмотря на проведение ряда исследований, посвященных изучению патофизиологических механизмов гибели плода при нарушениях углеводного обмена, детальное понимание данной проблемы все еще отсутствует. Многие авторы сходятся во мнении, что усиление процессов оксидативного стресса, снижение маточно-плацентарного кровотока, функциональные и гистологические изменения плаценты, обусловленные диабетической васкулопатией, играют решающую роль в развитии асфиксии и гибели плода.
В нашей работе показано, что самыми частыми факторами риска перинатальной смерти являются субкомпенсация диабета в I триместре, отсутствие прегравидарной подготовки, избыточная масса тела и ожирение до беременности и хроническая артериальная гипертензия.
Притом что большое внимание уделяется контролю гликемии на ранних сроках и до зачатия, показано, что для женщин с незапланированной беременностью и/или неоптимальным контролем уровня глюкозы ключевым моментом является достижение HbA1c менее 6,5% (< 48 ммоль/моль) к 24-й неделе беременности при СД как 1, так и 2 типа[13]. В соответствии с другими исследованиями, субоптимальный уровень глюкозы в материнской крови является ключевым модифицируемым фактором риска мертворождения[8, 10, 14]. S.T. Mackin и соавт. установили, что наиболее значимыми факторами риска мертворождения среди женщин с СД 1 типа являются высокие уровни HbA1c до беременности и в III триместре, тогда как у женщин с СД 2 типа высокий ИМТ, вне зависимости от уровня HbA1с, являлся самостоятельным фактором риска мертворождения[4]. В то же время, по данным M. Balsells и соавт., у женщин с СД 2 типа, несмотря на более низкие уровни HbA1c на протяжении всей беременности, риск перинатальных потерь выше, чем при СД 1 типа (ОШ = 1,50; 95%-ный ДИ: 1,15–1,96), без существенных различий в показателях врожденных пороков развития[6]. Приведенные данные подтверждают, что повышенный материнский ИМТ является важным модифицируемым фактором риска перинатальных потерь.
В метаанализе V. Flenady и соавт. рассчитывались значения риска, связанного с популяцией (англ. population attributable risk, PAR), для стран с высоким уровнем дохода. Избыточный вес матери и ожирение (ИМТ > 25 кг/м2) до беременности были наивысшим ранжируемым фактором риска гибели плода (PAR — 8–18%)[15]. В исследовании L. Liu и соавт. установлено, что прегравидарное ожирение является независимым фактором риска неблагоприятных перинатальных исходов, включая РДС новорожденных и потребность новорожденного в интенсивной терапии[16]. R. Yao и соавт. показали, что вероятность мертворождения у женщин с прегравидарным ожирением с 39 недель беременности увеличивается, при этом чем выше степень ожирения, тем быстрее возрастает риск. У женщин с ИМТ ≥ 50 кг/м2 на 39-й неделе беременности риск гибели плода превышал аналогичный показатель у женщин с нормальной массой тела в 5,7 раза, а на 41-й неделе беременности — в 13,6 раза[17]. В популяционном исследовании канадской когорты (около 227 000 беременностей) показано, что 10-процентная разница в ИМТ до беременности связана с как минимум 10-процентным различием в части риска развития преэклампсии, ГСД, преждевременных родов, макросомии плода и мертворождения[18]. Эти результаты показывают, что если у женщин с СД 1 типа прегестационный контроль гликемии остается наиболее важной задачей, то у женщин с СД 2 типа для снижения риска перинатальных осложнений в дополнение к контролю гликемии следует уделять больше внимания контролю веса до беременности.
Немаловажную роль играют сформировавшиеся акушерские осложнения. Среди исследованных нами групп наиболее часто встречались преэклампсия, хроническая плацентарная недостаточность с ЗРП и слабость родовой деятельности.
В работе, которую представили S. Lisonkova и соавт., скорректированное ОШ перинатальной смерти или развития тяжелых заболеваний новорожденных составило 16,4 (95%-ный ДИ: 14,5–18,6) при раннем начале преэклампсии и 2,0 (95%-ный ДИ: 1,8–2,3) — при позднем[19]. L.R. Marins и соавт. в своем обзоре показали, что цитотоксическая среда, присутствующая при преэклампсии, приводит к формированию нейтропении плода, которая наблюдается у 50% новорожденных и прямо коррелирует со смертностью[20]. Повышение уровня эритропоэтина, условия гипоксии, антиангиогенная среда при преэклампсии являются возможными звеньями патогенеза гибели плода[10].
Синдром ЗРП ассоциирован с повышенным риском как антенатальной, так и интранатальной гибели вследствие большей восприимчивости плода к инфекционным и гипоксическим факторам[21]. Известно, что плоды с крайне низким весом (менее 3-го перцентиля) подвергаются наибольшему риску смерти. ЗРП является одним из наиболее значимых факторов риска мертворождения, увеличивая его в 4–8 раз по сравнению с общей акушерской популяцией[21]. По данным S.T. Mackin и соавт., абсолютный риск мертворождения в общей популяции в 6 раз выше при наличии ЗРП и повышается при наличии у матери СД 1 типа[4]. J.W. Seeds и соавт. продемонстрировали, что показатели перинатальной смертности увеличиваются при массе тела плода более 90-го перцентиля, если макросомия плода связана с наличием материнского СД (наибольшее увеличение риска отмечено у плодов массой > 4500 г, ОШ = 6,1), в то же время усиленный рост плода при нормальных уровнях гликемии у матери не связан с увеличением риска гибели плода[22]. Исследование X. Zhang и соавт. показало, что у новорожденных, имеющих вес при рождении 4500–4999 г, риск перинатальной смерти в 2,7 раза выше (95%-ный ДИ: 2,2–3,4), а более 5000 г — в 13 раз выше (95%-ный ДИ: 9,8–17,7), чем при весе 3500–3999 г, тогда как новорожденным с весом при рождении от 4000 до 4499 г не свойственно увеличение риска гибели[23].
Большинство смертей при различных типах СД приходится на долю мертворождения[24]. В нашем исследовании это утверждение оказалось справедливым для групп СД 2 типа и ГСД, где в 50% случаев отмечалась антенатальная гибель плода. По данным S.T. Mackin и соавт., среди матерей с СД 2 типа в структуре перинатальной смертности на долю мертворождения пришлись 81,1%. Треть из них произошла на доношенном сроке, в частности при сроке 39 недель частота мертворождения составила 9,3 (95%-ный ДИ: 2,4–29,2) на 1000 продолжающихся беременностей[4].
Однако среди женщин с СД 1 типа в проведенном нами исследовании преобладала ранняя неонатальная гибель плода (60,0%), что может быть объяснено более тщательным наблюдением за данным контингентом женщин в условиях специализированного центра, наличием инсулинотерапии и регулярного гликемического контроля. Это наблюдение находит подтверждение в работе M. Persson и соавт., где установлено, что для беременных с СД 1 типа более характерны гибель плода в течение первых 7 дней жизни, низкие баллы по шкале Апгар при рождении, паралич Эрба и развитие респираторных нарушений[25].
Дистоция плечиков плода в нашей работе встречалась в единичных случаях, что связано с настороженностью и обученностью персонала специализированного медицинского центра. Однако имеются данные о взаимосвязи между макросомией (ОР = 6,27; 95%-ный ДИ: 2,33–16,88; р < 0,001), необходимостью оперативного родоразрешения (ОР = 9,58; 95%-ный ДИ: 3,70–24,81; р < 0,001) и риском развития дистоции плечиков плода у беременных с СД[26]. Макросомия плода при СД у матери является самым значимым независимым фактором риска развития дистоции плечиков и интранатальной гибели[26].
Прегравидарная подготовка у женщин с прегестационными типами СД позволяет снизить риск формирования врожденных пороков развития плода и перинатальную смертность и должна включать: компенсацию углеводного обмена до зачатия (HbA1c < 6,5%); нормализацию ИМТ; коррекцию сопутствующих заболеваний, обусловленных макро- и микрососудистыми осложнениями СД[13]. Недостаточное употребление фолиевой кислоты и добавок, содержащих метафолин, может быть связано с повышенным риском врожденных дефектов при беременности на фоне СД, в том числе риском развития дефектов нервной трубки[27]. В Кокрейновском систематическом обзоре показано, что прием фолиевой кислоты (≥ 400 мкг/сут) в период до зачатия и во время беременности связан со снижением общего риска формирования дефекта нервной трубки[28]. Уменьшение вероятности формирования spina bifida может положительно повлиять на снижение риска мертворождения среди пациенток с различными типами СД. Согласно данным ВОЗ, прием других витаминов (В6 (пиридоксина), С, Е) не показал своей эффективности и не рекомендован как средство улучшения акушерских и перинатальных исходов3.
Сильной стороной выполненного нами исследования является ретроспективный анализ данных пациенток с различными типами СД за 30 лет в условиях специализированного центра. Определена структура перинатальной смертности при СД и сделано предположение о возможных путях профилактики перинатальных потерь. Однако, поскольку исследование проводилось в одном центре, включало относительно небольшой объем выборки и не учитывало потенциального смешения с другими факторами риска, такими как старший возраст, паритет родов и некоторые различия в тактике ведения пациенток, полученные данные имеют ограничения. В связи с этим требуется проведение дальнейших исследований с бо́льшим объемом выборки и оценкой влияния смешанных факторов риска.
ЗАКЛЮЧЕНИЕ
Наши результаты демонстрируют, что при сопутствующем сахарном диабете (СД) самыми частыми факторами риска гибели плода или новорожденного являются недостаточный контроль гликемии в I триместре, отсутствие прегравидарной подготовки, избыточная масса тела и прегравидарное ожирение, а также хроническая артериальная гипертензия. Немаловажную роль играют и сформировавшиеся акушерские осложнения, такие как преэклампсия, хроническая плацентарная недостаточность с задержкой роста плода и слабость родовой деятельности.
Структура общей перинатальной смертности в ФГБНУ «НИИ АГиР им. Д.О. Отта» была следующей: антенатальная гибель — 16 случаев (38,1%), интранатальная — 7 (16,7%), постнатальная — 19 (45,2%).
Полученные нами данные согласуются с зарубежными исследованиями и свидетельствуют о том, что тщательная прегравидарная подготовка, нормализация ИМТ и консолидированная политика в области сроков и способов родоразрешения являются теми факторами, которые позволят снизить риски перинатальных потерь у женщин с различными типами СД.
Поступила: 15.03.2021
Принята к публикации: 05.04.2021
________
1 United Nations Inter-agency Group for Child Mortality Estimation (UN IGME). A neglected tragedy: The global burden of stillbirths. New York: United Nations Children’s Fund; 2020. URL: https://www.unicef.org/reports/neglected-tragedy-global-burden-of-stillbirths-2020 (дата обращения — 01.04.2021).
2 National Collaborating Centre for Women’s and Children’s Health. Diabetes in pregnancy: management of diabetes and its complications from preconception to the postnatal period. London: National Institute for Health and Care Excellence (UK); 2015. URL: https://www.ncbi.nlm.nih.gov/books/NBK293625/ (дата обращения — 01.04.2021).
3 WHO recommendations on antenatal care for a positive pregnancy experience. Geneva: World Health Organization; 2016. URL: https://apps.who.int/iris/bitstream/handle/10665/250796/9789241549912-eng.pdf;jsessionid=A8FDD0F357C... (дата обращения — 01.04.2021).








